橡胶树胶孢炭疽菌Zn2Cys6型转录因子CgAswA的生物学功能
2021-11-06刘沙玉曹健李蒙柳志强李晓宇
刘沙玉 曹健 李蒙 柳志强 李晓宇
(海南大学生命科学与药学院,海口 570228)
橡胶树作为一种重要的热带经济作物,该树产的橡胶具有良好的绝缘性、弹性、可塑性耐磨等特点,因而被广泛应用于国防、农业、工业、机械制造和医疗卫生等领域[1]。橡胶炭疽病由胶孢炭疽菌(Colletotrichum gloeosporioides)引起,是造成橡胶产量下降的主要原因之一。胶孢炭疽菌通常以菌丝体和分生孢子的形式在果实、叶片和枝干等发病部位进行越冬,条件适宜时,分生孢子可以通过风雨和昆虫落在寄主组织表面,随后孢子萌发形成芽管、附着胞以及侵染钉,使植物发病,导致橡胶产量下降[2-3]。胶孢炭疽菌的寄主范围非常广泛,对不同植物具有多种侵染策略,对该病菌的防治较为困难[4]。因此,了解胶孢炭疽菌相关基因在生长发育及致病过程中的生物学功能,为深入开展胶孢炭疽菌分子致病机制研究和防治提供重要的理论和实践基础。
转录因子在转录调控中可以特异地识别或结合到靶基因调控区的顺式作用元件的核心序列上,参与调控真菌形态发育、寡营养环境适应、胁迫反应和毒素合成等过程,从而调控病原真菌对寄主的侵染[5-7]。根据DNA结合域的空间结构特征,转录因子主要分为4个家族:锌指(zinc finger)、螺旋-环-螺旋(helix-loop-helix,HLH)、螺旋-转角-螺旋(helix-turn-helix,HTH)、碱基亮氨酸拉链(basic leucine zipper,bZIP)。锌指蛋白家族根据其半胱氨酸和组氨酸残基的数目和位置将锌指蛋白分为Cys2His2(C2H2)、Cys4(C4)和Zn2Cys6(C6)三个类群[8]。Zn2Cys6蛋白是真菌中特有的一类转录因子。目前,Zn2Cys6型转录因子在稻瘟病菌[7,9]、灰霉菌[10]、构巢曲霉[11]、禾谷镰刀菌[12]、马尔尼菲青霉[13]和黄曲霉[14]等真菌中得到鉴定,参与调控菌丝生长、孢子萌发、附着胞形成、外界胁迫应答反应、次生代谢产物的形成、色素及毒素的产生和致病性等重要生理过程。然而,目前关于胶孢炭疽菌Zn2Cys6型转录因子的研究较少。本研究从胶孢炭疽菌中克隆出一个Zn2Cys6型转录因子,其与黄曲霉中的aswA基因同源,将该转录因子命名为CgaswA,通过同源重组的方法获得该基因的敲除突变体,并构建其互补株,通过表型分析确定CgaswA的生物学功能。
1 材料与方法
1.1 材料
1.1.1 实验菌株 菌株胶孢炭疽菌(Colletotrichum gloeospo-rioides)野生型菌株由海南大学生命科学与药学院保存。
1.1.2 试剂 RNA提取试剂盒、反转录试剂盒、DNA凝胶回收试剂盒、质粒提取试剂盒、限制性内切酶(EcoRⅠ,HindⅢ,XbaⅠ)及 PCR试剂等均购自 TaKaRa 公司;引物合成和测序均由上海生工生物工程股份有限公司完成;其他试剂均为国产分析纯。
1.1.3 培养基 MM培养基(g/L)葡萄糖 10.0 g、NaNO31.0 g、MgSO40.5 g、K2HPO41.0 g、FeSO40.01 g、KCl 0.5 g、琼脂粉 18.0 g。PDA培养基、CM培养基、LB培养基和Czapek培养基的配方均参照文献[15]。
1.2 方法
1.2.1 CgaswA基因的克隆及序列分析利用 TaKaRa MiniBEST Plant RNA Extraction Kit(TaKaRa,中国)提取胶孢炭疽菌总RNA,采用 PrimeScriptTMII 1st Strand cDNA Synthesis Kit(TaKaRa,中 国)合成 cDNA。以胶孢炭疽菌cDNA为模板,利用引物CgaswAF 和 CgaswAR(表 1)扩 增CgaswA的ORF框,该PCR 产物经切胶回收、连接、转化、鉴定后送上海生工测序公司测序。利用 SMART(http://smart. embl-heidelberg. de/)预测蛋白结构域,从GenBank(http://www.ncbi.nlm.nih.gov)下载不同真菌CgAswA的同源序列。使用Clustal_W进行序列比对,并利用MEGA7.0软件采用邻近相接法(neighbor-joining,NJ)构建系统发育树(No.of Bootstrap:1 000;Model/Method:Poisson model;Rates among Sites:Uniform rates;Gaps/Missing Data Treatment:Complete deletion)。利用NovoPro(https://www.novopro.cn/)预测蛋白质核定位信号。

表1 引物名称及序列Table 1 Primer and sequence
1.2.2 CgaswA基因的敲除和互补 图1为CgaswA基因敲除原理图。参照文献[16]的方法提取胶孢炭疽菌基因组DNA,利用引物CgaswAupF和CgaswAupR,CgaswAdownF和CgaswAdownR(表1)扩增CgaswA基因的上下游序列。将该基因上下游片段回收纯化后依次连接到 pCB1532载体,酶切验证无误,得到敲除载体pKno-CgaswA。将pKno-CgaswA用EcoRⅠ 酶切线性化后,转入胶孢炭疽菌野生型菌株的原生质体中,原生质体的制备及转化方法参照文献[17]。转化子在含有氯嘧磺隆(100 μg/mL)的培养基进行筛选后,提取抗性转化子的基因组,利用3对引物CgaswAF+ CgaswAR、CgaswAUU+PI、CgaswADD+PI1(表1)对 转 化 子 进 行PCR验证,引物的设计位点如图1所示:引物CgaswAF+CgaswAR扩增不出目的条带,而引物CgaswAUU+PI、CgaswADD+PI1 能扩增出目的条带的转化子为阳性转化子。

图1 CgaswA基因的同源重组原理Fig. 1 Homologous recombination principle of the gene CgaswA
以胶孢炭疽菌基因组DNA为模板,利用引物CgaswAhbF和CgaswAhbR扩增CgaswA基因的互补片段,将该片段与潮霉素磷酸转移酶基因(HPT)的DNA片段(来自质粒pCB1003)相连后,连接到pUC18质粒上,得到互补载体pComp-CgaswA。将互补载体转化到CgaswA敲除突变体制备的原生质体中,转化制备方法如上所述。将转化子在含有潮霉素(300 μg/mL)的平板上筛选。以转化子基因组DNA为模板,以CgaswAF 和CgaswAR为引物,进行PCR验证,能扩增出CgaswA基因片段的为互补转化子。
1.2.3 突变体表型分析
1.2.3.1 营养生长和胁迫因子敏感性分析 用直径5 mm的打孔器在活化7 d的野生型菌株、敲除突变株和互补株的菌落边缘打取菌饼,分别接种到PDA、CM、Czapek和MM固体培养基上,每处理设3个重复,28℃培养7 d,测量菌落的直径。
将不同菌株的菌饼接种至含有山梨醇(浓度为1.0 mol/L),甘油(浓度为1.0 mol/L),NaCl(浓度为0.8 mol/L),H2O2(浓度为10 mmol/L)以及 0.01%SDS(sodium dodecyl sulfate,十二烷基硫酸钠)的MM平板上,每处理设3个重复。28℃培养7 d后观察,计算抑制率。
1.2.3.2 分生孢子产量、萌发及附着胞的形成 将野生型菌株、敲除突变株和互补株于PDA平板活化7 d后,用打孔器打取菌落边缘的菌饼接种至PDB培养基中,在28℃,150 r/min下培养2 d后,过滤除菌丝,取滤液7 000 r/min,离心8 min,弃上清,用无菌水洗3次,使用血球计数板统计分生孢子数量。将25 μL孢子悬浮液滴在载玻片上,28℃培养4 h、8 h、12 h后,在显微镜下观察,计算孢子萌发率和附着孢形成率。
1.2.3.3 洋葱表皮和玻璃纸的穿透试验 撕取洋葱内表皮细胞,用无菌水洗3次,然后将其平铺于灭菌的载玻片上。取孢子悬浮液10 μL(浓度为:5×103个/mL)滴于洋葱表皮,28℃培养8 h和12 h后观察附着胞的穿透和侵入,每处理设3个重复。
将玻璃纸平铺在PDA培养基上,取20 μL(浓度为:5×105个/mL)孢子悬浮液和菌饼分别接种于玻璃纸上。28℃培养2 d和3 d,分别揭去玻璃纸,并再培养1 d后观察,每处理设3个重复。
1.2.3.4 致病性分析 (1)活化7 d的野生型菌株、敲除突变体和互补株PDA平板上打取5 mm胶孢炭疽菌菌饼,以有伤的方式接种到离体橡胶叶片表面,28℃保湿,2 d后将菌饼揭去,4 d后观察发病情况,每处理设3个重复。(2)将野生型菌株、敲除突变株和互补株分生孢子悬浮液浓度调至1×106个/mL,取20 μL孢子悬浮液以有伤的方式接种到离体橡胶叶片表面。28℃保湿,5 d后观察发病情况,每个处理设3个重复。
1.2.4 数据处理 实验数据采用Excel 2019进行数据的运算和处理,采用IBM SPSS Statistics 23.0数据处理软件进行单因素试验统计分析。
2 结果
2.1 CgaswA基因的克隆及序列分析
通过PCR扩增获得了CgaswA基因的ORF框,生物信息学分析发现,CgaswA基因ORF框全长2 142 bp(GenBank登 录 号:MW324529),编码蛋白长度713个氨基酸,含有一个GAL4结构域(GAL4-like Zn(II)2Cys6 binuclear cluster DNAbinding domain)、一 个AT_ hook结 构 域(DNA binding domain with preference for A/T rich regions)和一个真菌特异转录因子结构域,为Zn2Cys6型锌指蛋白(图2-A)。CgaswA在GenBank中利用BLASTp工具进行比对,将其在12种不同真菌中的同源蛋白构建系统发育树(图2-B)。CgAswA蛋白在炭疽菌属里比较保守,与C. fructicola(KAF4888992.1)和C. siamense(XP_036493040.1)中的同源蛋白的相似度都在99%以上,此外CgAswA与Verticillium longisporum、Stachybotrys chartarum、Fusarium graminearum、Fusarium oxysporum、Valsa mali和Pyricularia oryzae中同源蛋白的相似度较高,均在48%以上,而与Saccharomyces cerevisiae同源蛋白的相似率较低,仅为26%。经NovoPro预测,CgAswA蛋白在128-143个氨基酸之间有一段核定位信号序列(KQKRPRGRPRKHPLAP),概率为94.6%。

图2 CgAswA蛋白结构域和系统发育树Fig. 2 Protein domain and phylogenetic tree of CgAswA protein
2.2 CgaswA基因的敲除和互补
对基因敲除载体pKno-CgaswA线性化后,转入野生型原生质体中,共得到105个转化子。提取全部转化子基因组,利用CgaswAF+CgaswAR、CgaswAUU+PI、PI1+CgaswADD三对引物(引物的设计位点详见图1)进行3轮PCR验证。结果显示3号、8号和11号转化子利用引物CgaswAF+CgaswAR无法扩增出CgaswA基因ORF框的目的条带,且引物CgaswAUU+PI和PI1+CgaswADD能够扩增出预期大小的目的条带(图3-A和B)。最终确定3号、8号和11号转化子为敲除转化子,分别命名为ΔCgaswA-3、ΔCgaswA-8和ΔCgaswA-11(图3)。
将互补载体pComp-CgaswA转化到已敲除突变株ΔCgaswA-11制得的原生质体中,在含有潮霉素的平板上筛选,共获得32个抗性互补转化子,经PCR验证,发现16号转化子利用引物CgaswAF+CgaswAR可扩增出CgaswA基因ORF框的目的条带,确定其为互补株,命名为ΔCgaswA/aswA(图3-A)。

图3 CgaswA 基因的敲除和互补验证Fig. 3 Verification of CgaswA gene knockout and complementation
2.3 突变体表型分析
2.3.1 CgaswA对胶孢炭疽菌营养生长和胁迫因子的影响 野生型菌株、敲除突变体ΔCgaswA和互补株在4种培养基中的生长情况见图4-A。敲除突变体ΔCgaswA较野生型菌株及互补株生长缓慢,尤其在CZAPEK培养基上,野生型菌株培养7 d的直径为7.93 cm,而突变体的菌落平均直径为6 cm,差异显著(P<0.05),互补株的生长速率与野生型菌株相似(图4-B)。

图4 菌株在4种培养基上生长情况比较Fig. 4 Comparison of strains’ growth on four media
将菌株接至含不同胁迫因子的MM平板上,结果表明,同野生型相比,1.0 mol/L山梨醇,1.0 mol/L甘油,0.8 mol/L NaCl,10 mmol/L H2O2和0.01%SDS对突变体生长的抑制作用并不显著。以上结果说明CgAswA参与调控胶孢炭疽菌的营养生长。
2.3.2 CgaswA突变体的分生孢子产量、萌发及附着胞的形成 与野生型相比,敲除突变株ΔCgaswA产生的分生孢子明显较少,互补株的分生孢子产量与野生型相似(图5-A)。野生型菌株的孢子在4 h萌发率为85.87%,敲除突变体ΔCgaswA在4 h时,孢子的萌发率仅为32.54%,附着胞的形成率也明显低于野生型,只有28.84%;随着时间的延长,12 h时,敲除突变体的孢子萌发率和附着胞的形成率分别增加到71.94%和69.41%(图5-B-C)。从整体上来看,敲除突变体ΔCgaswA的孢子萌发和附着胞的形成较野生型滞后(图5-D)。由此可见,CgAswA参与调控胶孢炭疽菌的分生孢子产生、孢子的萌发和附着胞形成。

图5 野生型、ΔCgaswA与ΔCgaswA/aswA分生孢子的产生、萌发和附着胞的形成Fig. 5 Sporulation,germination and appressorium formation of wild type,ΔCgaswA and ΔCgaswA/aswA
2.3.3 洋葱表皮和玻璃纸穿透试验 为了了解突变体的附着胞是否能进一步发育成侵染结构,在洋葱表皮细胞和玻璃纸上分别进行了穿透试验。由图6-A可以看出,野生型菌株在洋葱表皮细胞上,8 h后附着胞开始分化出侵染结构,12 h后进一步形成明显的侵染菌丝,敲除突变体ΔCgaswA在8 h仅部分附着胞开始分化出侵染结构,12 h虽然大部分附着胞分化出侵染结构,但该侵染结构明显小于野生型,互补株基本能恢复到野生型水平。
在玻璃纸穿透试验中,无论是分生孢子悬液还是菌饼接种,野生型菌株、敲除突变体ΔCgaswA和互补株都能穿透玻璃纸,在2 d形成菌落,但敲除突变体ΔCgaswA形成的菌落比野生型小,互补株与野生型菌株无显著差异(图6-B)。以上结果表明,CgAswA参与调控胶孢炭疽菌的侵入过程。
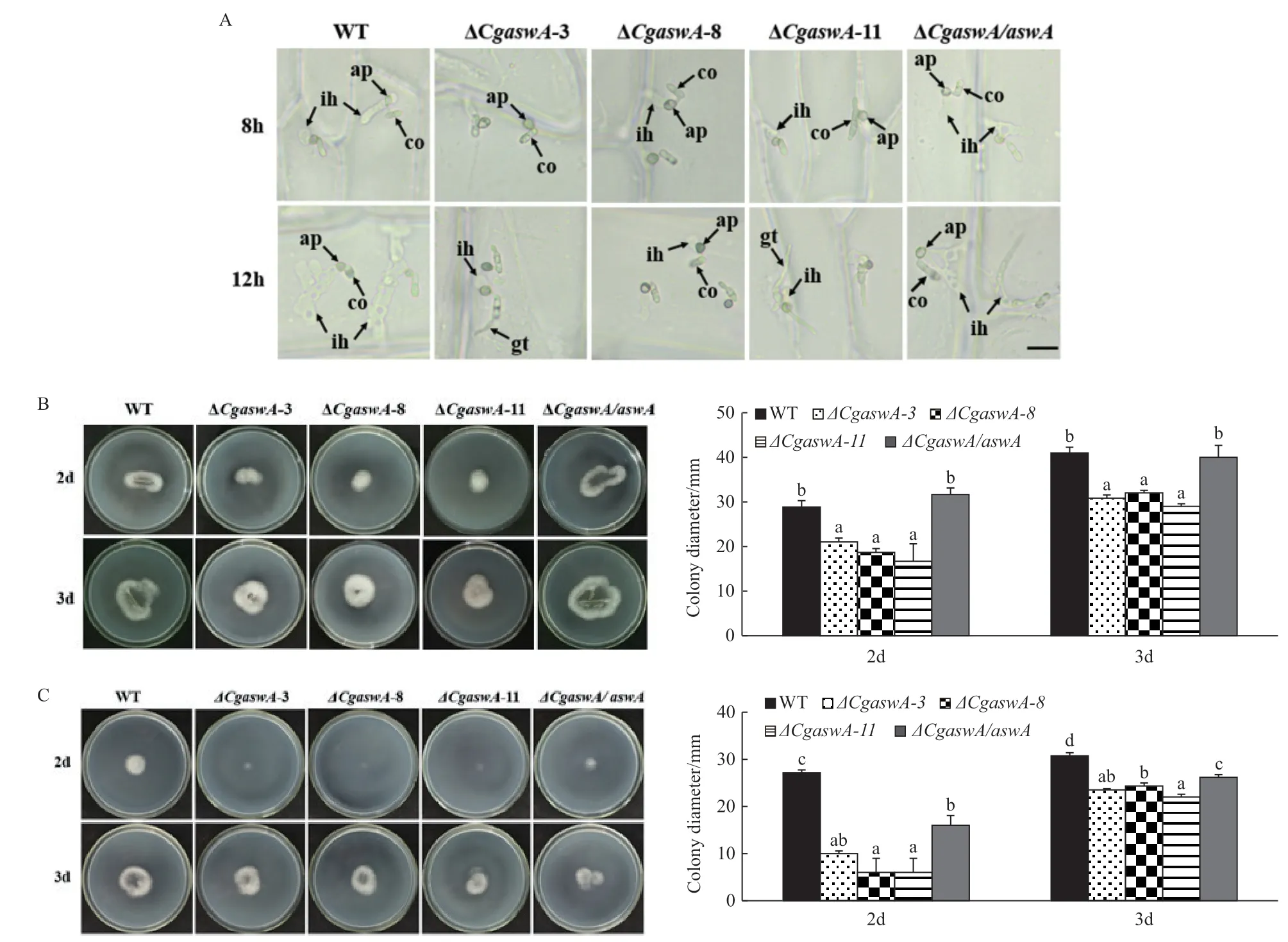
图6 洋葱表皮侵染和玻璃纸穿透试验Fig. 6 Onion epidermis infection and cellophane penetration assays
2.3.4 致病性分析 将野生型菌株、敲除突变株ΔCgaswA与互补株ΔCgaswA/aswA的菌饼和孢子悬浮液分别接种到有伤的离体橡胶树叶片上。敲除突变体ΔCgaswA形成的病斑明显小于野生型,其致病力明显减弱,互补株ΔCgaswA/aswA基本可以恢复到野生型水平(图7)。此结果说明CgAswA参与调控胶孢炭疽菌的致病力。
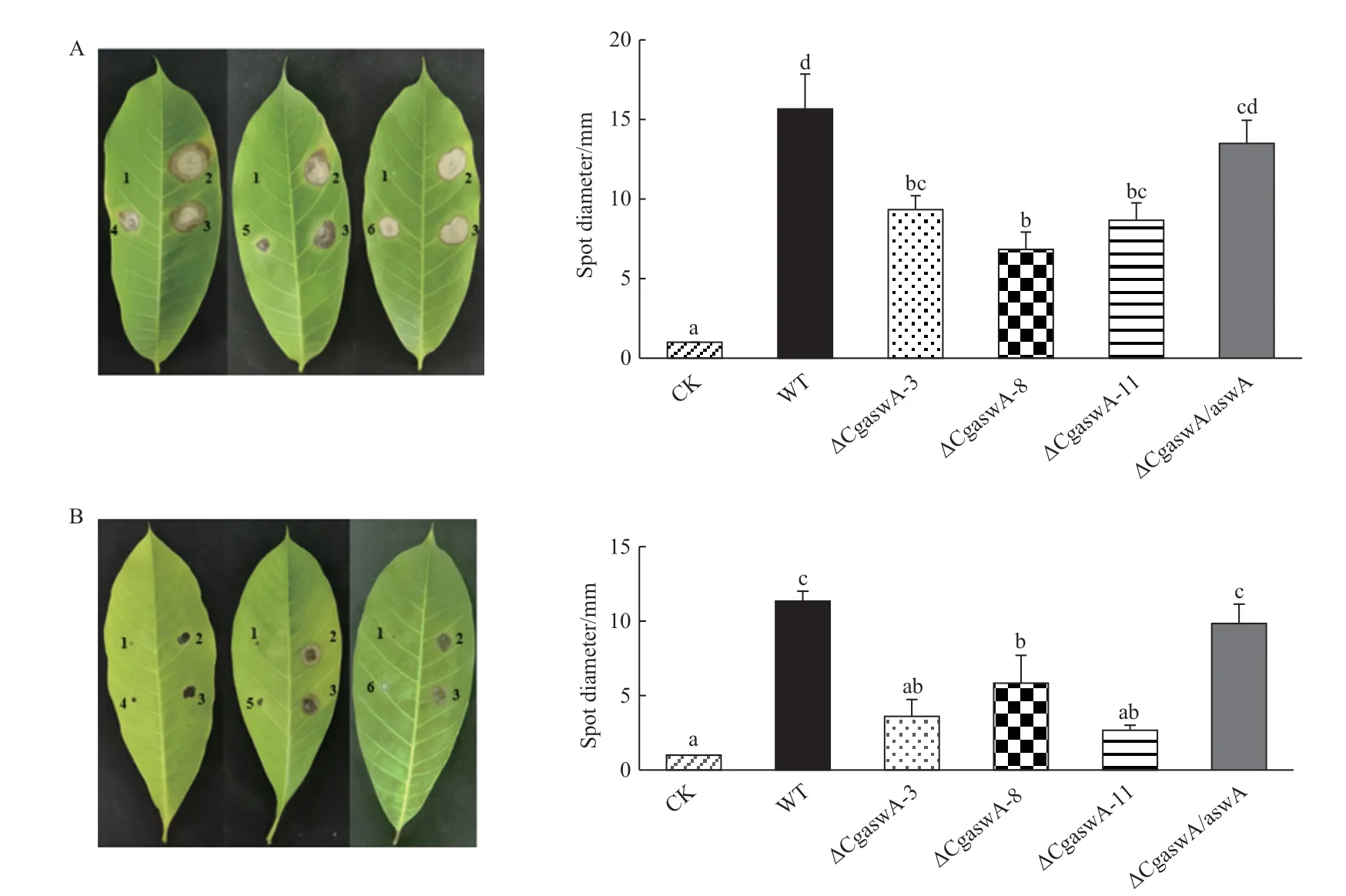
图7 野生型、ΔCgaswA与ΔCgaswA/aswA致病性分析Fig. 7 Pathogenicity analyses of wild type,ΔCgaswA and ΔCgaswA/aswA
3 讨论
转录因子在调控真菌生长发育及致病过程中起着重要的作用。本研究从胶孢炭疽菌中鉴定了一个Zn2Cys6型转录因子CgAswA,获得其敲除突变株ΔCgaswA。ΔCgaswA在Czapek和MM培养基上生长速率明显低于野生型,孢子产量显著低于野生型菌株,孢子萌发和附着胞形成较野生型滞后。在洋葱表皮和玻璃纸上,突变株孢子形成的侵染结构较野生型延迟,且穿透能力明显减弱,在橡胶叶片上致病力也减弱。目前关于CgaswA同源基因功能的研究较少,仅在曲霉中有报道。在黄曲霉中,CgaswA的同源基因aswA参与调节菌核发育,同时影响菌核中特异性代谢物的生物合成和积累[14]。在构巢曲霉中,aswA的同源基因是oefC(over-expressed fluffy),该基因过量表达时,形成大量的气生菌丝,但对于该基因是否参与无性产孢等生理过程,并未有报道[18]。
研究发现,Zn2Cys6型转录因子在不同真菌中的功能并不保守,此类转录因子在进化过程中功能不断分化,参与调控不同的生长发育过程[19]。在禾谷镰刀菌中,EBR1参与调控菌丝生长、分生孢子的产生、萌发和致病性[12]。RosA和NosA是构巢曲霉有性发育的负调控因子,过表达RosA导致菌丝生长减少,且RosA可抑制NosA的表达[20-21]。在大丽轮枝菌中,VdFTF1参与调控细胞壁降解酶相关基因的表达,进而影响其致病性[22]。在稻瘟病菌中,GCC1、GPF1和GTA1参与调控菌丝生长,其中敲除突变体Δgpf1完全丧失对水稻的致病能力[23]。在梨树腐烂病菌中,VpPf2不影响该病菌的生长、菌丝形态和分生孢子形成,但参与调控细胞壁的完整性与致病性[24]。
在胶孢炭疽菌中,也有一些转录因子得到研究。bZIP型转录因子CgAP1参与调控该菌的氧化应激反应和致病力[25]。C2H2型转录因子pacC作为一种重要的pH调节因子,调控许多在碱性条件下表达的致病基因[26-27]。C2H2型转录因子CgAzf1参与调控黑色素的合成、分生孢子发育和致病力[28]。SltA和CrzA也是C2H2型转录因子,其中SltA参与调控胶孢炭疽菌附着胞的形成及致病性,而CrzA参与调控生长,分生孢子的产生和萌发,附着胞的形成和致病性[29]。本文所研究的Zn2Cys6型转录因子CgAswA参与调控营养生长、分生孢子发育和致病力,这将为胶孢炭疽菌中Zn2Cys6型转录因子的功能研究添加新的内容,同时也为深入认识该病原菌致病的分子机理奠定一定的基础。
4 结论
在胶孢炭疽菌中,CgAswA是一个Zn2Cys6型转录因子,参与调控该病原菌的营养生长、分生孢子的产生和萌发、附着胞的形成、侵入及致病性。
