3种海参脱腥方法的效果比较研究
2021-11-06石友盛谢文强陈贤功胡晓苹
石友盛,谢文强,陈贤功,胡晓苹
(海南大学食品科学与工程学院,海南海口570228)
中国、日本、韩国、新加坡、马来西亚、菲律宾等国将海参视为珍贵海鲜,一方面是海参脂肪含量低,蛋白含量高且富含如色氨酸、精氨酸、赖氨酸等必需氨基酸;另一方面海参含有海参多糖、海参皂苷、海参胶原蛋白、海参多肽及脂类等多种对人体具有抗肿瘤、抗氧化、免疫调节、抗菌、抗病毒、降血糖及抗凝血等功效的生物活性物质[1-2]。目前,我国的海参养殖场数量众多,特别是大连渤海湾地区[1]。海参多分布于海南,而且因其自然条件非常适合海参的生长、繁殖,海参生长速度快,养殖成本相对较低。近年来,除了在凉爽的渤海湾地区有海参养殖外,海南已有一定规模的海参和花刺参等品种的人工养殖。目前,关于海参的研究多集中在海参品种的生物学特性、营养品质和海参生理活性物质的分析、海参养殖技术的探索、海参废弃物产品的开发等[3-7]。
近年来,随着人们生活水平的提高,海参已从馈赠珍品逐渐走上了大众餐桌。一方面,人们非常重视海参对人体的多种功效;另一方面,现代的快节奏生活带动了海参即食产品的开发生产。但是,海参特殊的腥味影响了海参即食产品及海参其它相关加工产品的发展。
日常人们多采用姜、大蒜等佐料来掩盖海参的腥味,但无法从根本上去除海参的腥味,而目前针对海参脱腥的研究较少。如利用碳酸氢钠粉和草木灰内的碳酸钾,去除海参表面的腥味以及黏稠物,从而达到对海参全方位去腥味的效果,并在蒸煮过程中加入含有茶叶和菊花瓣的调制品[8];还有的海参脱腥方法是将海参捕捞后,放在养殖池中进行暂养,将海参剖肠后煮制,将水煮后的海参于茶多酚溶液中浸泡,并用饱和盐水盐渍,最后将盐渍后的海参冷冻储存[9];本课题组前期提出了针对海参的物理法(减压处理)、物理-化学法(减压同时经茶及氯化钙浸泡处理)、物理-化学-微生物发酵法(减压同时经茶及氯化钙浸泡处理后再经乳酸菌发酵处理)3种脱腥方法[10]。但是,海参脱腥方法脱腥效果的客观评价则鲜有报道。
本文基于气相色谱质谱联用技术及电子鼻技术,对3种脱腥方法处理后的海参气味进行分析,以量化各处理方法的脱腥效果。另外,经过减压处理后,海参的质构会发生较大变化,因此采用了全质构分析,即模拟口腔咀嚼动作的二次压缩试验,对经3种不同脱腥方法处理后的海参质构特性进行研究。本研究对海参脱腥效果进行了客观的比较研究,为改善海参的食用品质,更好地开发海参即食产品提供了理论依据。
1 材料与方法
1.1 材料与试剂
海参:海南龙胆渔业开发有限公司海参养殖基地。海参打捞后,尽快剖肠、煮制、冰存运送至实验室,再放入-20℃冰箱中贮存备用;红茶:市售。
氯化钙(分析纯):广州化学试剂厂;HNU082植物乳杆菌:海南大学食品科学与工程学院热带有益微生物菌种资源库;MRS肉汤培养基:北京索莱宝科技有限公司;C7~C40正构烷烃混合标准品:美国o2si smart solutions公司。
1.2 仪器与设备
AUW220A型电子天平:厦门群隆仪器有限公司;Master-S15 UVF型超纯水机:上海和泰仪器有限公司;TA-XT2i型全质构分析仪:英国SMS公司;SHZ-D型循环水式真空泵:巩义市予华仪器有限责任公司;T150-II型塑料真空干燥器:天津尼克仪器有限公司;HH-4型数显恒温水浴锅:上海皓庄仪器有限公司;PEN3型电子鼻:德国Airsense公司;7890A-5975C型气相色谱质谱联用仪:美国 Agilent公司;50/30 μm DVB/CAR/PDMS萃取头的固相微萃取装置:美国Sigma-Aldrich公司。
1.3 方法
1.3.1 海参的脱腥处理
物理法脱腥:称取10 g海参块(长约10 cm)置于真空度达到0.05 MPa~0.1 MPa的真空干燥器中处理40 min;物理-化学法脱腥:85℃煮制红茶(3 g/100 mL)30 min,冷却后将茶叶捞出,再加入2.5 g CaCl2以制备浓度为2.5%的CaCl2-茶混合液,然后将10 g海参块(长约10 cm)浸泡于上述混合液中,再置于真空度达到0.05MPa~0.1MPa的真空干燥器中处理40 min;物理-化学-微生物发酵法脱腥:经物理-化学法处理后的海参再按1∶2(g/mL)料液比完全浸没于菌浓度为6.0×107CFU/mL的HUN082植物乳杆菌MRS肉汤培养基中,于37℃的培养箱中培养1 h。
1.3.2 即食海参的制备
将经物理法、物理-化学法及物理-化学-微生物发酵法脱腥处理过的海参块及未经脱腥处理的海参块用蒸馏水冲洗3次,然后蒸煮1 h后冷却至室温(24℃~26℃),即制得即食海参。
1.3.3 顶空固相微萃取法测定挥发性物质
取经3种脱腥方法处理及未经脱腥处理的即食海参10 g(精确至0.001 g)置于100 mL顶空瓶中,于70℃水浴下平衡20 min,将经过老化处理的50/30 μm DVB/CAR/PDMS萃取头的固相微萃取(solid-phase microextraction,SPME)装置手动直接插入样品瓶中吸附60 min,然后将手动SPME装置插入气相色谱(gas chromatography,GC)进样口,250 ℃解吸附 3.0 min,同时启动气相色谱质谱联用(gas chromatography-mass spectrometry,GC-MS)仪收集数据。
1.3.4 GC-MS测定
参照Wang等[11]的方法并作适当调整。色谱条件:采用HP-5MS石英毛细管柱(30 m×0.25 mm,0.25 μm),进样口温度250℃,氦气(纯度≥99.999%)为载气,载气流速1.0 mL/min,不分流模式进样。升温程序:初始温度60℃,以2℃/min升至180℃,再以10℃/min升至250℃,保持3 min,总运行时间为70 min。质谱条件:电离子方式为电子轰击(electron impact,EI)离子源,电离能量70 eV,离子源温度230℃,四极杆温度150℃,发射电流35 μA,转接口温度280℃,质量扫描范围 m/z 40~1 000。
在GC-MS分析时,采用了C7~C40混合标准品计算样品中各挥发性物质的相对保留时间即保留指数(retention index,RI)。采用RI及参考NIST库进行物质的定性分析,相似度高于700的峰用于定量分析。采用峰面积归一化法来对挥发性物质半定量,以相对百分含量形式表示。
1.3.5 电子鼻测定
本研究中使用的电子鼻设备具有10个传感器,分别为WIC(对芳香成分敏感)、W5S(对氮氧化物敏感)、W3C(对氨水、芳香类化合物敏感)、W6S(对氢气有选择性)、W5C(对烷烃、芳香类化合物及极性小的化合物敏感)、W1S(对甲烷敏感)、W1W(对硫化物、含硫有机化合物敏感)、W2S(对乙醇及部分芳香族化合物敏感)、W2W(对芳香族化合物、有机硫化物敏感)、W3S(对烷烃敏感)[12]。
参照Wang等[13]的方法并作适当调整,采用电子鼻对海参的挥发性物质进行测定。经3种脱腥方法处理及未经脱腥处理的10 g(精确至0.001 g)海参分别置于200 mL烧杯中,用双层薄膜密封,于室温(24℃~26℃)静置30 min,用电子鼻重复测定20次,每次采样时间均为80 s,采样时间间隔1 s/组,传感器自动清洗时间60 s,传感器归零时间8 s。
1.3.6 全质构分析
参照李莹等[14]的方法并做适当调整,选用P/36R探头,测前速度为3 mm/s,测试速度1 mm/s,测后速度2 mm/s,触发力30 g,测定时间间隔5 s,压缩比75%。选择硬度、黏附性、内聚性、弹性、咀嚼性和回复性为指标,每组样品平行测量3次计算平均值。
1.4 数据处理
全质构分析数据结果用平均值±标准差形式表示,用SPSS 24.0对数据进行统计分析,采用单因素方差分析(one-way-ANOVA)及Duncan法进行多重比较。电子鼻数据采用SIMCA 14.1进行主成分分析(principal component analysis,PCA)。
2 结果与分析
2.1 基于GC-MS的海参气味分析
经3种方法脱腥处理及未经脱腥处理海参的挥发性物质组成结果见表1。
如表1所示,检测到的挥发性物质分为七大类共39种,其中醛类10种、醇类13种、芳香族类9种、呋喃类3种、酮类1种、酯类1种、其它2种。醛类中的反-2-己烯醛,醇类中的1-丁醇、(E)-2-戊烯-1-醇、1-辛烯-3-醇,芳香族类中的苯甲醛、苯酚、苯甲醇,酮类中的2-辛酮以及其它类的(E)-2-癸烯共9种物质经3种脱腥方法处理后挥发性物质相对含量均有明显减少,有些经脱腥处理后,海参样品中检测不出该物质。通过比较这些物质在各组样品中的相对含量可知,物理-化学法和物理-化学-微生物发酵法的脱腥效果优于物理法。
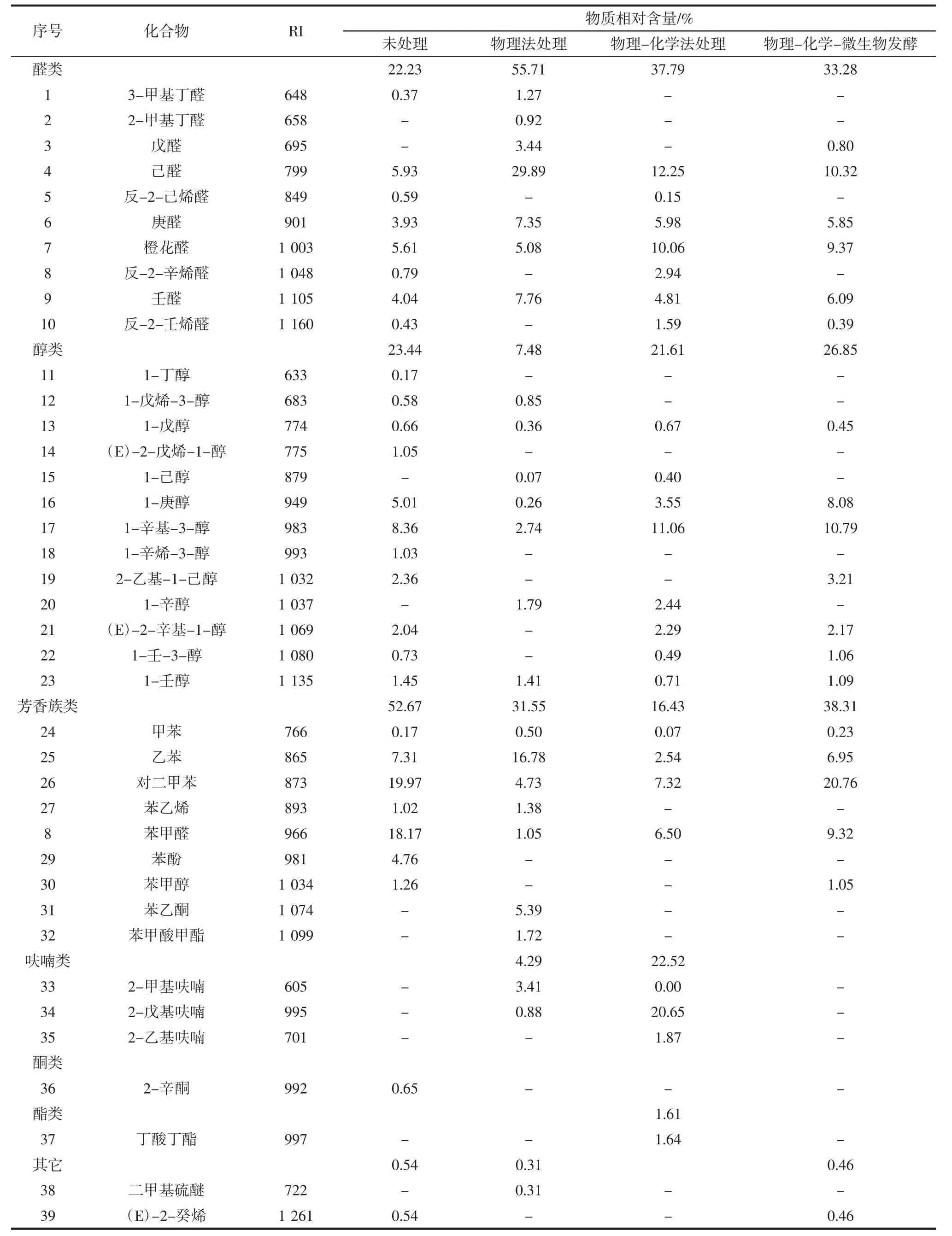
表1 经3种方法脱腥处理及未经处理海参的挥发性物质组成Table 1 Volatile substances composition of deodorization treated and non-treated sea cucumbers
本研究结果与已有研究报道基本一致,即水产品中的挥发性物质主要包括醇类、醛类、酮类、烃类及少量的呋喃类、硫醚、萘等物质,这些挥发性物质是水产品的主要腥味物质[15]。分子量低的醛类,尤其是己醛,它们的阈值低,通常会使鱼类产生一些令人不愉悦的气味[16]。Hirano等[17]和Fukami等[18]认为水产品中那些令人难以接受的气味物质,主要是C4~C7的低分子量醛、醇、酮类物质,如丁醛、1-戊烯-3-酮、己醛、反-4庚醛、顺-3-己醇等。由此推测本研究中海参的主要腥味物质为反-2-辛烯醛、反-2-己烯醛、1-丁醇、(E)-2-戊烯-1-醇、1-辛烯-3-醇。
2.2 基于电子鼻的海参气味分析
采用PEN3型电子鼻,对经3种脱腥方法处理及未经脱腥处理的海参整体气味进行比较分析,并绘制雷达图,结果如图1所示。

图1 经3种方法脱腥处理及未经脱腥处理海参的电子鼻雷达图Fig.1 Radar plot of electronic nose analysis of deodorization treated and non-treated sea cucumbers
由图1可见,海参经3种脱腥方法处理后,W2W、W3S、W3C、W6S和W5C这5个传感器响应值几乎与未处理海参的一致。而经物理-化学法和物理-化学-微生物发酵法处理的海参的W1W响应值较未处理及物理法处理有很大程度的提高。这可能是红茶的某些气味物质进入海参样品的原因。经3种脱腥方法处理海参的W1C和W5S响应值较未处理海参有少许提高。然而3种脱腥方法处理海参的W1S和W2S响应值较未处理海参有较大程度的降低,并且物理法处理的下降幅度小于物理-化学法和物理-化学-微生物发酵法处理。此结果与GC-MS结果一致。
为比较3种脱腥方法的效果,对电子鼻结果进行了主成分分析,结果如图2所示。
由图2a可见,未经脱腥处理与经3种脱腥方法处理后的海参在整体风味上存在明显差异,可与之区分开;物理法处理的与另两种方法处理后的海参风味也存在较大差异,可与之区分开;而经物理-化学法和物理-化学-微生物发酵法处理的海参在整体风味上比较相似,不能区分开。
由图2b可见,未经脱腥处理和经物理法处理海参的W1S、W2S、W3S这3个感应器上的响应值较大,而经物理-化学法处理和物理-化学-微生物发酵法处理海参的W1W、W5S、W1C、W3C和W5C这5个感应器上的响应值较大。此结果与电子鼻雷达图揭示的各脱腥方法处理后海参样品的各感应器响应值差异情况相一致。

图2 经3种方法脱腥处理及未经脱腥处理海参的电子鼻PCA分析Fig.2 PCA analysis plots of electronic nose analysis of deodorization treated and non-treated sea cucumbers
2.3 经3种脱腥方法处理的即食海参质构特性参数的显著性差异分析
经物理法、物理-化学法及物理-化学-微生物发酵法处理及未经脱腥处理的即食海参全质构分析(texture profile analysis,TPA)结果如表2所示。
在TPA分析中,硬度是指使物体达到变形所需要的最大力[19]。弹性是发生变形样品除去形变力后恢复到变形前条件下的高度或体积比[20]。而咀嚼性是指将半固体样品咀嚼成吞咽时的稳定状态所需能量[21]。回复性是指变形样品在导致形变同样速度、压力下回复的程度[22]。
由表2可见,经物理法和物理-化学-微生物发酵法处理的即食海参的各质构参数(除硬度外)均无显著性差异,且相较于物理-化学法脱腥处理方式,这两种脱腥处理方式与未经脱腥处理的即食海参质构各参数更为接近;然而经物理-化学法处理的即食海参其硬度、弹性、内聚力、咀嚼性、回复性都显著高于另两种处理(p<0.05)。
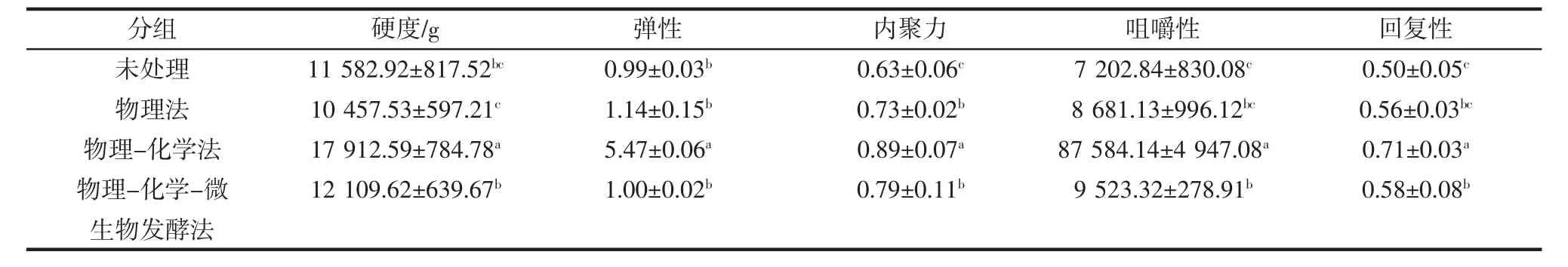
表2 经3种方法脱腥处理及未经处理海参的质构特性比较Table 2 Comparison of texture characteristics of deodorization treated and non-treated sea cucumbers
物理-化学法虽然能极大程度地脱除海参腥味,但是会增加海参的硬度,不适合食用;物理法脱腥处理制备的即食海参,腥味脱除不完全但软硬适宜;而物理-化学-微生物发酵脱腥处理一方面可有效去除腥味,另一方面制得的即食海参软硬合适。
3 结论
海参的腥味物质组成极其复杂,往往是多种物质共同作用的结果。经3种脱腥方法处理后的海参与未经脱腥处理的海参相比,反-2-己烯醛、(E)-2-癸烯、1-丁醇、(E)-2-戊烯-1-醇、1-辛烯-3-醇、苯甲醛、苯酚、苯甲醇、2-辛酮这9种物质的相对含量明显降低,有的物质在经脱腥处理后未检出,综合来看,物理法的脱腥效果较另两种稍差。经3种脱腥方法处理与未经脱腥处理的海参在整体风味上也存在明显差异,经过3种脱腥处理的海参在W1S和W2S的响应值较未经脱腥处理海参有较大程度降低。整体来看,物理-化学法和物理-化学-微生物发酵法脱腥效果接近,优于物理法的脱腥效果。另外,经物理-化学法脱腥处理后制备的即食海参太硬不宜食用,而物理-化学-微生物发酵法处理后制备的即食海参软硬合适。由此物理-化学-微生物发酵法脱腥处理后制备的即食海参具有较好的品质。
