小分子酪氨酸激酶抑制剂联合程序性死亡受体-1单抗治疗晚期消化系统恶性肿瘤的疗效评价
2021-11-06米智慧曲晶磊曲秀娟
米智慧, 曲晶磊, 曲秀娟, 滕 赞, 陈 颖, 宋 娜
(中国医科大学附属第一医院 肿瘤内科, 辽宁 沈阳, 110001)
研究[1]报告了截至2020年时,结直肠癌(9.40%)、肝癌(8.30%)、胃癌(7.70%)等已成为继肺癌后导致死亡的主要原因,而目前恶性肿瘤的治疗方案主要包括手术、放化疗、介入治疗、靶向治疗及免疫治疗等多种方法,但疗效不尽如人意。免疫检查点抑制剂(ICIs)的应用改善了包括消化系统恶性肿瘤在内的多种恶性肿瘤患者的预后[2],其起效较慢,但作用时间持久。研究[3]表明小分子酪氨酸激酶抑制剂(TKI)类药物能够改善肿瘤微环境,促进肿瘤CD8+T淋巴细胞的浸润,解除恶性肿瘤的免疫抑制状态,从而增强ICIs药物的疗效。程序性死亡受体-1(PD-1)是一种重要的免疫抑制分子,通过向下调节免疫系统对人体细胞的反应,以及通过抑制T细胞炎症活动来调节免疫系统并促进自身耐受。目前, TKI联合PD-1单抗治疗恶性肿瘤的研究多为Ⅰ期及Ⅱ期临床试验,而对于真实世界中联合治疗的疗效及安全性研究仍较少。本研究评估小分子TKI联合PD-1单抗治疗晚期消化系统恶性肿瘤的安全性和有效性,现将结果报告如下。
1 资料与方法
1.1 一般资料
收集2019年3月—2021年2月在中国医科大学附属第一医院肿瘤内科接受小分子TKI联合PD-1单抗治疗的晚期消化系统恶性肿瘤患者的临床资料。纳入标准: ① 年龄≥18岁者; ② 病理或临床诊断为消化系统恶性肿瘤者; ③ 至少有1次影像学评价者; ④ ≥1个可测量病灶者; ⑤ 充分的脏器储备功能; ⑥ 病历资料及随访记录完整者。最终30例患者纳入本研究,中位年龄为57岁; 男21例,女9例; 美国东部肿瘤协作组(ECOG)评分1分28例, ≥2分2例; 胃癌3例,肠癌13例,肝癌8例,胰腺癌4例,食管癌2例; 既往经历全身二线治疗8例,三线治疗12例,三线以上治疗10例; 肝转移21例,非肝转移9例。30例患者中, 23例患者可获得微卫星状态,其中1例为高频度微卫星不稳定(MSI-H), 其余22例为低频度微卫星不稳定(MSI-L); 16例可获得程序性死亡受体-配体1(PD-L1)阳性联合分数(CPS), 其中9例CPS<1, 5例CPS≥1, 2例CPS≥10; 21例可获得肿瘤突变负荷(TMB), 中位TMB 8突变/Mb(2.28, 17.20), 见表1。TMB被定义为每百万碱基(Mb)中被检测出的体细胞基因编码错误、碱基替换、基因插入或缺失错误的总数。

表1 30例患者的基本临床特征[ n(%)]
1.2 方法
纳入研究的30例患者均接受了TKI联合PD-1单抗治疗,并在治疗前完善血常规、血生化、肿瘤标志物、甲状腺功能、肺部及腹部计算机断层扫描(CT)等相关检查,用药期间定期监测血压、血常规、血生化及肿瘤标志物等,定期进行影像学评估,直至出现疾病进展或不可耐受的毒副反应。
1.3 疗效及不良反应评价
主要研究终点为中位无进展生存期(PFS)和疾病控制率(DCR), 次要研究终点为客观缓解率(ORR)及安全性。根据实体肿瘤标准RECIST 1.1评价客观有效率,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD), ORR=(CR+PR)/总例数×100%, DCR=(CR+PR+SD)/总例数×100%。不良反应根据不良事件常用术语标准(NCI-CTCAE 5.0版)进行分级。
1.4 统计学方法
采用 SPSS 24.0统计学软件对数据进行统计分析,计数资料采用率表示,组间比较采用χ2检验,检验水准α=0.05, 生存分析采用Kaplan-Meier法,采用描述性方法进行安全性分析。P<0.05为差异有统计学意义。
2 结 果
2.1 疗效评价
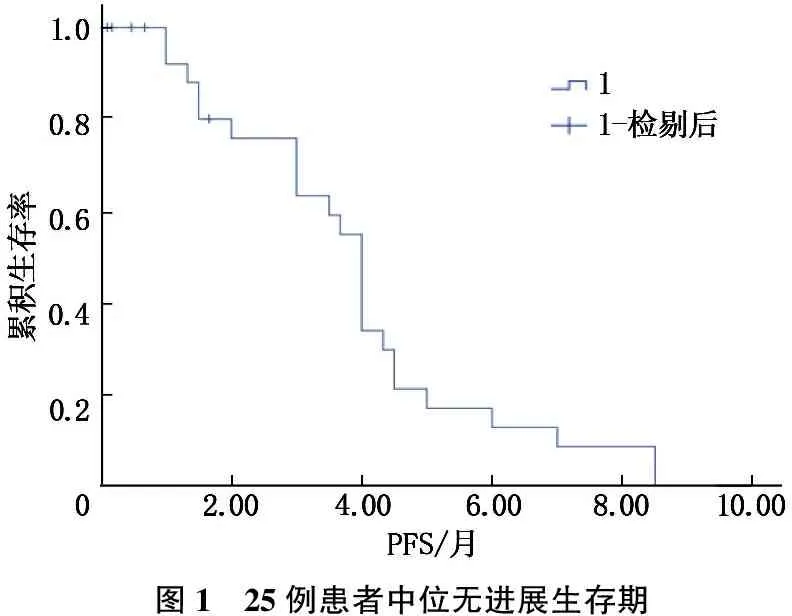
有5例患者因用药早期即无法耐受不良事件(AE)停药而未完成疗效评价,其他25例可评价疗效的患者中,胃癌2例,肠癌10例,肝癌8例,胰腺癌3例,食管癌2例。25例患者疗效评价结果显示, CR 0例, PR 6例(胰腺癌1例,肝癌4例,食管癌1例), SD 14例(肠癌7例,肝癌4例,胰腺癌2例,食管癌1例), PD 5例(胃癌2例,肠癌3例), ORR为24.00%, DCR为80.00%, 中位PFS为3.99个月(95%CI为3.07~4.72), 其中5例患者仍在持续治疗中。见图1。
进一步分析显示, 12例胃癌及肠癌患者ORR为0%, DCR为58.33%(7/12); 8例肝癌患者ORR为50.00%(4/8), DCR为100.00%(8/8); 3例胰腺癌患者ORR为33.33%(1/3), DCR为100.00%(3/3); 2例食管癌患者ORR为50.00%(1/2), DCR为100.00%(3/3)。见图2。
2.2 疗效与肿瘤生长速率(TGR)的相关性分析
TGR=100(D0-D-1)/D-1(CT0-CT-1), 其中CT0是在治疗期间确定疾病进展的CT日期, CT-1是CT0之前的CT日期, Dn是CTn靶病灶直径的总和。TGR截止值定义为TGR中位数,为0.741%/d。根据TGR和治疗前有无新发病灶(NL)将患者分为慢生长(SG)组和快生长(RG)组,其中SG为NL-或低TGR(<0.741%/d), RG为NL+或高TGR(≥0.741%/d)。见图3。


共有24例患者可计算TGR, 将TGR与治疗疗效进行分析,通过Fisher检验发现RG组(n=12)与SG组(n=12)的疗效差异有统计学意义(P=0.037)。以肿瘤是否得到控制将RG组和SG组患者再细分,其中SG组疗效达到PR及SD的患者12例, RG组中达到PR及SD的患者7例; SG组中PD患者0例, RG组中PD患者5例。生存分析发现, SG组的中位PFS为4.72个月,高于RG组的3.53个月; SG组的ORR为23.08%, 高于RG的18.18%。见图4。
2.3 安全性分析
对30例患者进行安全性分析, AE的总发生率为90.00%(27/30), 大多数不良反应为Ⅰ~Ⅱ级,对症治疗后均有好转。无治疗相关性死亡,总体不良反应可控。见表2。将潜在的不良反应如未发现替代病因(如疾病进展、合并用药及感染)且需要采用糖皮质激素和/或其他免疫抑制剂治疗(除外内分泌事件如甲状腺功能亢进/减退、垂体炎、1型糖尿病和肾上腺功能不全可能不会采取免疫抑制治疗,但仍认为与PD-1单抗引起的自身免疫功能亢进有关)定义为免疫相关不良反应(irAEs)。根据上述定义,本研究共有6例患者发生irAEs。将是否发生irAEs与近期疗效进行相关性分析,结果提示差异有统计学意义(P<0.05)。
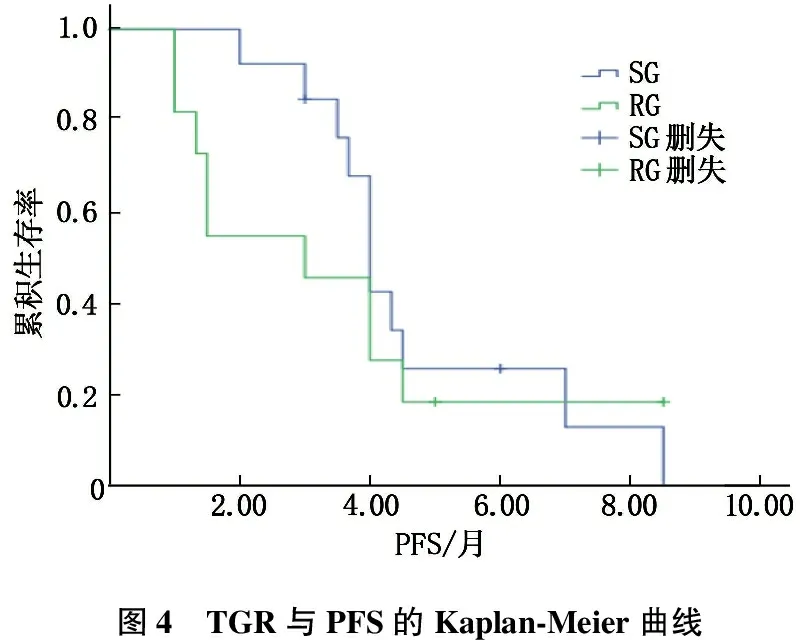
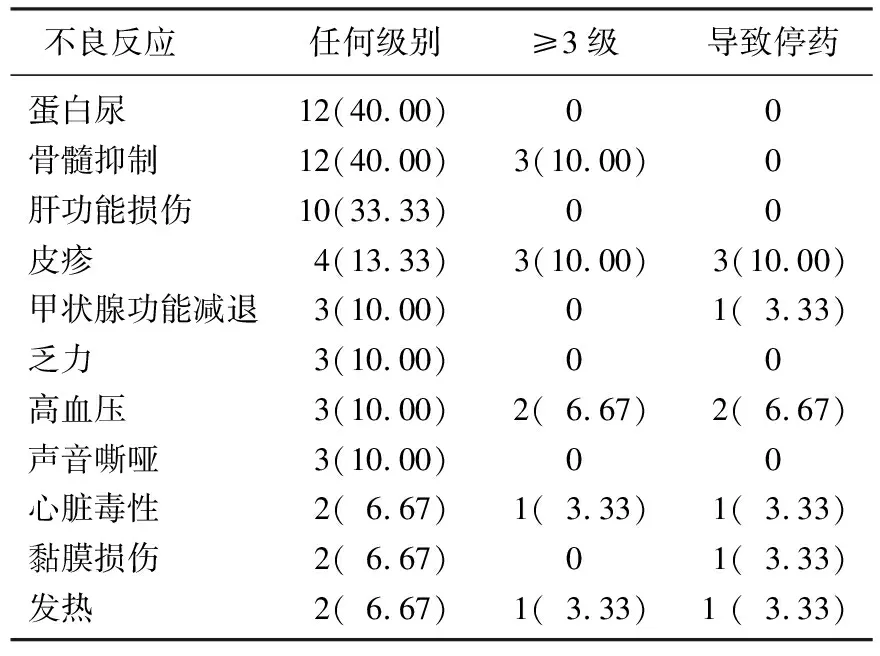
表2 30例患者治疗相关不良反应[ n(%)]
3 讨 论
目前国内已批准的用于消化系统恶性肿瘤的PD-1单抗包括纳武利尤单抗及卡瑞利珠单抗。一项纳武利尤单抗对比伊立替康治疗晚期胃癌疗效及TGR对肿瘤应答影响的回顾性研究[4]报告显示,肿瘤生长较慢的患者对纳武利尤单抗治疗的应答更佳。REGONIVO研究[5]报告了微卫星稳定型转移性结直肠癌患者对瑞戈非尼联合纳武利尤单抗治疗表现出了较高的应答率,总体ORR达40.00%, 该研究中胃癌的ORR达44.00%。另外一项仑伐替尼联合帕博利珠单抗治疗既往治疗失败的胃癌、结直肠癌(非MSI-H/pMMR)及胆管癌等患者的疗效与安全性的II期、单臂、开放的临床试验[6]报告了其ORR为10.00%~32.00%, 且不良反应可控。一项SHR-1210联合阿帕替尼治疗晚期肝癌、胃癌/胃食管结合部癌的IA/IB期研究[7]共纳入了43例患者, 39例可评估疗效患者的总体ORR为30.80%, 其中8例(44.40%)肝癌患者、5例(20.00%)胃癌/胃食管结合部癌患者疾病达PR, 7例(38.90%)肝癌患者、13例(52.00%)胃癌/胃食管交界处癌患者疾病达SD, 晚期胃癌/胃食管交界处癌的治疗耐受性良好,但应答率不如肝癌。
肿瘤血管生成是肿瘤生长、浸润和转移的关键因素[8], 与正常组织的血管不同,高度异常的肿瘤血管[9]通过减少免疫细胞的浸润产生免疫抑制,从而限制了免疫治疗的疗效[10]。因此,促使肿瘤血管正常化对于提高恶性肿瘤治疗疗效尤为重要。一方面,TKI类药物作用于血管内皮细胞生长因子受体(VEGFR)酪氨酸激酶,阻断VEGFR信号传导,抑制肿瘤血管生成,逆转VEGF导致的免疫抑制[11]; 另一方面,该类药物可以促进CD8+T细胞的浸润,提高免疫治疗的疗效[12]。上述作用机制为免疫治疗联合抗血管生成靶向药物治疗恶性肿瘤提供了理论基础。
临床前研究[13]也证实,在结直肠恶性肿瘤模型中,瑞戈非尼及PD-1单抗均能够抑制MC38肿瘤的生长,而联合治疗或者在应用PD-1单抗后应用瑞戈非尼均能显著增强抑制肿瘤生长作用,表明两药之间存在协同效应。一项关于瑞戈非尼联合纳武利尤单抗或帕博利珠单抗治疗18例微卫星稳定型的转移性肠癌的回顾性研究[14]结果提示, 13例(72.20%)患者出现PD, 5例患者(27.78%) SD, 中位PFS为2.00个月。本研究结果显示,联合用药在转移性胃癌及肠癌的疗效与上述回顾性研究类似,但与REGONIVO研究[5]的高应答率存在显著差异。对比基线特征发现, REGONIVO研究入组患者具有以下特点: ① 体能状态较好,98.00%患者ECOG评分为0分。② PD-L1 CPS>1患者比率高达41.00%。研究[15]表明, PD-1单抗的疗效与肿瘤突变负荷、PD-L1 等表达水平等有关。在胃癌、结肠癌、非小细胞肺癌患者中,肿瘤突变负荷高的患者接受PD-1单抗治疗的应答率高且预后较好[16-17]。③ 肝转移患者比率(56.00%)相对较低。本研究中,肝转移占总纳入人数的70.00%。值得注意的是,本研究纳入的患者人群更符合临床特点。因此,针对联合用药需要保持清醒的认识,避免盲从,并且需更大规模队列研究来进一步评估及确认联合用药的疗效。
本研究报告了晚期肝癌、食管癌及胰腺患者对联合用药具有良好的反应,肝癌患者的ORR达50.00%(4/8), DCR达100.00%(8/8), 与PD-1抑制剂SHR-1210联合阿帕替尼治疗晚期肝癌、胃癌/胃食管交接部癌的IA/IB期研究[4]结果接近。但由于样本量较小,需通过扩大样本量的研究进行验证。不同人群的TGR存在差异, MASUISHI T等[18]对比了晚期结直肠癌患者对于瑞戈非尼或TAS-102的应答率,并证实了SG组的肿瘤对于TAS-102的应答率更高,而在快生长组中两者没有明显差异。本研究首次证实了联合用药中TGR慢的患者较TGR快的患者无进展生存期更长。PD-1单抗通过阻断肿瘤PD-L1与PD-1的结合,消除肿瘤的免疫抑制,激活T细胞识别并杀伤肿瘤细胞[19-21], 其中记忆T细胞能够长期维持免疫记忆,使机体对肿瘤产生长期免疫应答[22-24]。一项回顾性研究[25]描述了单用免疫疗法治疗恶性肿瘤的反应时间及作用持续时间,该研究共纳入了262例患者, 76例患者肿瘤明显缩小,而在这76例患者中, 48例患者在用药3个月时起效,这表明免疫治疗较传统的化疗及手术等方式反应时间长,导致免疫治疗在TGR快的患者中很难发挥效果。一项国际多中心随机对照开放标签的Ⅲ期临床研究[26]报告了在微卫星不稳定型肠癌患者中免疫治疗与化疗的生存曲线在用药的前期存在交叉,这也说明即使在免疫治疗优势人群中,TGR快的患者对于免疫治疗的疗效也是受限的。
将本研究是否发生irAE与DCR进行分析发现,两者具有显著相关性。2020年美国临床肿瘤学会(ASCO)会议公布了ATTRACTION-2研究[27]的3年随访结果,即纳武利尤单抗治疗发生irAE较不发生此类反应的患者PFS及OS均延长。免疫治疗相关不良反应通常与免疫相关,可见于全身各系统[28]。单药免疫治疗不良反应发生晚,且重度不良反应发生率低,但是联合用药时会使irAE发生时间提前。在关于纳武利尤单抗联合酪氨酸激酶抑制剂靶向治疗晚期肾癌的研究[20]中发现, Ⅲ~Ⅳ级AE发生率高达73%和60%。联合用药提高了不良反应发生率,这要求医师在临床应用中应小心谨慎,在联合用药时需根据患者的体能及耐受调整用药剂量,及时发现并甄别不良反应。
TKI联合PD-1单抗治疗恶性肿瘤的研究尤其是REGONIVO研究[5]的疗效给人们治疗消化道肿瘤带来非常大的惊喜,但是这些研究多为Ⅰ期及II期临床试验,需要扩大样本量进行更深入的研究以得到更加真实的临床数据,为临床医师合理用药提供指导。本研究以REGONIVO研究[5]为启发,纳入了应用PD-1单抗联合包括瑞戈非尼在内的抗血管生成TKI类药物治疗的晚期消化系统恶性肿瘤患者,证实在晚期胃及肠恶性肿瘤的治疗上并没有达到与REGONIVO研究[5]类似的高应答率,提示在临床应用时需要更加精准筛选有可能获益的人群,根据个体的差异选择不同的组合及用药剂量,以期给患者带来更好的疗效,减少不良反应的发生。通过分析TGR与疗效发现, TGR慢的患者联合用药中位生存时间及ORR较TGR快的患者更高。本研究为回顾性研究、样本量小、随访时间短,有必要在未来的临床实践及临床研究中对TKI联合PD-1单抗的疗效、安全性以及可能预测其疗效的生物标记物进行进一步的探索。
