香芹酚通过增强PTEN诱导激酶1/Parkin介导的自噬而减轻心肌缺血再灌注损伤的动物及细胞实验
2021-11-06闫莉杨光程功
闫莉,杨光,程功
缺血性心脏病是世界范围内严重的公共健康问题,其发病率和死亡率均较高[1]。及时有效的心肌再灌注是挽救缺血心肌细胞、限制梗死面积的关键。然而,血流的突然恢复往往会加重缺血心肌的功能损伤,导致一系列不良后果,包括心肌细胞凋亡和坏死、心律失常和心脏收缩功能障碍,最终导致心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)[2]。虽然MIRI的病理机制尚未完全阐明,但已有报道认为MIRI与线粒体功能障碍引起的钙离子超载、活性氧(reactive oxygen species,ROS)积聚、三磷 腺苷(adenosine triphosphate,ATP)生成减少和线粒体膜电位(mitochondrial membrane protential,MMP)降低密切相关[3]。
自噬是一种高度保守的溶酶体相关的降解过程,主要负责大蛋白聚集体和受损细胞器的降解,广泛参与包括心血管疾病在内的病理生理过程[4]。自噬如何选择性地识别和清除受损的线粒体已成为最近研究的一个主要焦点。研究表明,在心血管疾病中,PTEN诱导激酶1(PTEN induced putative kinase 1,PINK1)/Parkin 介导的自噬通过有效地清除受损的线粒体和过量的ROS来维持细胞内线粒体的动态平衡[5]。PINK1/Parkin介导的自噬可以保护H9C2心肌细胞免受缺氧/复氧(hypoxia/reoxygenation,H/R)损伤[6]。因此,自噬调控被认为是治疗MIRI的有效策略。
香芹酚属于唇形科植物中的单萜酚类,在过去其作为食品添加剂被广泛应用于食品工业[7]。一些研究表明,香芹酚具有抗氧化、抗炎、抗肿瘤和抗微生物作用[8-10]。另外,有学者报道香芹酚可通过减轻氧化应激及减少心肌细胞凋亡[11]、减轻线粒体损伤[12]来缓解MIRI。然而,目前尚不清楚香芹酚对MIRI中自噬的影响。本研究旨在通过动物及细胞实验探讨香芹酚治疗MIRI的效果及其作用机制,从而为MIRI的治疗提供新的策略。
1 材料与方法
1.1 实验时间 2020年5月至2021年5月。
1.2 主要实验试剂 香芹酚购自美国Sigma-Aldrich公司;心肌肌钙蛋白I(cardiac troponin I,cTnI)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒购自武汉菲恩生物科技有限公司;肌酸激酶同工酶(creatine kinase isoenzyme,CK-MB)ELISA试剂盒购自上海心语生物科技有限公司;天冬氨酸氨基转移酶(aspartate aminotransferase,AST)ELISA试剂盒购自无锡云萃生物科技有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)ELISA试剂盒购自滁州仕诺达生物科技有限公司;2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)购自北京索莱宝科技有限公司;苏木精-伊红(hematoxylin eosin,HE)染色试剂盒、BCA蛋白分析试剂盒购自碧云天生物技术研究所;Masson三色染色试剂盒购自南京森贝伽生物科技有限公司;10%胎牛血清、Lipofectamine 3000购自美国Invitgen公司;青霉素、链霉素、DMEM培养基购自美国Gibco公司;TUNEL染色试剂盒购自美国罗氏公司;RIPA裂解缓冲液购自北京凯瑞基生物科技有限公司;PINK1、Parkin、Beclin1、微管相关蛋白轻链3(microtubule-associated protein 3,LC3)和抗β-actin试剂盒购自美国Cell Signaling Technology公司;辣根过氧化物酶标记的免疫球蛋白(immunoglobulin,Ig)G购自英国Abcam公司;靶向PINK1的小干扰RNA(small interfering RNA targeting PINK1,PINK1-siRNA)和阴性对照小干扰RNA(negative control siRNA,NC-siRNA)由上海吉玛制药技术有限公司合成。
1.3 实验动物和分组 成年雄性Sprague-Dawley大鼠48只〔平均体质量(230±20)g〕,购自南通特洛菲饲料科技有限公司。大鼠饲养在湿度为40%~50%、温度为25 ℃、光照/黑暗周期为12 h的实验室中。大鼠可自由获取食物和水。将大鼠随机分为Sham组(A组)、MIRI组(B组)、MIRI+20 mg/kg香芹酚组(C组)和MIRI+60 mg/kg香芹酚组(D组),每组12只。
1.4 实验细胞和分组 大鼠心肌细胞H9C2细胞购自美国ATCC。将H9C2细胞分为对照组(E组)、H/R组(F组)、H/R+香芹酚组(G组)、H/R+香芹酚+NC-siRNA组(H组)和H/R+香芹酚+PINK1-siRNA组(I组)。
1.5 实验方法
1.5.1 动物实验
1.5.1.1 MIRI模型的建立 B、C、D组大鼠腹腔注射5%水合氯醛(0.01 ml/g)麻醉后,连接动物呼吸机,潮气量2.0~2.5 ml,呼吸频率为120次/min,而后开胸暴露大鼠心脏。结扎冠状动脉左前降支造成心肌缺血。心肌缺血的标准是心电图上ST段抬高0.2 mV和心脏局部发紫。心肌缺血30 min后,解除结扎恢复血流2 h进行再灌注。A组大鼠接受相同的手术,但不结扎冠状动脉左前降支。术前15 min,C组和D组大鼠腹腔注射相应剂量的香芹酚,A组和B组大鼠给予等体积的0.9%氯化钠溶液。
1.5.1.2 血清cTnI、CK-MB、AST、LDH水平测定再灌注结束后,采集大鼠下腔静脉血,1 000 r/min离心15 min(离心半径15 cm),收集血清。分别用相应的ELISA试剂盒按照制造商的方案测定大鼠血清cTnI、CK-MB、AST、LDH水平。
1.5.1.3 心肌梗死面积测定 再灌注结束后,通过TTC染色确定心肌梗死面积。将大鼠左心室切成2~3 mm的切片,放入含有1% TTC的0.1 mol/L磷酸盐缓冲液(pH=7.4)中,于37 ℃避光孵育30 min。正常心肌为红色,梗死心肌为灰白色。分别用电子天平称重梗死区和左心室重量,梗死面积为梗死区重量占左心室重量的百分比。
1.5.1.4 心肌病变测定 (1)HE染色:将各组大鼠心脏在4%多聚甲醛中固定,石蜡包埋,切成4 μm厚的切片,按照HE染色试剂盒说明书进行HE染色,观察心肌组织形态。(2)Masson三色染色:将各组大鼠心脏置于4%多聚甲醛中固定,石蜡包埋,切成4 μm厚的切片,按照Masson三色染色试剂盒说明书进行Masson三色染色,观察心肌纤维化情况,使用Image-Pro Plus 6.0软件计算心肌纤维化百分比。(3)TUNEL染色:将各组大鼠心脏置于4%多聚甲醛中固定,石蜡包埋,切成4 μm厚的切片;将心肌切片脱蜡和水化后,置于蛋白酶K溶液中,并于37 ℃避光孵育30 min,然后将切片置于TUNEL工作液中于37 ℃孵育60 min;磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤并风干后,滴加含有4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)的抗淬灭荧光封固剂封固,置于荧光显微镜下观察,激发波长范围为450~500 nm,发射波长为515~565 nm。计算心肌组织TUNEL阳性率。
1.5.1.5 心肌组织中PINK1、Parkin、Beclin1蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ检测 采用Western blot法检测心肌组织中PINK1、Parkin、Beclin1、LC3蛋白表达水平,具体方法如下:使用含有蛋白酶和磷酸酶抑制剂的RIPA裂解缓冲液从心肌组织中分离蛋白,采用BCA蛋白分析试剂盒测定总蛋白浓度。采用12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离50 μg蛋白并电转移到聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上。采用5%脱脂牛奶封闭后,将切片置于抗PINK1、Parkin、Beclin1、LC3、β-actin(均为1∶1 000稀释)中,于4 ℃孵育过夜。然后在室温下于辣根过氧化物酶标记的IgG二抗(1∶2 000稀释)中孵育1 h。以β-actin作为内参。通过Bio-Rad凝胶成像系统进行成像,并用Image J软件计算PINK1、Parkin、Beclin1、LC3-Ⅰ、LC3-Ⅱ蛋白条带的灰度值,并计算LC3-Ⅱ/LC3-Ⅰ。
1.5.2 细胞实验
1.5.2.1 细胞培养及干预方法 将H9C2细胞培养在含10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的DMEM培养基中,于37 ℃、5% CO2环境中培养。取各组对数生长期的H9C2细胞,E组在正常环境(37 ℃、5% CO2、95%空气)中于完全DMEM培养基中培养;F组在37 ℃、5% CO2、95% N2的环境中于无糖DMEM培养基中培养,进行缺氧处理4 h后将细胞在正常环境中于完全DMEM培养基中复氧培养;G组用香芹酚(100 μmol/L)预处理6 h后,采用与F组相同的方法进行H/R处理;H组和I组在转染NC-siRNA或PINK1-siRNA后,分别用香芹酚(100 μmol/L)预处理6 h,然后进行H/R处理。细胞转染方法如下:将H9C2细胞以1×105个/孔的密度接种于6孔板上,使用Lipofectamine 3000将PINK1-siRNA或NC-siRNA转染至H9C2细胞中,转染方法按照说明书进行操作。
1.5.2.2 细胞活力检测 采用MTT法检测细胞活力,具体方法如下:H/R处理完成后,向各培养孔中加入50 μl MTT溶液,于37 ℃、5% CO2环境中培养4 h。然后将培养板以2 500 r/min离心5 min(离心半径15 cm),弃去上清液,各孔加入150 μl二甲基亚砜(dimethyl sulfoxide,DMSO)。振荡30 s,用酶标仪测量550 nm处吸光度值并计算细胞活力。实验重复6次。
1.5.2.3 细胞凋亡率检测 采用TUNEL染色法检测细胞凋亡率,具体方法如下:将H9C2细胞以2×104个/孔的密度接种到24孔板中,采用4%多聚甲醛室温固定30 min,采用0.1% Triton X-100在0.1%枸橼酸钠中渗透H9C2细胞2 min。PBS洗涤后,将细胞与TUNEL反应混合物在37 ℃下孵育1 h,然后用DAPI染核,采用荧光显微镜观察染色的细胞。随机选择6个高倍视野,计数每个视野中的总细胞数和TUNEL阳性细胞数(绿色荧光),之后计算TUNEL阳性率,即细胞凋亡率。实验重复6次。
1.5.2.4 H9C2细胞中PINK1、Parkin、Beclin1蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ检测 采用Western blot法检测H9C2细胞中Beclin1、LC3、PINK1、Parkin蛋白表达水平,方法同1.5.1.5。实验重复6次。
1.6 统计学方法 使用SPSS 22.0统计学软件进行数据分析。计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 血清cTnI、CK-MB、AST、LDH水平 A、B、C、D组大鼠血清cTnI、CK-MB、AST、LDH水平比较,差异有统计学意义(P<0.05)。B、C、D组大鼠血清cTnI、CK-MB、AST、LDH水平高于A组,差异有统计学意义(P<0.05);C、D组大鼠血清cTnI、CKMB、AST、LDH水平低于B组,差异有统计学意义(P<0.05);D组大鼠血清cTnI、CK-MB、AST、LDH水平低于C组,差异有统计学意义(P<0.05),见表1。
表1 A、B、C、D组大鼠血清cTnI、CK-MB、AST、LDH水平比较(±s,n=12)Table 1 Comparison of serum levels of cTnI,CK-MB,AST and LDH of rats in groups A,B,C and D
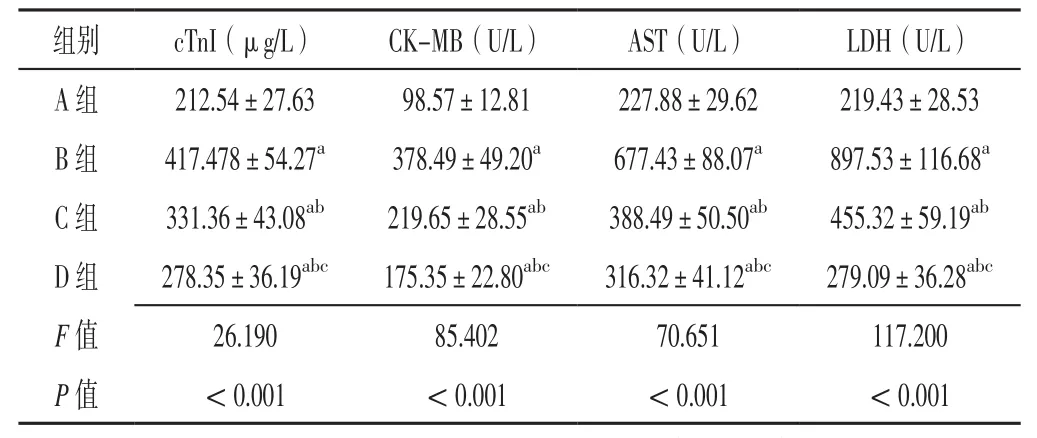
表1 A、B、C、D组大鼠血清cTnI、CK-MB、AST、LDH水平比较(±s,n=12)Table 1 Comparison of serum levels of cTnI,CK-MB,AST and LDH of rats in groups A,B,C and D
注:A组为Sham组,B组为心肌缺血再灌注损伤(MIRI)组,C组为MIRI+20 mg/kg香芹酚组,D组为MIRI+60 mg/kg香芹酚组;a表示与A组比较,P<0.05;b表示与B组比较,P<0.05;c表示与C组比较,P<0.05;cTnI=心肌肌钙蛋白I,CK-MB=肌酸激酶同工酶,AST=天冬氨酸氨基转移酶,LDH=乳酸脱氢酶
组别 cTnI(μg/L) CK-MB(U/L) AST(U/L) LDH(U/L)A组 212.54±27.63 98.57±12.81 227.88±29.62 219.43±28.53 B 组 417.478±54.27a 378.49±49.20a 677.43±88.07a 897.53±116.68a C 组 331.36±43.08ab 219.65±28.55ab 388.49±50.50ab 455.32±59.19ab D组 278.35±36.19abc 175.35±22.80abc 316.32±41.12abc 279.09±36.28abc F值 26.190 85.402 70.651 117.200 P值 <0.001 <0.001 <0.001 <0.001
2.2 心肌梗死面积 A、B、C、D组大鼠心肌梗死面 积 分 别 为 0、21.35%±2.60%、13.14%±1.60%、7.54%±0.92%。B、C、D组大鼠心肌梗死面积比较,差异有统计学意义(F=170.845,P<0.001)。C、D组大鼠心肌梗死面积小于B组,差异有统计学意义(P<0.05);D组大鼠心肌梗死面积小于C组,差异有统计学意义(P<0.05),见图1。

图1 A、B、C、D组大鼠心肌组织TTC染色结果(×10)Figure 1 TTC staining results of myocardial tissue of rats in groups A,B,C and D
2.3 心肌病变 HE染色结果显示,A组大鼠心肌细胞排列整齐,细胞核明显,无炎性细胞浸润;B组大鼠心肌组织广泛坏死,心肌纤维排列紊乱,大量炎性细胞浸润;C、D组大鼠心肌细胞排列较整齐,细胞坏死程度和范围明显减轻,见图2。
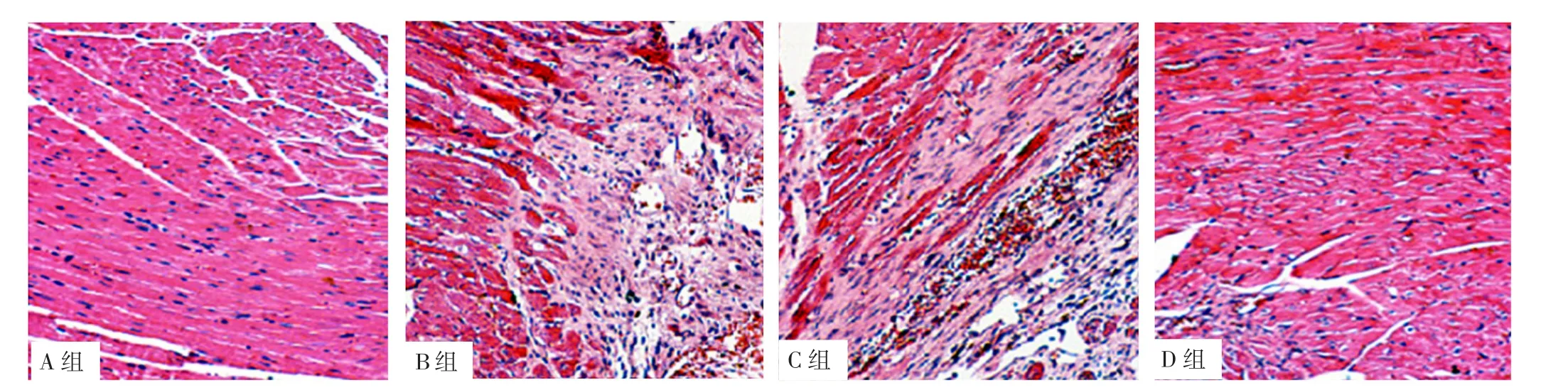
图2 A、B、C、D组大鼠心肌组织HE染色结果(×200)Figure 2 HE staining result of myocardial tissue of rats in groups A,B,C and D
Masson三色染色结果显示,A组大鼠心肌组织以心肌细胞为主,没有明显的胶原成分;B组大鼠心肌组织心肌纤维化明显,仅有少量心肌细胞存在;C、D组大鼠心肌组织的胶原纤维含量明显减少,见图3。定量分析结果显示,A、B、C、D组大鼠心肌纤维化百分比比较,差异有统计学意义(P<0.05)。B、C、D组大鼠心肌纤维化百分比高于A组,差异有统计学意义(P<0.05);C、D组大鼠心肌纤维化百分比低于B组,差异有统计学意义(P<0.05);D组大鼠心肌纤维化百分比低于C组,差异有统计学意义(P<0.05),见表2、图3。
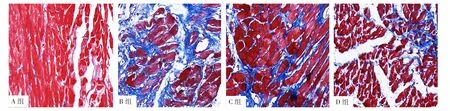
图3 A、B、C、D组大鼠心肌组织Masson三色染色结果(×400)Figure 3 Masson trichrome staining result of myocardial tissue of rats in groups A,B,C and D
TUNEL染色结果显示,A、B、C、D组大鼠心肌组织TUNEL阳性率比较,差异有统计学意义(P<0.05)。B、C、D组大鼠心肌组织TUNEL阳性率高于A组,差异有统计学意义(P<0.05);C、D组大鼠心肌组织TUNEL阳性率低于B组,差异有统计学意义(P<0.05);D组大鼠心肌组织TUNEL阳性率低于C组,差异有统计学意义(P<0.05),见表2、图4。
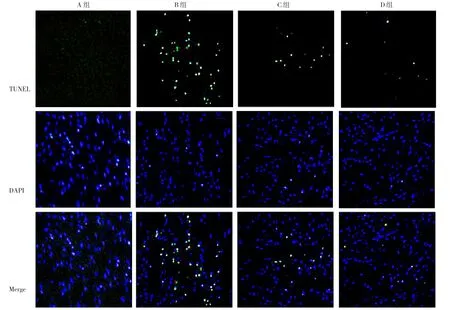
图4 A、B、C、D组大鼠心肌组织TUNEL染色结果(×200)Figure 4 TUNEL staining result of myocardial tissue of rats in groups A,B,C and D
表2 A、B、C、D组大鼠心肌纤维化百分比、心肌组织TUNEL阳性率比较(± s,%,n=12)Table 2 Comparison of rat myocardial fibrosis rate and myocardial tissue TUNEL positive rate in groups A,B,C and D

表2 A、B、C、D组大鼠心肌纤维化百分比、心肌组织TUNEL阳性率比较(± s,%,n=12)Table 2 Comparison of rat myocardial fibrosis rate and myocardial tissue TUNEL positive rate in groups A,B,C and D
注:a表示与A组比较,P<0.05;b表示与B组比较,P<0.05;c表示与C组比较,P<0.05
组别 心肌纤维化百分比 心肌组织TUNEL阳性率A组 0.54±0.07 0.27±0.03 B组 61.43±7.49a 22.43±2.74a C组 32.56±3.97ab 6.75±0.82ab D组 20.65±2.52abc 2.21±0.27abc F值 198.803 293.712 P值 <0.001 <0.001
2.4 心肌组织中PINK1、Parkin、Beclin1蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ A、B、C、D组大鼠心肌组织中PINK1、Parkin、Beclin1蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ比较,差异有统计学意义(P<0.05)。B、C、D组大鼠心肌组织中PINK1、Beclin1蛋白表达水平低于A组,B、C组大鼠心肌组织中Parkin蛋白表达水平低于A组,B组大鼠心肌组织中LC3-Ⅱ/LC3-Ⅰ低于A组,C、D组大鼠心肌组织中LC3-Ⅱ/LC3-Ⅰ高于A组,差异有统计学意义(P<0.05);C、D组大鼠心肌组织中PINK1、Parkin、Beclin1蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ高于B组,差异有统计学意义(P<0.05);D组大鼠心肌组织中Parkin、Beclin1蛋白表达水平高于C组,差异有统计学意义(P<0.05),见表3、图5。
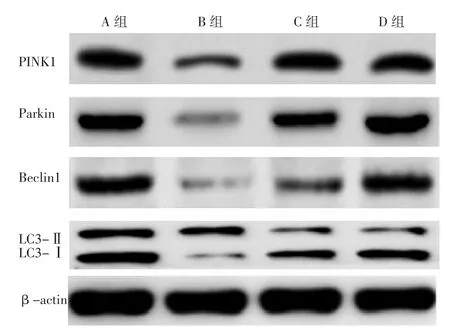
图5 Western blot检测A、B、C、D组大鼠心肌组织中PINK1、Parkin、Beclin1蛋白表达水平及LC3-Ⅱ、LC3-Ⅰ的SDS-PAGE图Figure 5 SDS-PAGE images of PINK1,Parkin,Beclin1 protein expression level and LC3-Ⅱ /LC3-Ⅰ detected by Western blot in myocardial tissues of rats in groups A,B,C,D
表3 A、B、C、D组大鼠心肌组织中PINK1、Parkin、Beclin1蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ比较(± s,n=12)Table 3 Comparison of expression levels of PINK1,Parkin and Beclin1 protein and LC3-Ⅱ/LC3-Ⅰ in the myocardial tissues of rats in groups A,B,C and D

表3 A、B、C、D组大鼠心肌组织中PINK1、Parkin、Beclin1蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ比较(± s,n=12)Table 3 Comparison of expression levels of PINK1,Parkin and Beclin1 protein and LC3-Ⅱ/LC3-Ⅰ in the myocardial tissues of rats in groups A,B,C and D
注:a表示与A组比较,P<0.05;b表示与B组比较,P<0.05;c表示与C组比较,P<0.05;PINK1=PTEN诱导激酶1,LC3=微管相关蛋白轻链3
images/BZ_79_1275_2631_2277_2689.pngA 组 1.00±0.14 1.00±0.12 1.00±0.09 1.00±0.08 B 组 0.23±0.02a 0.24±0.03a 0.18±0.03a 0.24±0.04a C 组 0.76±0.11ab 0.86±0.11ab 0.57±0.09ab 1.26±0.17ab D 组 0.83±0.08ab 0.97±0.08bc 0.70±0.02abc 1.35±0.14ab F值 68.982 101.655 156.986 106.612 P值 <0.001 <0.001 <0.001 <0.001
2.5 细胞活力 E、F、G、H、I组细胞活力比较,差异有统计学意义(P<0.05)。F、G、H、I组细胞活力小于E组,差异有统计学意义(P<0.05);G、H组细胞活力大于F组,差异有统计学意义(P<0.05);I组细胞活力小于G、H组,差异有统计学意义(P<0.05),见表4、图6。

图6 MTT法检测E、F、G、H、I组细胞活力结果(×400)Figure 6 Cell viability results of groups of E,F,G,H,I detected by MTT method
2.6 细胞凋亡率 E、F、G、H、I组细胞凋亡率比较,差异有统计学意义(P<0.05)。F、G、H、I组细胞凋亡率高于E组,差异有统计学意义(P<0.05);G、H、I组细胞凋亡率低于F组,差异有统计学意义(P<0.05);I组细胞凋亡率高于G、H组,差异有统计学意义(P<0.05),见表4。
表4 E、F、G、H、I组细胞活力、细胞凋亡率比较(±s,n=6)Table 4 Comparison of cell viability and apoptosis rate in groups E,F,G,H,I

表4 E、F、G、H、I组细胞活力、细胞凋亡率比较(±s,n=6)Table 4 Comparison of cell viability and apoptosis rate in groups E,F,G,H,I
注:E组为对照组,F组为缺氧/复氧(H/R)组,G组为H/R+香芹酚组,H组为H/R+香芹酚+阴性对照小干扰RNA(NC-siRNA)组,I组为H/R+香芹酚+靶向PINK1的小干扰RNA(PINK1-siRNA)组;a表示与E组比较,P<0.05;b表示与F组比较,P<0.05;c表示与G组比较,P<0.05;d表示与H组比较,P<0.05
组别 细胞活力 细胞凋亡率(%)E 组 1.00±0.15 2.06±0.10 F 组 0.50±0.08a 31.94±3.68a G 组 0.77±0.11ab 7.36±0.93ab H 组 0.72±0.12ab 8.50±0.81ab I组 0.53±0.04acd 16.34±1.87abcd F值 21.557 218.452 P值 <0.001 <0.001
2.7 H9C2细胞中 PINK1、Parkin、Beclin1蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ E、F、G、H、I组H9C2细胞中PINK1、Parkin、Beclin1蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ比较,差异有统计学意义(P<0.05)。F组H9C2细胞中PINK1、Parkin、Beclin1蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ低于E组,差异有统计学意义(P<0.05);G、H组H9C2细胞中PINK1、Beclin1蛋白表达水平低于E组、高于F组,Parkin蛋白表达水平高于F组,LC3-Ⅱ/LC3-Ⅰ高于E、F组,差异有统计学意义(P<0.05);I组H9C2细胞中PINK1、Parkin、Beclin1蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ低于E、G、H组,Beclin1蛋白表达水平高于F组,差异有统计学意义(P<0.05),见表5、图7。

图 7 Western blot检 测 E、F、G、H、I组 H9C2细 胞 中 PINK1、Parkin、Beclin1蛋白表达水平及LC3-Ⅱ、LC3-Ⅰ的SDS-PAGE图Figure 7 SDS-PAGE images of PINK1,Parkin,Beclin1 protein expression level and LC3-Ⅱ/LC3-Ⅰ in H9C2 cells in groups E,F,G,H,I detected by Western blot
表5 E、F、G、H、I组H9C2细胞中PINK1、Parkin、Beclin1蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ比较(± s,n=6)Table 5 Comparison of PINK1,Parkin,Beclin1 protein expression level and LC3-Ⅱ/LC3-Ⅰ in H9C2 cells in groups E,F,G,H,I
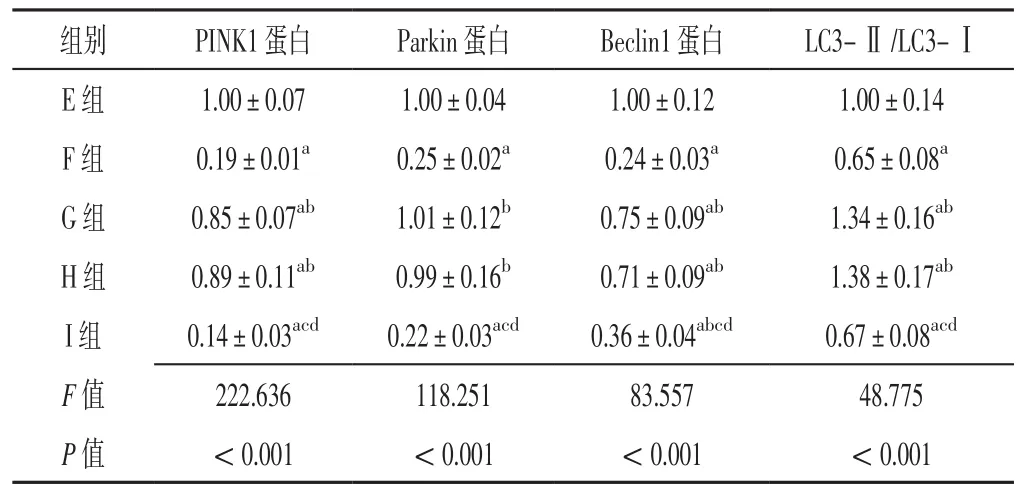
表5 E、F、G、H、I组H9C2细胞中PINK1、Parkin、Beclin1蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ比较(± s,n=6)Table 5 Comparison of PINK1,Parkin,Beclin1 protein expression level and LC3-Ⅱ/LC3-Ⅰ in H9C2 cells in groups E,F,G,H,I
注:a表示与E组比较,P<0.05;b表示与F组比较,P<0.05;c表示与G组比较,P<0.05;d表示与H组比较,P<0.05
组别 PINK1蛋白 Parkin蛋白 Beclin1蛋白 LC3-Ⅱ/LC3-ⅠE 组 1.00±0.07 1.00±0.04 1.00±0.12 1.00±0.14 F组 0.19±0.01a 0.25±0.02a 0.24±0.03a 0.65±0.08a G 组 0.85±0.07ab 1.01±0.12b 0.75±0.09ab 1.34±0.16ab H 组 0.89±0.11ab 0.99±0.16b 0.71±0.09ab 1.38±0.17ab I组 0.14±0.03acd 0.22±0.03acd 0.36±0.04abcd 0.67±0.08acd F值 222.636 118.251 83.557 48.775 P值 <0.001 <0.001 <0.001 <0.001
3 讨论
香芹酚是一种单萜酚类化合物,具有广泛的生物活性,包括抗菌[13]、抗病毒[14]、抗氧化[15]、改善免疫反应[16]等。香芹酚由于具有调味功能和抗菌活性已被用作食品工业的天然食品防腐剂[17]。此外,已有研究报道,香芹酚在MIRI的预防方面具有重要作用,然而尚不清楚其主要药理学机制。因此,本研究深入考察了香芹酚防治MIRI的可能分子机制。
血清cTnI、CK-MB、AST、LDH是诊断心肌损伤的常见标志物。本研究结果显示,C、D组大鼠血清cTnI、CK-MB、AST、LDH水平低于B组;D组大鼠血清cTnI、CK-MB、AST、LDH水平低于C组,提示香芹酚以剂量依赖性方式减轻了MIRI大鼠的心肌损伤。C、D组大鼠心肌梗死面积小于B组,D组大鼠心肌梗死面积小于C组。此外,HE染色结果显示,B组大鼠心肌组织广泛坏死,心肌纤维排列紊乱,大量炎性细胞浸润;C、D组大鼠心肌细胞排列较整齐,细胞坏死程度和范围明显减轻。Masson三色染色结果显示,C、D组大鼠心肌纤维化百分比低于B组;D组大鼠心肌纤维化百分比低于C组。这些结果进一步证实香芹酚以剂量依赖性方式减轻了MIRI大鼠的心肌损伤及纤维化程度。
本研究TUNEL染色结果显示,B、C、D组大鼠心肌组织TUNEL阳性率高于A组;C、D组大鼠心肌组织TUNEL阳性率低于B组;D组大鼠心肌组织TUNEL阳性率低于C组;提示香芹酚以剂量依赖性方式减轻了MIRI大鼠心肌细胞凋亡。已知细胞凋亡是心脏疾病发展过程中细胞死亡的主要形式之一,并且心肌细胞凋亡也是MIRI的重要决定因素[18]。因此,减少细胞凋亡是预防MIRI的主要措施。本研究结果显示,F、G、H、I组细胞活力小于E组,G、H组细胞活力大于F组,I组细胞活力小于G、H组;F、G、H、I组细胞凋亡率高于E组,G、H、I组细胞凋亡率低于F组,I组细胞凋亡率高于G、H组;提示香芹酚通过抑制MIRI大鼠心肌细胞的凋亡来保护心肌结构。宋旭东等[11]研究显示,香芹酚预处理可减轻MIRI小鼠的氧化应激及心肌细胞凋亡。王先宝等[12]研究显示,香芹酚预处理可减轻MIRI小鼠的线粒体损伤,从而减小心肌梗死面积。因此,推测香芹酚减轻心肌细胞凋亡的机制可能与改善动物体内氧化-抗氧化平衡有关。
越来越多的证据表明,自噬是MIRI期间心肌细胞凋亡的关键因素[19]。通过PINK1/Parkin途径上调自噬可以保护心肌细胞免受MIRI[20]。本研究推测香芹酚的心肌保护作用可能与自噬和PINK1/Parkin通路有关。为了验证这一观点,本研究检测了PINK1/Parkin通路及自噬相关蛋白的表达,结果显示,B、C、D组大鼠心肌组织中PINK1、Beclin1蛋白表达水平低于A组,B、C组大鼠心肌组织中Parkin蛋白表达水平低于A组,B组大鼠心肌组织中LC3-Ⅱ/LC3-Ⅰ低于A组,C、D组大鼠心肌组织中LC3-Ⅱ/LC3-Ⅰ高于A组;C、D组大鼠心肌组织中PINK1、Parkin、Beclin1蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ高于B组;D组大鼠心肌组织中Parkin、Beclin1蛋白表达水平高于C组;F组H9C2细胞中PINK1、Parkin、Beclin1蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ低于E组;G、H组H9C2细胞中PINK1、Beclin1蛋白表达水平低于E组、高于F组,Parkin蛋白表达水平高于F组,LC3-Ⅱ/LC3-Ⅰ高于E、F组;表明香芹酚上调了MIRI大鼠心肌组织及H/R处理的H9C2细胞中PINK1、Parkin、Beclin-1蛋白表达水平和LC3-Ⅱ/LC3-Ⅰ,提示香芹酚激活了PINK1/Parkin信号通路并增强了自噬能力。自噬是一个涉及清除受损的蛋白质和细胞器的降解过程,这个过程有助于维持心肌功能。据报道,抑制自噬可加重MIRI[21]。研究显示,PINK1/Parkin介导的线粒体自噬在心血管疾病中通过有效地清除受损的线粒体和过量的ROS来确保细胞内线粒体的稳定性[5]。PINK1/Parkin可检测到伴有功能障碍的线粒体并招募自噬小体对其进行降解[22]。研究表明,PINK1/Parkin诱导的自噬调节了心肌细胞中线粒体的动力学和功能[23]。随着年龄增长,Parkin的缺失导致心肌细胞中的线粒体功能发生紊乱,从而导致氧化应激和线粒体呼吸功能障碍[24]。本研究结果显示,I组H9C2细胞中PINK1、Parkin、Beclin1蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ低于E、G、H组,Beclin1蛋白表达水平高于F组,提示转染PINK1-siRNA后H9C2细胞中PINK1蛋白表达被抑制,并且也逆转了香芹酚对自噬的上调作用和对PINK1/Parkin通路的激活作用。这些结果说明,激活PINK1/Parkin通路促进自噬是香芹酚抗MIRI的主要机制。
本研究尚存在一定局限性:(1)虽然本研究使用了两种剂量的香芹酚来治疗MIRI大鼠,然而其最佳使用剂量尚未确定,需要在接下来的研究中进一步揭示;(2)参与调节MIRI发生发展的信号通路非常多,并且自噬也受多种信号通路直接或间接调节,因此,PINK1/Parkin介导的自噬通路仅是香芹酚防治MIRI的主要机制之一,还需要进一步研究香芹酚对其他通路的影响;(3)本研究动物实验中,香芹酚为预处理给药,因此,需要在今后的研究中探讨后处理给药方式是否对MIRI大鼠具有相同的治疗效果。
综上所述,动物及细胞实验均表明,香芹酚通过激活PINK1/Parkin通路增强自噬,从而减轻MIRI,香芹酚在防治MIRI中具有多种机制,有望成为缺血性心脏病的潜在治疗药物。
作者贡献:闫莉进行文章的构思与设计、研究的实施与可行性分析,撰写论文;闫莉、杨光进行数据收集与整理、统计学处理、结果的分析与解释;程功进行论文的修订,负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
