额窦恶性肿瘤的诊断与治疗(5例报告并文献复习)*
2021-11-06张国民胡翠玉高松马贺王志杰吴文斌
张国民 胡翠玉 高松 马贺 王志杰 吴文斌
额窦原发性恶性肿瘤少见,转移性癌罕见,我科2009~2017年收治了5例额窦恶性肿瘤患者,其中4例为原发性恶性肿瘤,1例为转移性癌,现总结分析如下。
资料与方法
1 一般资料
5例额窦恶性肿瘤中,男性2例,女性3例,年龄61~85岁,平均71岁。1例女性患者入院前5年前有乳腺癌手术史、4年前有左额窦骨瘤切除术史。
临床表现 额部肿块3例、鼻根部肿块1例、眼球突出3例、局部疼痛2例,鼻出血1例。
辅助检查 CT检查:额窦骨性肿块突入眼眶及前颅底1例(图1),额窦软组织占位破坏窦腔及眼眶骨壁3例,额、筛窦及鼻腔占位及骨质破坏1例。
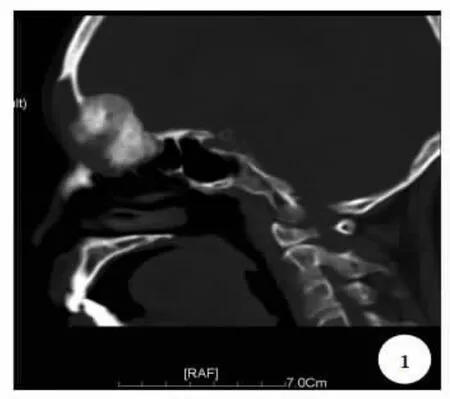
图1 鼻窦CT冠状位
病理类型 乳腺癌额窦转移1例(图2),弥漫大B细胞性淋巴瘤2例,鳞状细胞癌1例,乳头状瘤癌变(移行细胞癌)1例。
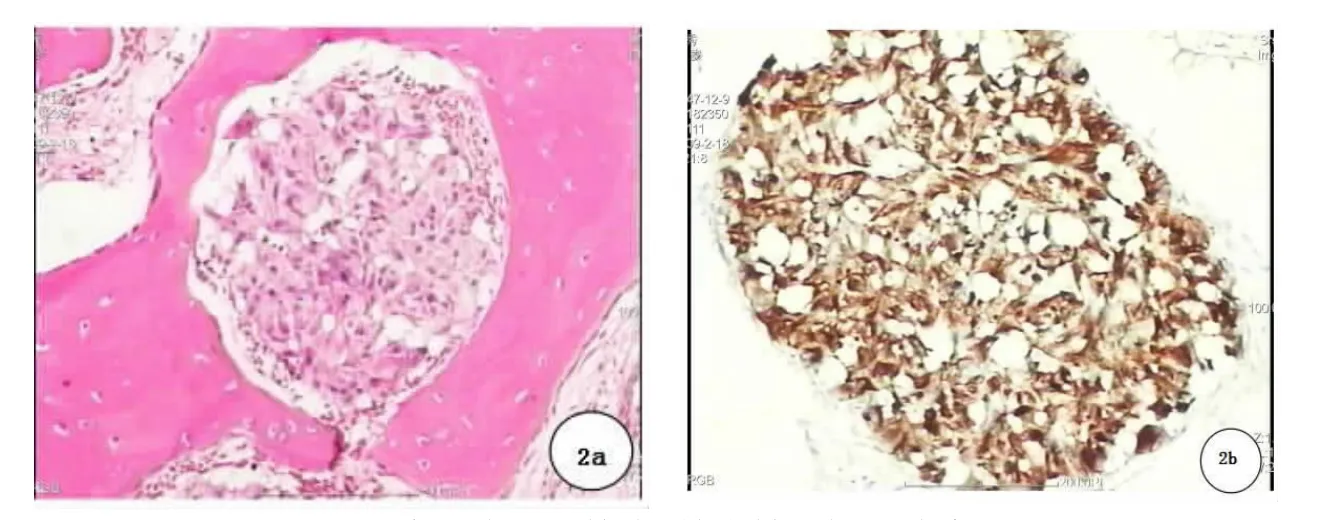
图2 术后病理学检查:符合转移性乳腺癌
2 治疗方法
3例全麻下行鼻外额窦切开、鼻内镜经鼻联合路径病变切除,1例行鼻内镜下DrafⅢ型额窦手术(辅助眉弓切口),1例局麻下行额部切开活检术。转移癌患者术后拒绝治疗;鳞癌患者术后拒绝放疗,1年半后因鼻出血就诊,复查MRI提示:额筛窦肿瘤复发累及双侧额叶、邻近脑膜,予同步放化疗(调强放疗DT6300cGy/30F,“DP”方案化疗);淋巴瘤活检术后患者拒绝化疗,予额窦区放疗DT5000cGy/25F,8个月后左乳腺出现肿块,穿刺活检病理证实为弥漫大B细胞淋巴瘤,予左乳腺放射治疗,总量DT 5200cGy/26F;另一例淋巴瘤术后患者转肿瘤医院化疗;乳头状瘤癌变患者行右侧额筛窦区域放射治疗,剂量DT6000cGy/30F,出院前复查MRI:右侧额筛窦未见明显肿块影,邻近额骨、右侧筛骨及右侧眼眶内侧壁骨质膨胀性破坏。
结果
随访3年,5例患者中死亡3例,1例带瘤生存,1例临床治愈。乳腺癌额窦转移患者于术后1年死亡;额窦乳头状瘤癌变患者于术后9个月死亡;额窦淋巴瘤活检术后继发左乳腺淋巴瘤先后2次放疗患者于术后2年10个月死亡;额窦鳞癌术后复发放疗患者带瘤生存(症状缓解,复查MRI显示肿瘤明显缩小);淋巴瘤术后化疗患者随访至今,一般情况良好,未见复发、转移。
讨论
鼻腔鼻窦恶性肿瘤占上呼吸道恶性肿瘤的3%[1],鼻窦恶性肿瘤发病率最高的为上颌窦恶性肿瘤,几乎占2/3,其余鼻窦按发病率高低依次为筛窦、额窦、蝶窦[2]。额窦恶性肿瘤少见,临床上较常见的是起源于鼻腔或筛窦的恶性肿瘤扩散累及额窦,偶有身体其它部位的恶性肿瘤转移至额窦。
额窦原发性恶性肿瘤罕见,约占鼻窦恶性肿瘤病例的1%[3]。作者检索了中国知网、维普、万方数据库,1980~2019年国内文献关于额窦原发性恶性肿瘤的报道有15篇[4-18],总共病例44例,主要病理类型包括鳞癌、淋巴瘤、浆细胞瘤、恶性黑色素瘤、横纹肌肉瘤、骨肉瘤、纤维肉瘤、滑膜肉瘤、腺癌、小细胞癌、未分化癌等,其中以鳞癌最多,共26例,占59%。美国Bhojwani分析总结了171例额窦恶性肿瘤,最常见的组织学类型是鳞状细胞癌(39.8%),其次是成熟的B细胞非霍奇金淋巴瘤(17.5%)、上皮性肿瘤和腺癌[19]。本文4例原性额窦恶性肿瘤中,弥漫大B细胞性淋巴瘤2例,鳞状细胞癌1例,乳头状瘤癌变为移行细胞癌1例。
鼻窦转移癌少见,Prescher等[20]回顾分析了123篇报道总共169例病例,转移部位以上颌窦多见,额窦最少,原发癌以肾细胞癌最多(67例),其次是支气管癌15例、甲状腺癌、乳腺癌分别13例和14例、前列腺12例。我国台湾学者[21]回顾分析了19例鼻窦和鼻腔转移性恶性肿瘤,转移瘤以肝、肾、乳腺来源居多。鼻窦转移癌中额窦转移癌尤为罕见,国内文献报道转移至额窦且未累及其他鼻窦的病例仅有2例,1例转移癌来源于甲状腺[22],1例原发癌为肾透明细胞癌[23]。而国外文献关于额窦的转移癌也仅有数例个案报道,原发癌中3例为肾透明细胞癌[24-26],1例为肾腺癌[27]、1例为前列腺癌[20]、1例为支气管肺癌[28]。本文1例额窦转移癌,病理证实为乳腺癌转移。
额窦恶性肿瘤的病因可能与以下因素有关:局部长期炎症刺激;职业暴露,尤其是木尘,其他已确定的职业危险因素包括皮尘、镍化合物等[29];外伤;良性肿瘤如乳头状瘤恶变等。
额窦恶性肿瘤的主要表现包括:①鼻部症状,如鼻塞、流脓血性涕、鼻出血,严重的可现额骨骨髓炎;②眼部症状,眼球移位、眼球突出、复视、视力减退、溢泪、眼睑肿胀、眼痛等;③额部症状,额部皮肤瘙痒、肿胀、破溃、瘘道形成;④肿瘤破坏额窦后壁、侵入颅前窝,出现剧烈头痛等。
诊断:额窦恶性肿瘤初起常无症状,早期诊断很困难。因此对于中老年患者,短期内出现前额部胀闷不适、皮肤瘙痒、疼痛、流脓血性涕者,须提高警惕,及时进行影像学检查。CT扫描是首选的检查手段,鼻窦轴位、冠状位CT扫描可以了解额窦通气的程度、病变的范围、窦壁骨质的破坏吸收、邻近结构的受累情况。MR较高的软组织分辨率、对精细结构的清晰显示,可以帮助我们了解病灶的范围、起源、对邻近器官的功能影响、压迫[30]。钆强化和脂肪抑制的MRI可以区分浓缩的分泌物和软组织肿块,区分手术后改变和肿瘤,显示肿瘤扩散引起的周围神经强化[31]。CT和MRI获得的信息是互补的,在怀疑恶性病变或病变范围较为广泛时有必要同时检查。鉴别诊断:本病须与额窦黏液囊肿相鉴别,后者为额窦自然开口完全阻塞,窦腔内黏液聚积、压力增高、压迫骨壁致骨质吸收变薄、缺损,常出现前额部隆起、眼球突出、复视等症状,合并感染形成脓囊肿时可出现额部、眶内上角红肿疼痛,CT表现多为等或低密度,蛋白含量高时表现为高密度影;窦腔呈膨胀性改变,骨质受压移位、变薄或缺损。MR信号表现多数为长T1长T2信号,增强扫描中央不强化,囊壁呈环形强化,厚度均匀一致[32]。本组1例额窦内骨性占位误诊为骨瘤,分析原因如下:①未重视患者的乳腺癌病史,未意识到乳腺癌是最容易发生骨转移的肿瘤之一;②患者有外院额窦“骨瘤”切除史,想当然为骨瘤复发;③未警惕到骨瘤病变不足以解释患者额部及眼眶疼痛症状;④阅片不仔细,未发现肿瘤有溶骨性、侵袭性表现。
本病预后差。目前多主张采用手术广泛、彻底切除为主的综合疗法。随着鼻内镜技术的不断发展、对内镜解剖的认识不断加深,以及手术设备器械的改进,鼻内镜下鼻腔鼻窦恶性肿瘤切除术运用越来越广,其主要优点是:无面部切口,住院时间短,出血控制好,肿瘤边界清晰,术后并发症及死亡率低; 主要缺点是: 肿块难以整块切除[33]。但鼻内镜下额窦手术目前主要适用于额窦炎、良性病变切除术或肿瘤活检术,对于恶性肿瘤须采用额窦根治术鼻外径路,可切除额窦前壁、下壁、窦腔内容物、筛窦及鼻中隔上份;若肿瘤已破坏额窦后壁、颅底骨质可行冠状径路或联合开颅手术,必要时切除受累的硬脑膜及眶内容物,手术难度在于颅底的修复重建,须与神经外科团队联合[34],血管化的腹直肌肌皮瓣可用于修复皮肤和额叶基底的大量缺损[35]。术后给予放疗,酌情化疗。对于淋巴瘤,CHOP方案联合放疗能显著提高患者的5年无瘤生存率[36]。鼻窦转移癌患者的预后通常更差。治疗目标是改善或维持其生活质量,如缓解出血、疼痛等。治疗应根据肿瘤的位置和患者的整体健康状况而定,在大多数患者,可能只能予以姑息治疗,但只要有可能,单独手术切除或联合放射治疗可能对缓解症状有用,很少能延长生存期[37]。文献报道额窦恶性肿瘤5年生存率为44.2%,其中以成熟B细胞非霍奇金淋巴瘤生存率最高(72.3%),鳞癌为32.6%[19]。本组5例中以淋巴瘤化疗者治疗效果最好。
