支气管哮喘患儿肺泡灌洗液miR-98-5p及靶蛋白STAT3的表达与气道炎症的相关性分析
2021-11-06杜明红周云刘成军
杜明红,周云,刘成军
(1.重庆市涪陵区妇幼保健院 儿科,重庆 408000; 2.重庆医科大学附属儿童医院 重症医学科,重庆 400000)
支气管哮喘是儿科最常见的呼吸系统疾病之一,目前传统的治疗药物以控制症状、减少发作频率为主要目的[1]。对于疾病进展风险的评估,例如急性发作、肺功能下降、长期用药引起的不良反应等,都应纳入临床治疗考虑的范畴。由于支气管哮喘患儿气道炎症可能持续存在,即使临床症状得到缓解,但并不能证明已达到治疗目的[2]。因此,探索新的治疗靶点尤其是与气道炎症相关的分子机制,对于新型药物研发具有重要的指导价值。众多miRNAs被证实在肺部疾病的发生、进展过程中扮演着关键角色,例如唐晋等[3]发现miR-98-5p可靶向TLR4/MyD88/NF-κB信号通路,诱导急性肺损伤大鼠的肺泡巨噬细胞向M2型分化,从而减轻肺部炎症并保护肺泡组织的正常结构及功能。但是miR-98-5p是否可作为支气管哮喘治疗的分子靶点尚需要临床证据的支持。信号转导及转录激活因子3(signal transducer and activator of transcription 3, STAT3)是miR-98-5p的下游靶蛋白[4]。Chong等[5]已通过小鼠模型证实,STAT3与哮喘发病机制有潜在联系。本研究拟探讨支气管哮喘患儿肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中miR-98-5p和靶蛋白STAT3的表达变化及其与气道炎症的相关性,为寻找疾病进展和临床疗效的评估指标以及将来靶向药物的开发提供一定的证据支持。
1 对象和方法
1.1 研究对象
选取2017年1月至2020年5月于重庆市涪陵区妇幼保健院就诊的120例支气管哮喘患儿作为哮喘组,包括72例急性发作期患儿(BA-E组)和48例缓解期患儿(BA-R组)。其中,男87例,女33例;年龄1~12岁,平均(6.80±3.02)岁。纳入标准:(1) 符合《儿童支气管哮喘诊断与防治指南(2016年版)》[6]诊断标准。急性发作期定义为患者临床症状(包括呼吸困难程度、呼吸频率、脉搏频率等)和肺功能出现急性或亚急性恶化;临床缓解期定义为经或不经治疗,症状体征消失,肺功能恢复至急性前水平,并维持3个月以上。(2) 4周内没有接受皮质类固醇、免疫抑制剂、免疫调节剂或炎症递质拮抗剂治疗。排除标准:(1) 有变异性哮喘或其他过敏性疾病史者;(2) 4周内发生严重感染者;(3) 合并炎症性疾病、恶性血液系统疾病、免疫系统疾病、肿瘤或先天性疾病者。另外纳入20例因呼吸道发育畸形(3例)或支气管异物(17例)入院就诊的患儿作为对照组,排除感染病史、过敏性疾病史、免疫疾病史。其中男11例,女9例;年龄1~12岁,平均(6.40±3.19)岁。两组基本资料差异无统计学意义(P>0.05),见表1。本研究经医院伦理委员会批准;所有参与者的监护人在招募前提供了书面的知情同意书。
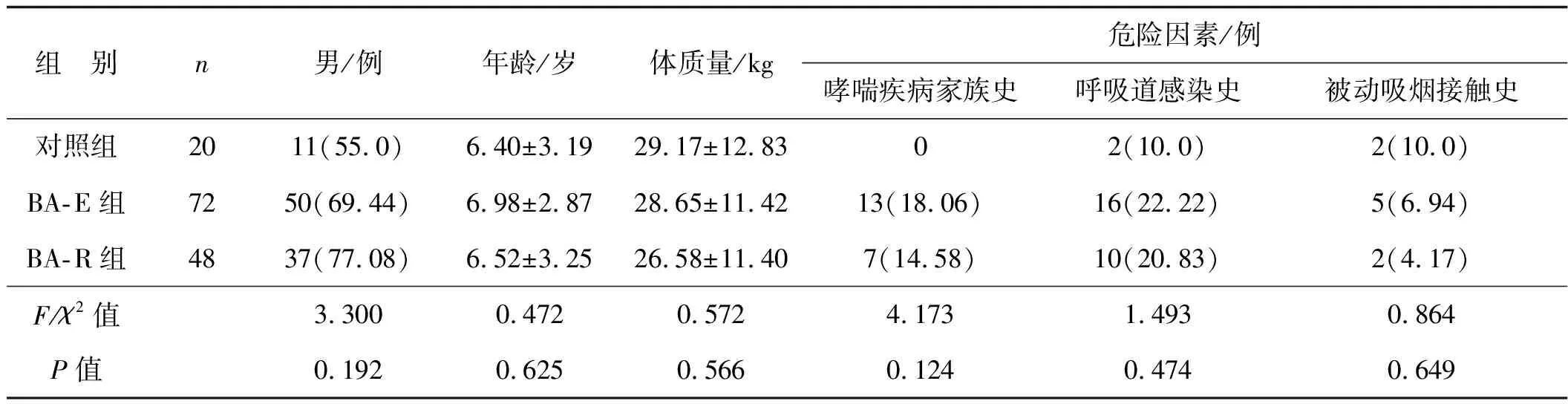
表1 3组入组受试儿童临床资料对比
1.2 检测指标及方法
1.2.1 样本收集及处理 根据欧洲呼吸学会儿童肺泡灌洗术的操作指南,所有患儿采用喉罩式气道和柔性支气管镜(Olympus BF-3C160型,日本奥林巴斯公司)在全身麻醉下进行灌洗;从右肺叶中段收集灌洗液,1 ml·kg-1·次-1,20~40 min·次-1。将BALF分为两部分:一部分用于病原学培养;另一部分离心,取细胞沉渣用于细胞学分析,取上清用于提取总RNA和细胞因子检测。
1.2.2 提取总RNA并采用实时荧光定量PCR法检测miR-98-5p相对表达量 采用mirVana miRNA Isolation Kit(美国Ambion公司)提取BALF总RNA,使用MicroRNA TaqMan逆转录试剂盒和TaqMan MicroRNA检测(美国Applied Biosystems公司)进行逆转录和荧光定量PCR。PCR扩增条件为95 ℃预变性10 min,然后进行40个循环(95 ℃→60 ℃→72 ℃),收集荧光信号。数据分析使用Livak和Schmittgen等描述的2-ΔΔCt方法。将数据用U6 mRNA内参校正。净循环阈值(net cycle threshold,CT)被用来计算每个样本的ΔCT值,使用U6 mRNA的平均CT作为参考。U6是miR-106a的内参。miR-98-5p正向序列为5′-TGCAGTAGATCTCAAAAAGCTACC-3′,反向序列为5′-CCTTGGCCATGTAAAAGTGC-3′,产物长度54 bp;U6正向序列为5′-CTCGCTTCGGCAGCACATATACTA-3′,反向序列为5′-ACGAATTTGCGTGTCATCCTTGC-3′,产物长度为79 bp。
1.2.3 ELISA法检测STAT3和气道炎症相关炎症因子的表达量 采用ELISA试剂盒检测BALF中白细胞介素(interleukin,IL)-6、IL-10、IL-13、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、总免疫球蛋白E(immunoglobulin E,IgE)。用试剂盒提供的标准品制作标准曲线,用线性回归分析确定标准曲线中的细胞因子浓度。所有实验均按照试剂盒说明书进行操作。
1.2.4 肺功能检查 使用PonyFX型肺功能仪(意大利COSMED公司)对哮喘患儿的肺功能进行检测,包括最大程度的深呼吸后用力呼气第1秒时候的气量容积(forced expiratory volume in one second,FEV1)、用力肺活量(forced vital capacity,FVC)、FEV1/FVC、用力呼气25%容量(MEF25)、MEF50、MEF75。检测前应稳定患儿情绪,并告知家长和儿童配合检查,对于5岁以下患儿,尽量在患儿熟睡状态下连续完成5次测试,若无法配合操作时,可以使用口服水合氯醛和鼻塞麻黄素滴鼻进行镇静,但整个过程应严格控制药物用量。
1.2.5 FeNO检测 受试患儿静坐,进行最大呼气,50 ml·s-1为测试的呼气流速,10 s(>6岁)或6 s(≤6岁)设定为呼出时间。采用NIOX一氧化氮测定仪(瑞典尼尔斯公司)检测FeNO,检测3次,取平均值。
1.2.6 双荧光素酶报告分析 先用生物信息学软件预测miR-98-5p的靶点为STAT3,为了验证两者的靶向结合关系,将含有miR-590-5p结合位点的野生型或突变型STAT3 3′-UTR片段克隆到pmirGLO载体(美国Promega公司)。然后,用脂质体2000试剂(美国Invitrogen公司)将HEK293T细胞与pmirGLO载体及miR-98-5p模拟物共转染。培养48 h后,取细胞进行裂解。使用双荧光素酶报告测定系统(美国Promega公司)检测萤火虫荧光强度/海肾荧光强度值,以反映不同处理组的相对荧光强度。
1.3 统计学处理

2 结 果
2.1 3组受试儿童BALF中miR- 98- 5p和STAT3水平
与对照组相比,BA-E组和BA-R组BALF中miR-98-5p相对表达量降低,STAT3水平升高,差异有统计学意义(P<0.05);而且与BA-R组相比,BA-E组miR-98-5p和STAT3水平变化更明显,差异均有统计学意义(P<0.05)。见表2。
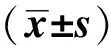
表2 3组受试儿童BALF中miR-98-5p和STAT3水平
2.2 生物信息学分析miR- 98- 5p和STAT3的靶向关系
生物信息学分析(TargetScan和microRNA.org)结果显示,miR-98-5p存在与STAT3 mRNA靶向结合的
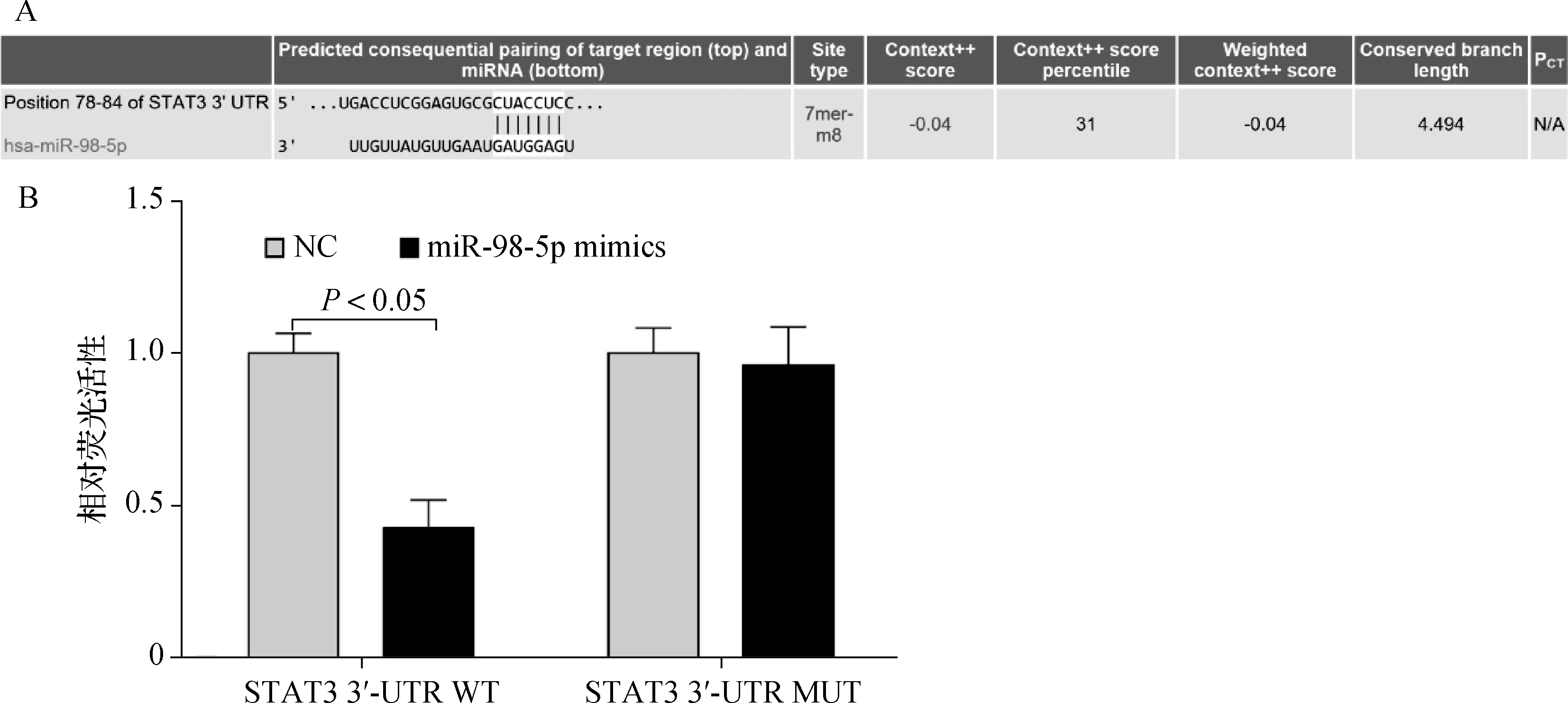
A. TargetScan在线软件预测miR-98-5p和STAT3 mRNA互补的保守序列;B. 双荧光素酶报告基因分析验证
保守序列(图1A)。根据双荧光素酶报告基因分析,miR-98-5p显著抑制包含野生型STAT3 3′-UTR的报告载体的荧光素酶活性(图1B)。然而,miR-98-5p对包含突变体STAT3 3′-UTR的报告载体的荧光素酶活性没有明显的影响(图1B)。
2.3 哮喘患儿肺功能、FeNO、气道炎症相关因子检测
与BA-R组相比,BA-E组FEV1、FEV1/FVC以及BALF中IL-10水平降低(均P<0.001),同时FeNO和BALF中IL-6、IL-13、TNF-α、总IgE水平均增加(均P<0.05),见表3。
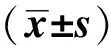
表3 2组哮喘患儿肺功能、FeNO、气道炎症相关因子检测结果
2.4 哮喘患儿BALF中miR- 98- 5p及STAT3与气道相关炎症因子的相关性
经Pearson相关性分析,哮喘患儿BALF中miR-98-5p与STAT3呈负相关(r=-0.659,P<0.05),同时与IL-6、IL-13、TNF-α、IgE亦呈负相关(均r<0,P<0.001),与IL-10水平则呈正相关(r=0.288,P=0.001);而BALF中STAT3水平与IL-6、IL-13、TNF-α、IgE均呈正相关(均r>0,P<0.001),与IL-10水平则呈负相关(r=-0.285,P<0.001)。见图2。
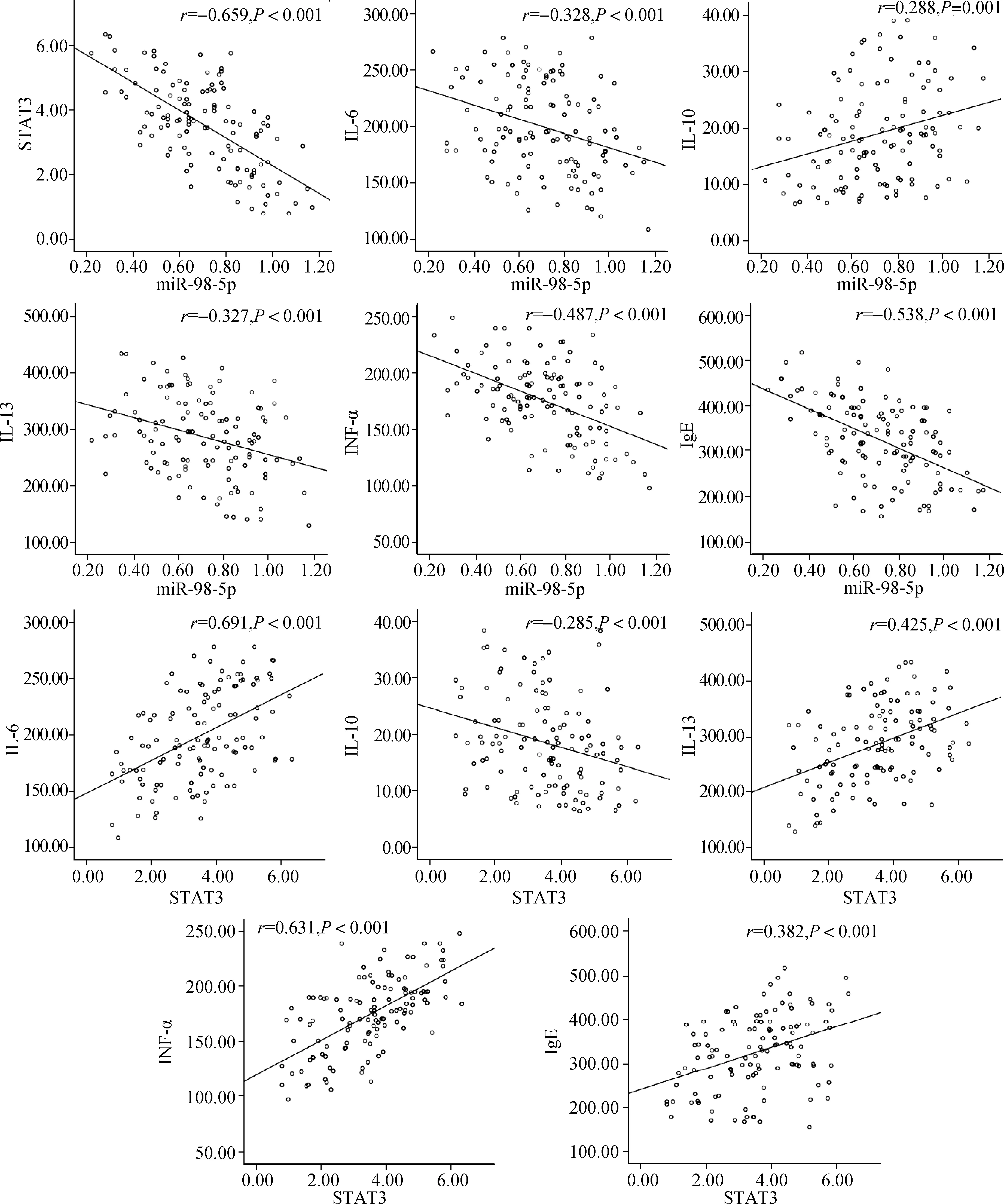
图2 哮喘患儿BALF中miR-98-5p及STAT3与气道相关炎症因子的相关性
3 讨 论
气道炎症是支气管哮喘最主要病理特征之一,多与组织损伤、细胞因子及生长因子的大量释放有关,可导致气道高反应性和气道平滑肌重塑[7]。气道炎症涉及多种信号转导过程,例如STATs通路等,这可能是影响气道炎症反应持续时间和强度的关键分子机制[8-10]。本研究结果显示miR-98-5p与STAT3存在靶向结合关系,哮喘患儿BALF中miR-98-5p相对表达量降低,同时STAT3水平升高,且两者与IL-6、IL-13、TNF-α、IgE、IL-10等炎症因子水平存在一定的相关性,说明miR-98-5p/STAT3轴可能是通过影响炎症因子参与哮喘的发生进展过程。
miR-98-5p在多种疾病中被证实属于炎症相关miRNAs。唐晋等[3]通过建立大鼠急性肺损伤模型发现,过表达miR-98-5p可明显缓解大鼠肺部病理学改变,降低BALF中促炎因子IL-6、IL-1β、TNF-α的分泌水平,同时增加抗炎因子IL-10的分泌,说明上调miR-98-5p可减轻脓毒症诱导的肺部炎症反应并保护肺泡组织的正常结构及功能。刘继红等[11]通过细胞实验证实,miR-98可能通过负性调控NF-κB信号通路抑制ox-LDL诱导的动脉粥样硬化早期血管内皮损伤过程。本研究BA-E组和BA-R组哮喘患儿BALF样本中miR-98-5p相对表达量较对照组儿童降低,而且与BA-R组患儿相比,BA-E组患儿BALF样本中miR-98-5p降低水平更明显。这些证据都证实miR-98-5p可能参与了哮喘发病和进展过程。哮喘患儿BALF中miR-98-5p与促炎因子IL-6、IL-13、TNF-α、IgE水平呈负相关,而与抗炎因子IL-10水平则呈正相关,说明哮喘患儿BALF中miR-98-5p表达降低与气道炎症反应存在一定的关联,可能通过加重气道炎症反应进而诱导哮喘急性发作。
为了探讨miR-98-5p在哮喘中的作用机制,本研究分析了其潜在靶基因之一STAT3在BALF中的水平变化。STATs属于细胞因子和生长因子诱导的转录因子家族,在免疫和体液反应中起关键作用[12]。在细胞因子刺激下,STATs通过受体相关JAK激酶家族成员酪氨酸残基的磷酸化而被激活[13]。Src激酶家族也被证明通过生长因子和细胞因子介导STAT酪氨酸磷酸化;这种磷酸化通过对-Tyr-SH2结构域相互作用导致构象变化,从而使STATs转移到细胞核,在那里它们与序列特异性、DNA结合元件结合以调节转录[14]。Chong等[5]证实,瘦素可通过激活STAT3信号通路诱导肥胖性哮喘的气道炎症反应。Yu等[15]亦证实,糖皮质激素通过抑制MEK/JAK/STAT信号通路的激活调节ILC2s的转录表达,进而有效地降低气道炎症反应,达到缓解症状的目的。 本研究BA-E组和BA-R组BALF样本中STAT3水平均高于对照组,同时BALF中STAT3水平与IL-6、IL-13、TNF-α、IgE均呈正相关,与IL-10水平则呈负相关。说明STAT3与促炎因子激活有关,这与之前的发现基本一致。通过TargetScan数据库检索和双荧光素酶报告基因分析证实,STAT3是miR-98-5p的靶标之一,而且通过Pearson相关性分析,哮喘患儿BALF中miR-98-5p与STAT3呈负相关,说明miR-98-5p/STAT3轴与哮喘患儿气道炎症反应有关,可能在哮喘中发挥关键作用。此外,miR-98-5p/STAT3 轴被证明与哮喘患者肺通气功能有关。这可能是:(1) miR-98-5p表达降低可激活STAT3等炎症相关因子的表达,进而通过提高炎症细胞因子水平加重反应,从而增加了哮喘急性发作的风险;(2) miR-98-5p/STAT3 轴也可能通过招募炎症细胞引起支气管和肺泡细胞损伤,从而加重肺部炎症,提高哮喘疾病恶化的风险。因此,局部阻断STAT3或上调miR-98-5p相对表达量可能是未来治疗或逆转哮喘的一个有吸引力的策略。
综上,支气管哮喘患儿BALF中miR-98-5p相对表达量降低,同时STAT3蛋白水平升高,两者存在一定的靶向调控关系。miR-98-5p/STAT3轴的激活在一定程度上可反映患儿气道炎症严重程度,进而为支气管哮喘患儿的临床治疗和病情进展评估提供参考。
