豆渣蛋白-植物甾醇纳米颗粒的制备及其性质表征
2021-11-05骆兆娇沈晓梅江轶群杨娟王金梅
骆兆娇,沈晓梅,江轶群,杨娟,王金梅*
(1.华南理工大学食品科学与工程学院,广东广州 510640)(2.岭南师范学院食品科学与工程学院,广东湛江 524048)
植物甾醇(Phytosterol,PS)是一种广泛存在于植物细胞膜中的天然活性成分,具有降低胆固醇、抗动脉粥样硬化、抗癌、抗炎等生理作用[1-3]。然而,植物甾醇的亲脂晶体结构导致其既不溶于水也不溶于油脂[4],生物利用度极差,肠道吸收率仅为1.5%~5%[5]。有学者试图将酯化后的甾醇掺入高脂食品以提高其生物可及性[6],但高脂食品的摄入仍存在健康隐患。因此,开发水溶性和水分散植物甾醇对扩大其在食品领域的应用具有重要意义。乳化及包埋是常用的两种手段。Sarah等[7]构建了基于蔗糖单月桂酸酯、丙二醇和油酸乳酸酯的微乳液体系,对植物甾醇显示出高增溶能力。Cao等[8]通过乳化蒸发技术制备了蛋白基植物甾醇纳米颗粒,可有效提高甾醇的生物利用率。Meng等[9]以β-环糊精为包材可将甾醇水溶性提升至8.68 mg/mL。遗憾的是,这些方法在工业化生产上具有较大的局限性。
白蛋白纳米结合技术(Nanoparticle albumin-bound technology,Nab)是指在高压微射流处理下白蛋白分子间二硫键发生交联从而形成复合纳米颗粒的药物输送技术,可避免表面活性剂和交联剂的使用。美国Abraxis生物科技公司通过Nab技术制备的水溶性白蛋白结合型紫杉醇可使紫杉醇的生物可及性提高32%[10]。Nab技术良好的输送特性主要归因于高压微射流可诱导白蛋白分子二硫键的形成与交联,形成稳定的聚合物壳体保护活性成分。Liu等[11]人以富含二硫键的大豆Bowman-Birk型抑制剂(BBI)为载体通过反溶剂法制备了BBI-姜黄素纳米颗粒,明显提高了姜黄素的水溶性与生物利用度。蛋白质-姜黄素之间的疏水相互作用为纳米颗粒形成的主要驱动力。
豆渣作为大豆加工过程中的副产物,仍含有15%左右的蛋白质,且这些蛋白质疏水性较高,且含有较多的二硫键[12,13],有可能可以作为植物甾醇的一种较为理想的包材。目前关于豆渣蛋白的研究多集中于蛋白提取、功能性质分析与改性方法,应用型研究也多限于抗氧化活性肽[14]。本文拟以豆渣蛋白为原料,采用反溶剂技术结合高压微射流处理制备豆渣蛋白-植物甾醇纳米颗粒,并对其性质进行表征,以期提高植物甾醇的生物可及性,扩大其在食品领域的应用。
1 材料与方法
1.1 材料与试剂
豆渣粉,Dumas法测定其蛋白含量为15.30%±0.02%(N×6.25,干基),购于山东香驰粮油公司;植物甾醇(PS)购于西安Realin生物科技有限公司,β-谷甾醇82.45%、豆甾醇10.02%,菜油甾醇3.32%及其他成分4.21%。5α-胆甾烷标准品、5,5-二硫基-2-硝基苯甲酸(DTNB)均由阿拉丁实业有限公司提供(上海,中国);其他化学试剂均为分析纯。
1.2 仪器与设备
DELTA冷冻干燥机,德国Christ公司;Nano-ZS纳米粒度分析仪、Mastersizer 3000+EV微米粒度仪,英国Malvern公司;Sonic Ruptor 400超声细胞破碎仪,美国OMNI公司;UVA2300紫外可见分光光度计,上海天美公司;T25高速剪切机,德国IKA公司;M-110EH高压微射流纳米均质机,美国Microfluidics公司。
1.3 方法
1.3.1 豆渣蛋白的制备
采用碱溶酸沉法提取豆渣蛋白[15]:按照1:20的料液比加入去离子水,用2 mol/L NaOH调节pH至12,搅拌2 h后离心(8000 r/min×30 min)。用2 mol/L盐酸调节上清液pH至4.5,离心(8000 r/min×15 min)并洗涤沉淀,用7倍体积的去离子水重新溶解沉淀,回调pH至7.5,4 ℃透析48 h,冷冻干燥得到豆渣蛋白。蛋白纯度为70.48%±0.35%(N×6.25,干基)。
1.3.2 豆渣蛋白-植物甾醇纳米颗粒的制备
用去离子水配制1%(W/W)的豆渣蛋白溶液,磁力搅拌2 h后调pH值至7.0,于4 ℃条件下水化过夜。将适量PS溶于无水乙醇,45 ℃水浴搅拌30 min,在6000 r/min剪切速率下将PS溶液于1 min内注入豆渣蛋白分散液,剪切3 min后进行超声(功率280 W,时间15 min,间隔70%)后,进行高压微射流均质3次(0~120 MPa),离心(1000 r/min×10 min),上清液冷冻干燥即为豆渣蛋白-甾醇纳米颗粒(OP-PS)。其中,植物甾醇在终体系的浓度为1 mg/mL。以大豆分离蛋白作为对照(SPI-PS)。
1.3.3 粒度及ζ-电位
取复合纳米颗粒溶液稀释至1 mg/mL,于25 ℃室温下测定颗粒平均粒径(Size)、多分散指数(PDI)及ζ-电位(ζ-potential),每个平行测定三次。
1.3.4 游离巯基及二硫键
游离巯基及二硫键的测定参考Beveridge[16]的方法:称取50 mg纳米颗粒样品溶于10 mL Tris-Gly-Urea缓冲液,离心(8000 r/min,10 min)分别取两份2 mL上清液:一份加入80 μL的Ellman’s溶液,混匀后放置5 min,在412 nm下测定吸光值(A412);另一份加入0.2%二硫苏糖醇(DTT)处理2 h后加入三氯乙酸(TCA),离心后(8000 r/min,10 min)用3 mL缓冲液溶解沉淀,同样在412 nm下测定吸光值。其中:
游离巯基(SHF)、总巯基(SHT)=73.53×A412/C(μmol/g蛋白质)
二硫键=(SHT-SHF)/2(μmol/g蛋白质)
1.3.5 PS包埋率
参考彭捷[17]的方法测定甾醇的包埋率。
准确取2 mg样品于10 mL血清瓶中,加入100 μL 5α-胆甾烷作为内标,再加入2 mL 2.5 mol/L氢氧化钾-乙醇溶液后加盖密封,剧烈震荡后置于70 ℃皂化1 h。反应结束后迅速冷却至室温,分别加入1 mL去离子水和3 mL正己烷,加盖密封。剧烈震荡3 min,静置分层,将上层转移至10 mL容量瓶中。继续用正己烷重复萃取3次,每次加正己烷2 mL,震荡1 min,最后合并正己烷层。合并后的正己烷萃取液经1 g无水硫酸钠干燥后,置于气相色谱的液体进样瓶中,待测。
气相色谱测定参数:HP-5柱(30 m×0.25 mm×0.25 μm),柱温300 ℃,进口温度330 ℃,检测器温度330 ℃,分流比5:1,氮气流量:0.5 mL/min,上样量4 μL。采用以下公式对植物甾醇含量进行定量计算:
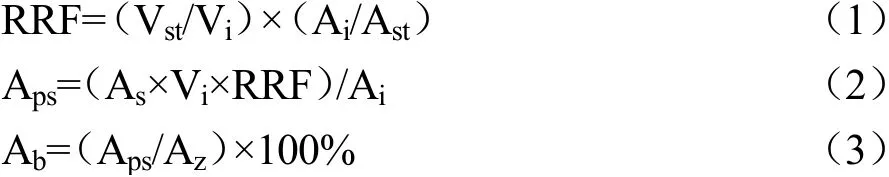
式中:
RRF——相对响应因子;
Vi——内标含量,mg/mL;
Vst——标准品含量,mg/mL;
Ai——内标峰面积;
Ast——标准品峰面积;
As——样品峰面积;
Aps——样品中植物甾醇的含量,mg/mL;
Az——样品中甾醇的总添加量,mg/mL;
Ab——样品中植物甾醇的包埋率,%。
1.3.6 X射线衍射(XRD)
利用D8 ADVANCE衍射器(德国Bruker公司)测定OP-PS冻干粉的结晶度。将样品平铺至玻璃载片上,铜靶Kα辐射(λ=0.15418 nm),狭缝DS=1 mm;Ni滤波片,管压40 kV,管流40 mA。以0.05步/s的速度从2 °到30 °对测试样品进行连续扫描。用JADE 5软件对测试数据进行分析。
1.3.7 储藏稳定性
取OP-PS溶液(10 mg/mL)加入叠氮钠(0.04%,m/V),密封于带盖的玻璃瓶中,室温贮存50 d,测定其粒径和甾醇含量变化,测试方法参考1.3.3和1.3.4。
1.3.8 热稳定性
取OP-PS冻干粉分散在缓冲液(pH 7.0)中,搅拌2 h,获得OP-PS溶液(10 mg/mL)。将溶液密封于带盖的玻璃瓶中,分别于90 ℃(水浴锅)和120 ℃(高压灭菌锅)内热处理15 min。热处理结束后,冰浴冷却至室温,对热处理后的纳米颗粒样品进行粒径和甾醇含量进行测试,测试方法参考1.3.3和1.3.4。
1.3.9 数据分析
实验数据为三次测定平均值,采用SPSS 16.0方差分析(ANOVA,Duncan)比较样品平均值间的显著差异(p<0.05)。
2 结果与讨论
2.1 不同均质压力对豆渣蛋白-植物甾醇纳米颗粒的影响
颗粒在溶液中的尺度及表面电荷数量与胶体体系的稳定性密切相关。一般而言,粒径越小且表面电荷多的颗粒越不容易聚集,更趋于稳定。图1a、b反映了不同均质压力下豆渣蛋白-植物甾醇纳米颗粒的粒径及电位变化。在未经高压微射流处理时,OP-PS颗粒的粒径(239.03 nm)较SPI-PS(163.89 nm)大,这可能与豆渣蛋白的溶解性较SPI差有关。随着均质压力的增大,OP-PS颗粒的粒径呈明显的降低趋势。经120 MPa高压均质3次后,颗粒的粒径可达139.28 nm,PDI为0.18,且溶液也较未高压均质的样品更澄清透明,这意味着高压微射流处理能显著减小颗粒尺度,使其具有更稳定的结构。Zhang等人[18]在反溶剂制备头孢呋辛酯纳米颗粒时发现,较高的搅拌速率有利于形成更小且更均匀的药物颗粒,与本文结果一致。通常情况下,胶体体系电位的绝对值大于30 mV时被视为稳定状态[19]。如图1B所示,SPI-PS和OP-PS体系中电位的绝对值均大于30 mV,表明二者具有不错的稳定性。OP-PS颗粒的ζ-电位绝对值高于SPI-PS,说明OP-PS表面存在更多电荷,更利于借助静电相互作用维持其体系的稳定。
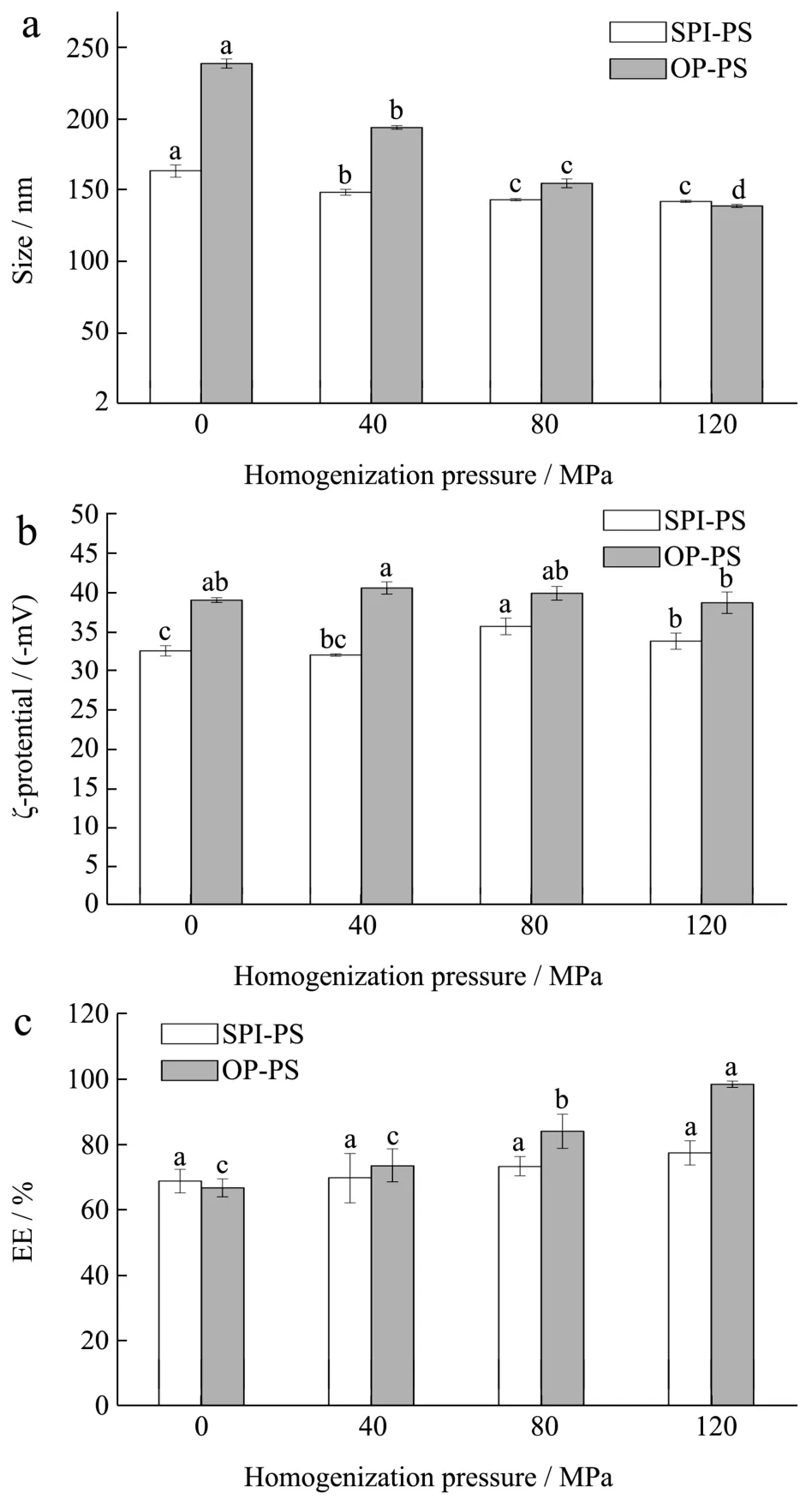
图1 均质压力对蛋白-植物甾醇纳米颗粒粒径(a)、电位(b)和包埋率(c)的影响Fig.1 Effects of homogenization pressure on size (a), ζ-potential(b) and encapsulation efficiency of protein-phytosterol nanoparticles (p<0.05)
在蛋白基胶体颗粒中,活性物质的包埋率是评价输送体系优劣的重要指标。如图1c所示,未经高压均质的SPI-PS和OP-PS颗粒中PS的包埋率分别为68.89%和66.84%。在反溶剂过程中,PS在蛋白溶液中迅速分散并通过疏水相互作用与蛋白结合成可溶性颗粒。对二者进行高压微射流处理后,PS的包埋率得到明显提高,这可能归因于高压微射流较强的机械效应能更好地抑制PS在反溶剂过程中形成较大的晶体而析出。越高的均质压力处理后得到的复合颗粒粒径越小也证实了高压微射流能减少PS聚集。OP-PS经120 MPa微射流循环处理3次后PS的包埋率可提升至98.63%,明显高于SPI-PS(77.73%)。这可能与豆渣蛋白具有更多的游离巯基,在高压微射流作用下可形成更多的二硫键并发生交联以减少PS的析出有关。
表1 比较了不同均质压力处理后SPI和OP中游离巯基及二硫键的含量。结果显示,随着均质压力的增大,OP中游离巯基含量明显减少且二硫键含量显著提升。这是因为OP中游离巯基在高压均质产生的超氧化离子的作用下会发生氧化,形成新的二硫键。豆渣蛋白中游离巯基的数量(6.50 μmol/g蛋白质)远高于SPI(3.95 μmol/g蛋白质),因此经过高压微射流处理后会形成更多的二硫键并交联,使颗粒的结构更加致密稳定。

表1 均质压力对蛋白游离巯基及二硫键的影响Table 1 Effects of homogenization pressure on free sulfhydryl group and disulfide bond of protein
2.2 豆渣蛋白-植物甾醇纳米颗粒的结构分析
对OP-PS纳米颗粒进行X射线衍射可确定其晶体结构,其衍射图谱如图2所示。单纯的植物甾醇在7 °和9 °左右会出现较为明显的结晶峰,将OP与PS按10:1的质量比混合均匀后进行XRD分析,结晶峰的位置与单纯的植物甾醇相同。单纯的豆渣蛋白在2~30 °内并未出现明显的结晶峰,OP-PS纳米颗粒的XRD图谱趋近于一条直线,这说明以豆渣蛋白为原料荷载植物甾醇可有效降低其结晶度,使其以无定型形式存在。一般而言,甾醇的高结晶度正是其生物利用率低的原因,因此采用高压微射流技术制备OP-PS颗粒可能会提高植物甾醇的生物可及性和生物利用率。

图2 豆渣蛋白-植物甾醇纳米颗粒的X射线衍射图Fig.2 X-ray diffraction pattern of OP-PS nanoparticles freeze-dried powder
2.3 豆渣蛋白-植物甾醇纳米颗粒的复溶特性
表2 比较了新制蛋白-甾醇纳米颗粒及冻干样品复溶后的平均粒径、分散指数和ζ-电位值(样品均经过120 MPa高压微射流循环3次)。新制颗粒的平均粒径在140 nm左右,PDI均未超过0.2,分散性良好。将冻干后的蛋白-甾醇颗粒进行复溶,OP-PS和SPI-PS的粒径都存在着不同程度的增加,PDI也明显上升,这表明冷冻干燥会促进颗粒聚集与分散性恶化。OP-PS复溶液粒径的增加幅度明显小于SPI-PS,意味着OP-PS的结构稳定性强于SPI-PS。结合不同蛋白中游离巯基的数量分析,OP含有更多的游离巯基,经高压微射流处理后迅速氧化成二硫键并交联,对PS的保护作用优于SPI,因此冻干后粒径变化更小。冻干前后,OP-PS颗粒的Zeta电位并无显著差异,说明冻干处理对颗粒表面电荷数量影响不大。

表2 蛋白-植物甾醇纳米颗粒的平均粒径(Size)、分散指数(PDI)、ζ-电位(ζ-potential)Table 2 Size, PDI and ζ-potential of protein-phytosterol nanoparticles
2.4 豆渣蛋白-植物甾醇纳米颗粒的稳定性
高压微射流处理能有效提升OP-PS颗粒的稳定性。由图3a可知,经高压微射流处理后的颗粒在常温储存过程中粒径变化幅度较未处理的颗粒小,表明其物理稳定性明显优于未处理的颗粒。高压处理后的颗粒放置50 d后PS损失幅度更小也说明高压微射流处理有助于提升颗粒的储藏稳定性。高压微射流处理诱导OP分子间二硫键的形成可能是颗粒稳定性提升的内在原因。在高压均质作用下,OP游离巯基氧化形成分子间二硫键,且原有的分子内二硫键也可能断裂重新形成分子间二硫键并交联,进而提高颗粒的稳定性。经120 MPa处理的SPI-PS颗粒在储藏30 d内的粒径增长幅度始终高于OP-PS,这意味着着OP-PS的结构稳定性较SPI-PS好。放置50 d后SPI-PS和OP-PS颗粒中PS的包埋率分别由77.73%和98.63%降至57.31%和66.90%,说明在常温贮藏过程中,PS都存在着不同程度的损失。但无论是新制颗粒还是储藏50 d后的样品,以OP为原料制备的颗粒中PS的包埋率总远高于SPI,这表明相较于用SPI荷载PS,以OP为载体更能减少贮藏过程中PS的损失。这一结果与高压微射流能诱导更多二硫键形成并交联有关,120 MPa高压均质后的OP-PS颗粒中二硫键的数量(56.42 μmol/g蛋白质)远高于SPI-PS(36.97 μmol/g蛋白质)也印证了这一点。
图3 蛋白-植物甾醇纳米颗粒分散液储存50 d后的粒径(a)及甾醇荷载率(b)变化Fig.3 Changes in particle size (a) and encapsulation efficiency(b) of protein- phytosterol nanoparticle dispersion after 50 days of storage different letters represent significant differences among different samples (p<0.05)
热稳定性也是评价颗粒是否稳定的重要指标之一,图4反映了不同蛋白-甾醇颗粒经热处理后平均粒径及甾醇包埋率的变化。热处理后OP-PS的粒径明显增大且PS包埋率也存在不同程度的降低,这说明高压微射流处理对颗粒热稳定性的提升效果不大。在90 ℃处理15 min的条件下,OP-PS粒径明显高于SPI-PS,这可能是由于豆渣蛋白的热聚集程度高于SPI,从而导致了更大的颗粒尺度。OP-PS中PS的包埋率总显著高于SPI-PS,说明OP-PS的耐热性优于SPI-PS,这可能归因于OP中更多的二硫键在高压微射流处理过程中发生了交联,使其结构更加稳定。

图4 蛋白-植物甾醇纳米颗粒经不同热处理后的粒径(a)及甾醇荷载率(b)变化Fig.4 Changes in particle size (a) and encapsulation efficiency of phytosterol (b) of protein-phytosterol nanoparticles after different heat treatments.
3 结论
采用高压微射流技术制备豆渣蛋白-植物甾醇纳米颗粒能极大改善植物甾醇的水分散性。随着均质压力的增加,纳米颗粒表现出更小的尺度与更高的甾醇荷载能力,且稳定性也得到明显提升。经120 MPa高压微射流处理3次后的OP-PS颗粒结构稳定且包埋率高(98.63%)。与SPI-PS相比,OP-PS的重分散性更好,且稳定性更优。这是由于OP中更多的游离巯基含量更易于在高压微射流处理中氧化生成分子间二硫键并交联,使颗粒的结构更加紧凑稳定。
