辣木籽异硫氰酸酯衍生物抑制结肠癌HCT-116细胞的生长和迁移
2021-11-05杨茗茸杨扬彭麟杰毛家英盛军解静田洋
杨茗茸,杨扬,彭麟杰,毛家英,盛军,3,解静,3*,田洋,3*
(1.云南农业大学食品科学技术学院,云南昆明 650201)(2.国家辣木加工技术研发专业中心,云南昆明 650201)(3.教育部食药同源资源开发与利用工程中心,云南省药食同源功能食品开发工程中心,云南昆明 650201)
结直肠癌作为一种常见的消化道恶性肿瘤,在世界范围内严重威胁人类健康,其发病率高居全球第三位,是导致癌症相关死亡的第二大病因[1-3]。结直肠癌主要通过手术切除和化学疗法治疗,但结肠癌患者的传统手术治疗大多会出现高复发、低预后的情况[4],且辅助化疗价格昂贵,并易产生毒性及耐药性[5,6]。因此,探索低毒、高效的抗肿瘤药物正成为结肠癌治疗研究领域的新热点。
辣木(Moringa oleiferaLam.)为辣木科辣木属多年生热带乔木。作为一种新开发利用的食品,近年来,对辣木保健食品开发及有效成分的提取多有研究。辣木籽是辣木的种子,除了具有丰富的蛋白质、油脂、维生素、多糖等营养物质[7],同时富含多种活性成分。研究发现,辣木籽具有抗氧化[8]、抗菌[9]、抗癌[10]、降血糖血脂[11,12]等作用。
异硫氰酸酯类化合物(Isothiocyanates,ITCs)是广泛存在于十字花科植物中的一类含硫有机化合物,具有多种生物学活性[13-15]。大量研究表明,辣木籽异硫氰酸酯化合物具有抗炎[16]、降血压[17]、抗菌[18]、抗癌[19]等活性。其中,对肝癌Hep 3B细胞[20]、结肠癌Caco-2细胞[21]、人前列腺癌PC-3细胞[22]的增殖具有抑制作用,也可通过调节NF-κB和凋亡相关因子抑制SH-SY5Y人神经母细胞瘤细胞生长[23]。
异硫氰酸酯已被证明是具有活力的天然抗癌产物,但部分异硫氰酸酯由于其独特的化学结构,在温度、pH值、光照、溶剂等因素的影响下易降解[24-26]。此类辣木籽异硫氰酸酯(MITC)对热不稳定[27],有待优化结构。课题组前期对MITC进行了结构优化,并合成了一系列的MITC衍生物,通过抗癌活性筛选发现MITC-21的抗癌活性最佳。因此,本研究在前期工作基础上,进一步探讨MITC-21对HCT-116细胞增殖、凋亡和迁移的调控作用,明确MITC-21抑制HCT-116细胞生长和迁移的效果,为辣木资源的有效利用及结肠癌的防治奠定科学依据。
1 材料与方法
1.1 材料
1.1.1 样品与试剂
人结肠癌细胞(HCT-116)、人胃粘膜细胞(GES-1)、人前列腺癌细胞(PC-3)、人肾透明细胞腺癌细胞(786-O)、人宫颈癌细胞(Hela)、人乳腺癌细胞(MDA-MB-231)购自中国科学院典型培养物保藏委员会细胞库,MITC、MITC-21由教育部食药同源资源开发与利用工程中心提供。F/12培养基,Hyclone公司;胎牛血清,BI公司;Bax、Bcl-2、MMP2、β-tubulin一抗,Abcam公司;噻唑蓝MTT,sigma公司;结晶紫,阿拉丁生化科技股份有限公司;细胞凋亡检测试剂盒,翊圣生物有限公司;RIPA及PMSF,索莱宝生物技术公司;BCA测定试剂盒,碧云天生物技术有限公司;超敏ECL化学发光试剂盒,万类生物科技有限公司。
1.1.2 仪器与设备
低速离心机,安徽中科中佳科学仪器有限公司;CO2培养箱,德国宾德;多功能酶标仪、倒置显微镜,上海蔡康光学仪器有限公司;细胞计数器,Count star;Molecular Devices;恒温金属浴,上海一恒科技有限公司;电泳仪,北京六一生物科技有限公司;曝光机,科锐;高速冷冻离心机,(CT15RE)Hitachi;流式细胞仪,BDC6。
1.2 实验方法
1.2.1 辣木籽异硫氰酸酯衍生物制备
加入辣木籽中提取的异硫氰酸酯与3,5-二溴邻氨基氨基苯甲酸以乙醇作溶剂加入三乙胺催化,在90 ℃条件下反应,置于油浴锅中进行,通过薄层层析点板的方法检测,到产生新物质后结束反应,反应结束后通过沙漏冲洗法和柱层析法分离出产物后蒸干。
1.2.2 细胞培养
细胞培养在含有10%胎牛血清和1%双抗的F/12培养基中,并置于37 ℃,5%的CO2培养箱中,每隔两天传代一次。
1.2.3 MTT法检测细胞存活率
收集对数生长期的细胞,胰蛋白酶消化后计数,以1×104cells/孔接种于96孔板中,于37 ℃,5% CO2培养箱中培养12~24 h,分别用不同浓度的MITC-21(0、0.5、1、2、4、8和16 µmol/L)处理细胞24、48、72 h,移除培养基,加入100 μL浓度为0.25 mg/mL的MTT溶液,孵育4 h后终止培养,移除MTT溶液,每孔加入100 μL DMSO,振荡10 min至结晶充分溶解,在酶标仪OD490nm处检测各孔的吸光度值,计算细胞存活率。
1.2.4 克隆形成实验
收集对数生长期的HCT-116细胞,胰蛋白酶消化后计数,以500 cells/孔接种于6孔板中培养24 h,用不同浓度的MITC-21(0、2和4 µmol/L)处理24、48、72 h,更换正常培养基继续培养至空白对照组细胞生长至80%后,吸弃培养基,用磷酸盐缓冲液清洗两次,甲醇固定10 min,用0.1%结晶紫染色30 min,洗涤晾干后拍照,并用10%的冰乙酸溶解结晶紫,在酶标仪OD560nm处测量吸光值,计算克隆形成率。
1.2.5 倒置显微镜观察细胞形态变化
收集生长状态良好的HCT-116细胞,以适当浓度接种于6孔板中培养12~24 h,用不同浓度的MITC-21(0、2和4 µmol/L)处理48 h,倒置显微镜下观察细胞形态变化,并拍照。
1.2.6 流式细胞术检测细胞凋亡
取对数生长期细胞接种于6孔板中,每孔2×105cells,过夜贴壁生长,采用不同浓度的MITC-21(0、2和4 µmol/L)处理细胞24、48、72 h,用预冷的磷酸盐缓冲液清洗后,胰蛋白酶消化收集细胞于离心管中,300 g,4 ℃离心5 min,弃上清液收集细胞,用PBS清洗2次。使用100 μL 1×Binding Buffer重悬细胞,加入5 μL Annexin V-FITC和10 μL PI Staining Solution,避光、室温反应10~15 min。加入400 μL 1×Binding Buffer,混匀后放置于冰上,样品在1 h内用流式细胞仪检测。
1.2.7 细胞划痕实验
取对数生长期的HCT-116细胞接种于60 mm培养皿中培养,待过夜贴壁生长后,用枪头对细胞层划痕,加入磷酸盐缓冲液清洗,用不同浓度的MITC-21(0、2和4 µmol/L)处理细胞,48 h后拍照观察细胞划痕愈合情况。
1.2.8 Western blot法检测相关蛋白表达量
取对数生长期细胞接种于60 mm培养皿中,每孔5×105个,于37 ℃,5% CO2培养箱中过夜贴壁生长,加入不同浓度的MITC-21(0、2和4 µmol/L)处理细胞48 h,吸弃培养基,用预冷的磷酸盐缓冲液清洗后,使用RIPA裂解液和PMSF(RIPA:PMSF=100:1)提取总蛋白,BCA法测定蛋白浓度。在质量分数10%的聚丙烯酰胺凝胶上分离后,将蛋白质转移到聚偏二氟乙烯(PVDF)膜上,用5%的脱脂奶粉在室温下封闭1 h,与一抗在4 ℃下过夜孵育。第2 d用1×TBST清洗PVDF膜3次,再将PVDF膜与相应二抗在室温下孵育1 h,1×TBST清洗3次,最后用曝光仪曝光显影。
1.2.9 数据处理与分析
使用Graphpad prism、ImageJ、SPSS等软件进行分析统计,组间比较采用单因素方差分析,*表示p<0.05,**表示p<0.01,***表示p<0.001。
2 结果与讨论
2.1 MITC-21对HCT-116细胞存活率的影响
MITC、MITC-21结构式如图1a所示。首先采用MTT法对MITC-21进行抗癌活性筛选。研究发现,与对照组相比,MITC-21剂量为10 µmol/L时,PC-3细胞、HCT-116细胞、Hela细胞和MDA-MB-231细胞的存活率受到其显著抑制,且抑制率分别为18.72%(p<0.01)、59.87%(p<0.001)、54.4%(p<0.001)和53.87%(p<0.001)(表1)。结果表明,MITC-21具有一定的抗癌活性,且其对结肠癌HCT-116细胞的抗癌活性最为显著。因此,在后续的实验中,进一步探究MITC-21对HCT-116细胞生长和迁移的抑制作用。
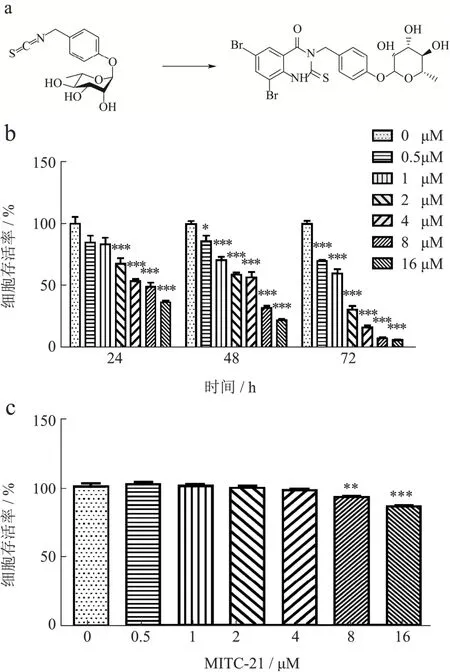
图1 辣木籽异硫氰酸酯及衍生物对HCT-116细胞及GES-1细胞存活率的影响Fig.1 Effects of Moringa oleifera seeds isothiocyanate and its derivatives on the survival rate of HCT-116 cells and IEC-6 cells
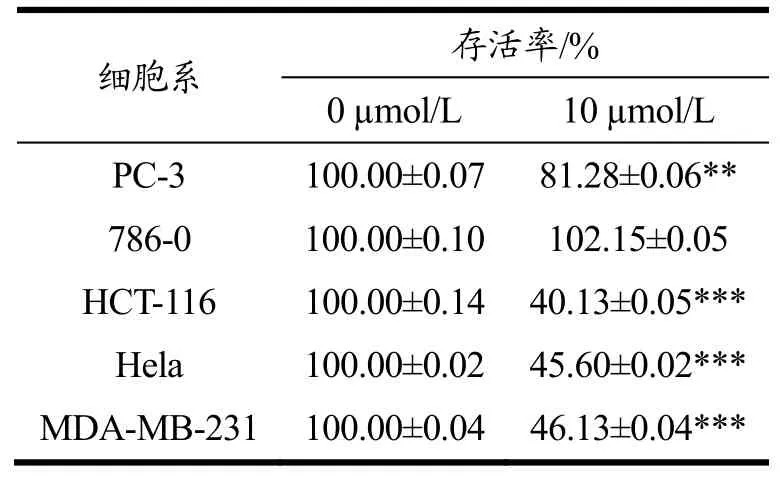
表1 辣木籽异硫氰酸酯衍生物对5种癌细胞存活率的影响Table 1 Effect of Moringa oleifera seeds isothiocyanate derivatives on the survival rate of five kinds of cancer cells
为了进一步研究MITC-21抑制HCT-116细胞生长是否具有时间和剂量依赖性,采用不同浓度的MITC-21(0、0.5、1、2、4、8和16 µmol/L)处理结肠癌HCT-116细胞24、48和72 h,并使用MTT法检测细胞存活率。研究发现,随着MITC-21浓度的增加,细胞存活率逐渐降低,并且在MITC-21处理HCT-116细胞24 h后,细胞存活率从100.00%降低到84.84%、83.98%、67.86%(p<0.001)、54.09%(p<0.001)、49.68%(p<0.001)和36.42%(p<0.001);处理48 h后细胞存活率从100.00%降低到86.09%(p<0.05)、70.90%(p<0.001)、59.14%(p<0.001)、56.90%(p<0.001)、32.24%(p<0.001)和22.03%(p<0.001);处理72 h后细胞存活率从100.00%降低到94.21%(p<0.001)、93.68%(p<0.001)、85.25%(p<0.001)、72.49%(p<0.001)、69.07%(p<0.001)和42.94%(p<0.001)(图1b)。三个时间段的半致死剂量(IC50)分别为6.79µmol/L、3.71 µmol/L、1.13 µmol/L。结果表明,MITC-21呈时间和剂量依赖性的方式显著抑制HCT-116细胞存活率。为了研究MITC-21对正常细胞是否具有毒性,使用相同剂量的MITC-21处理人胃粘膜细胞(GES-1)。研究发现,MITC-21对GES-1细胞的存活率没有太大影响,且细胞存活率分别为100.00%、101.78%、100.42%、99.01%、97.02%、91.85%(p<0.05)、85.28%(p<0.001)(图1c)。以上结果表明,MITC-21具有显著抑制HCT-116细胞生长的作用,且对正常细胞无毒。
2.2 MITC-21对HCT-116细胞克隆形成的影响
当单个细胞在体外增殖6代以上,其后代所组成的细胞群体,称为集落或克隆。细胞克隆形成实验是检测细胞增殖能力的有效方法之一[28],通过计算克隆形成率,来测定细胞的增殖能力。已有研究表明,辣木籽异硫氰酸酯能显著抑制皮肤癌A431细胞克隆形成,5 µmol/L处理细胞48 h后克隆形成率降低到48.54%(p<0.001)[29]。本研究通过克隆形成实验评价MITC-21对HCT-116细胞集落形成的影响。综合24、48和72 h半致死剂量(IC50),选择具有抑制细胞生长效果且浓度小于或接近半致死剂量的2和4 µmol/L进行后续实验。结果如图2所示,采用不同剂量的MITC-21(0、2和4 µmol/L)处理HCT-116细胞24 h后,与对照组相比,细胞克隆形成率分别降低到53.95%(p<0.01)和46.16%(p<0.01);处理48 h后,与对照组相比,细胞克隆形成率分别降低到68.36%(p<0.05)和49.51%(p<0.01);处理72 h后,与对照组相比,细胞克隆形成率分别降低到42.22%(p<0.001)和35.79%(p<0.001)。结果表明,MITC-21具有显著抑制HCT-116细胞克隆形成的作用。

图2 辣木籽异硫氰酸酯衍生物对HCT-116细胞克隆形成率的影响Fig.2 Effect of Moringa oleifera seeds isothiocyanate derivatives on the colony formation rate of HCT-116 cells
2.3 MITC-21对HCT-116细胞形态的影响
细胞发生凋亡时,会出现细胞体积缩小,连接消失,与周围的细胞脱离等形态学变化。采用不同剂量的MITC-21(0、2和4 µmol/L)处理HCT-116细胞48 h后,在倒置显微镜下观察细胞形态变化。如图3所示,显微镜下观察到对照组细胞长势较好,细胞紧密排列,脱落细胞较少,MITC-21处理细胞48 h后的细胞出现变圆、皱缩,脱落细胞悬浮于培养液中,随着MITC-21浓度的升高,培养液中脱落细胞越来越多,贴壁细胞变得更加稀疏,间隙增大,体积缩小,细胞碎片较多。以上结果表明,MITC-21能够使HCT-116细胞形态发生非正常改变,初步提示MITC-21能够引起细胞的凋亡。

图3 辣木籽异硫氰酸酯衍生物对HCT-116细胞形态的影响Fig.3 Effect of Moringa oleifera seeds isothiocyanate derivatives on morphology of HCT-116 cells
2.4 MITC-21对HCT-116细胞凋亡的影响
细胞凋亡(或程序性细胞死亡)在动物的发育过程中起着关键作用,是由基因控制的细胞自主、有序的死亡,参与了组织的形成重塑[30]。甘辉云等[31]研究发现,2.5 μmol/L苯乙基异硫氰酸酯处理Hep-2细胞后凋亡率与空白对照组比较无明显差异(p>0.05),5.0 μmol/L组相较空白对照组组有显著差异(p<0.05)。为了进一步证实MITC-21是否引起HCT-116细胞凋亡,采用流式细胞术评价MITC-21对HCT-116细胞凋亡的影响。如图4所示,MITC-21处理24 h后,细胞凋亡率分别从20.00%增加到24.85%(p<0.01)和26.02%(p<0.001);处理48 h后,细胞凋亡率分别从14.97%增加到21.60%(p<0.001)和22.78%(p<0.001);处理72 h后,细胞凋亡率分别从33.40%增加到48.78%(p<0.001)和52.12%(p<0.001)。随着MITC-21剂量的增加,细胞凋亡率显著增加,并呈现出一定的时间依赖性。以上结果表明,MITC-21具有诱导结肠癌HCT-116细胞凋亡的作用。

图4 辣木籽异硫氰酸酯衍生物对HCT-116细胞凋亡的影响Fig.4 Effect of Moringa oleifera seeds isothiocyanate derivatives on apoptosis of HCT-116 cells
2.5 MITC-21对HCT-116细胞迁移的影响
迁移是肿瘤细胞生长过程中必不可少的环节之一,对于肿瘤的发展至关重要,也是恶性肿瘤细胞共同的特征[32]。因此,采用细胞划痕愈合实验探讨MITC-21对HCT-116细胞迁移能力的影响。Chou等[33]研究表明,异硫氰酸苯乙酯以剂量依赖的方式减少GBM 8401细胞的迁移,并通过抑制uPA、Rho A和RAS,抑制MMP-2、-7和-9基因的表达。在本文研究中发现,MITC-21(0、2和4 µmol/L)处理HCT-116细胞48 h后,细胞划痕愈合率分别从61.53%降低到32.89%(p<0.01)和24.30%(p<0.001)(图5)。与对照组相比,随着MITC-21剂量的增加,细胞划痕愈合率逐渐降低,细胞迁移显著减少。结果表明MITC-21显著抑制结肠癌HCT-116细胞迁移。
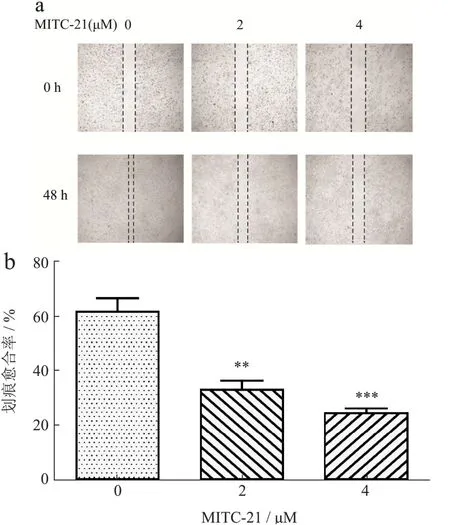
图5 辣木籽异硫氰酸酯衍生物对HCT-116细胞迁移的影响Fig.5 Effect of Moringa oleifera seeds isothiocyanate derivatives on migration of HCT-116 cells
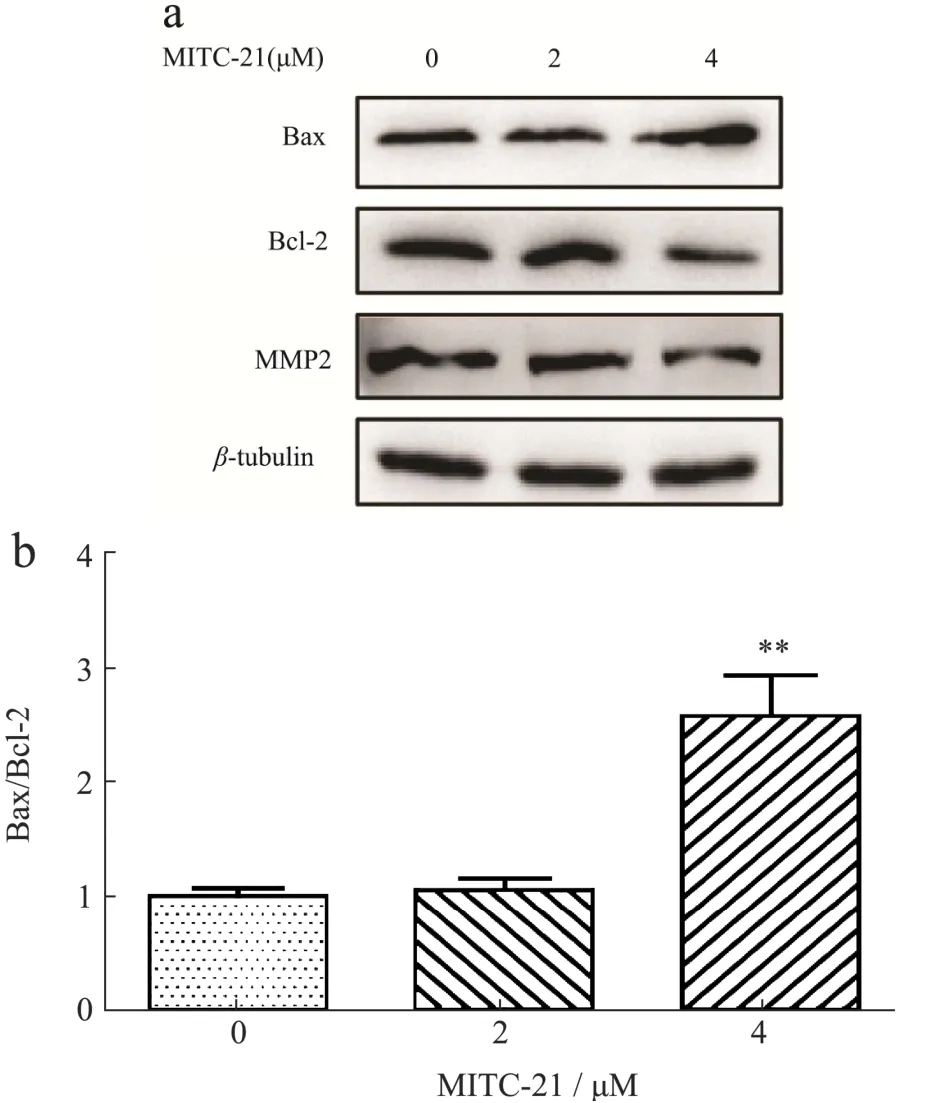
2.6 MITC-21对HCT-116细胞凋亡及迁移蛋白表达的影响
细胞凋亡可受内源性线粒体途径诱导,在细胞凋亡途径中,Bcl-2和Bax是两个主要的相关蛋白,线粒体膜的完整性严格受到Bcl-2蛋白家族的调控,Bcl-2属原癌基因,定位于线粒体膜上,阻止线粒体外膜的透化,高表达的Bcl-2可抑制细胞凋亡。Bax促进线粒体外膜的透化,具有促凋亡作用,Bax/Bcl-2比值的变化对决定细胞凋亡或存活至关重要[34,35]。刘海彬等[36]研究发现缩氨基硫脲-喹唑啉衍生物通过诱导Bax的激活,抑制Bcl-2的活性,诱导A549细胞的凋亡。为进一步证实MITC-21是否通过调控Bax及Bcl-2蛋白表达诱导HCT-116细胞凋亡,将MITC-21(0、2和4 µmol/L)处理HCT-116细胞48 h后,通过蛋白印迹法检测凋亡相关蛋白Bax、Bcl-2的表达情况。结果如图6a和6b所示,与对照组相比,MITC-21(4µmol/L)增加了促凋亡蛋白Bax的表达水平,降低了抗凋亡蛋白Bcl-2的表达水平,并显著增加Bax/Bcl-2的比例。结果表明MITC-21调控了HCT-116细胞中Bax及Bcl-2蛋白的表达,这可能导致了线粒体膜完整性的破坏,从而促进HCT-116细胞凋亡。在Liu等[37]的研究中得到相似的结果,异硫氰酸苯乙酯能通过线粒体介导的Bax/Bcl-2途径诱导IPEC-J2细胞凋亡。MMP2是基质金属蛋白酶家族成员,当被细胞外蛋白酶分解后发生激活、降解和重塑细胞外基质,参与肿瘤细胞的迁移和侵袭[38,39]。端传友[40]通过检测MMP-2在86例结肠癌组织及正常结肠组织中的表达,发现结肠癌组织中MMP-2表达水平及阳性率均显著高于正常结肠组织,提示MMP-2高表达与肿瘤转移密切相关。通过MITC-21(0、2和4 µmol/L)处理HCT-116细胞48 h,采用蛋白印迹法检测迁移相关蛋白MMP2的表达情况,结果如图6a和b所示,与对照组相比,MITC-21(4 µmol/L)显著降低MMP2蛋白表达水平,表明MITC-21可通过抑制HCT-116细胞中迁移蛋白MMP2的表达进而抑制细胞的迁移。
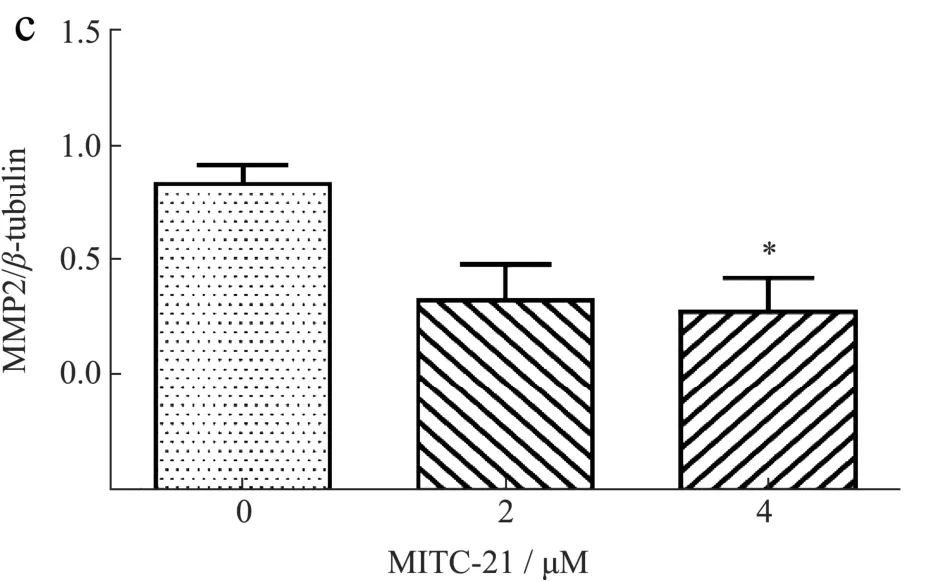
图6 辣木籽异硫氰酸酯衍生物对HCT-116细胞凋亡及迁移蛋白的影响Fig.6 Effects of Moringa oleifera seeds isothiocyanate derivatives on apoptosis and migration protein of HCT-116 cells
综上所述,Bax/Bcl-2、MMP2检测结果与流式细胞术及细胞划痕愈合结果相一致,进一步验证了MITC-21对细胞凋亡和细胞迁移的调控效应。
3 结论
本研究以结肠癌HCT-116细胞为研究对象,通过MTT实验、克隆形成实验、流式细胞术、划痕愈合实验和蛋白印迹法,检测经不同浓度的MITC-21处理后的HCT-116细胞增殖、凋亡和迁移的变化情况。结果表明MITC-21具有抑制HCT-116细胞增殖和迁移并诱导细胞凋亡的作用,同时可调控Bax/Bcl-2比率和MMP2蛋白的表达水平。本研究确定了MITC-21具有良好的抗肿瘤效果,可为辣木资源的有效利用及结直肠癌的防治提供理论基础和实验依据。
