人参皂苷的生物法制备及研究进展
2021-11-05夏玲珍储建林何冰芳
赵 璐,夏玲珍,储建林,何冰芳
(1.南京工业大学 生物与制药工程学院,江苏 南京 211800;2.台州市中心医院(台州学院附属医院),浙江 台州 318000;3.南京工业大学 药学院,江苏 南京 211800)
人参被誉为“百草之王”,具有提高免疫力、缓解疲劳、补充精力、改善体质和安神益智等多种显著的药用功效,也是重要的滋补剂、保健品和食品添加剂[1-2],一直作为名贵中药材被国内外广泛使用。人参中含有多种人参皂苷、人参多糖和人参烯醇等药用活性物质。近年来,人参的相关产品也越来越多地被应用于化妆品和健康饮料等方面[3-4]。
人参皂苷是一类三萜类化合物,是人参中的主要药用成分。目前,已有超过150种天然人参皂苷从人参药材各部位中被分离和鉴定出来[5]。人参皂苷在天然人参中含量较低,5~7年生的人参中的人参皂苷总含量仅为2%;而一些容易被吸收并能发挥较高生物活性的稀有人参皂苷(如人参皂苷Rg3、Rg2、Rh2和CK等)的含量则更加低微,含量仅有十万分之一左右,直接提取非常困难。根据人参皂苷苷元的骨架不同,人参皂苷可分为齐墩果烷型和达玛烷型两大类。其中,达玛烷型人参皂苷主要以原人参二醇(PPD)、原人参三醇(PPT)和拟人参皂苷为苷元,而齐墩果烷型人参皂苷则以齐墩果酸为苷元[5](图1)。
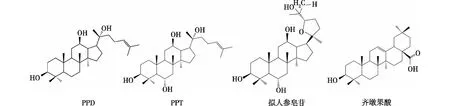
图1 不同类型的人参皂苷苷元[5]
人参皂苷具有抗癌、抗应激和抗氧化等作用,也可用于糖尿病、心血管、免疫和神经疾病的辅助治疗[6]。人参皂苷化合物中糖基连接的位置和数量对其生物活性的影响显著,例如:人参皂苷Rh2能抑制癌细胞向其他器官转移[7];人参皂苷Rg1具有兴奋中枢神经和抑制血小板凝集的作用[8];人参皂苷Rg3能抑制癌细胞有丝分裂前期蛋白质和腺嘌呤核苷三磷酸(ATP)的合成,延缓癌细胞的增殖生长等[9-10]。目前,由人参皂苷Rg3制成的“参一胶囊”已成功作为药品上市,用于培元固本、补益气血,或与化疗配合用药,从而提高治疗原发性肺癌、肝癌的功效,并且还能改善肿瘤患者的气虚症状,提高机体免疫功能;人参皂苷CK具有保肝、抗炎和抗癌等功效,已被我国食品药品监督管理局批准为防治关节炎的临床用药[11-12]。稀有人参皂苷CK、Rh2和Rg3等往往具有较强的药理活性,但在天然植物中含量甚微,极为稀缺。因此,稀有人参皂苷的合成与获取、制备方面的研究一直备受关注。
人参生长缓慢,从幼苗到成熟阶段通常需要5~7年,栽培种植时间较长。另外,中药材栽培技术相对复杂,易受季节、土壤、气候和病虫害等各种因素影响,难以实现大规模且高效稳定的人工栽培。此外,人工栽培植株中人参皂苷的含量往往偏低(最高约为天然人参含量的1/3),难以满足人参皂苷国内外日益增长的市场需求[13]。为了解决药源匮乏的问题,近年来国内外研究者们致力于使用生物法制取人参皂苷产物,在组织培养、转基因植物、生物合成途径及合成生物学等各研究领域的生物技术上均取得了相应进展与突破,为大量制备或生产人参皂苷类产物奠定了重要的基础。本文通过综述人参皂苷的植物培养、合成途径解析和合成生物学制备等方面的新进展,特别是糖基转移酶作为最后一步关键酶的相关研究,以期为稀有人参皂苷的生物法定向制备提供有关参考。
1 通过组织培养解决人参栽培难的问题
为了解决难以大量栽培人参组织的问题,在20世纪50年代,研究人员尝试利用组织细胞培养技术来获取人参皂苷成分,成功地培育出了人参根愈伤组织[14]。目前,利用悬浮细胞、不定根以及毛状根的培养生产人参次生代谢产物是主要的研究方向。通常,人参的根系统在生长速度、产生的次生代谢产物含量等方面要优于人参的其他组织细胞。因此,人参的根部培养是目前人参组织培养研究的主要热点[15-16]。在培养规模方面,人参植物细胞培养已开发出固体静止培养、液体悬浮培养等多种方式。不同的人参植物细胞培养方式需要建立适合的生物反应器,以达到大量培养的目的,也是决定植物人参细胞能否实现大规模工业化生产的关键。其中一个成功的例子是:韩国忠北大学利用了商业级鼓泡式生物反应器建立的人参不定根扩大培养系统,使人参细胞的培养规模高达10 000 L,年产人参不定根约45 t,获得的人参皂苷产物可部分满足韩国国内保健品、药品和化妆品等行业的市场需求[17-18]。
尽管人参的细胞培养和不定根培养均取得了一定的进展,但仍然存在一些问题,如:继代培养易退化或生长减缓、人参皂苷含量较天然植株低,难以获得高纯度的高活性人参皂苷单体等。因此,人参的细胞培养还需要探索出易于培养且适合工业化生产的新方法。
2 通过转基因实现合成途径关键酶的解析
由于人参皂苷在根、茎和叶等组织中累积与分布都不均匀,而人参特定根部组织中含有较多含量的人参皂苷,而一些活性较高成分如人参皂苷Rg3、Rh2等含量极其低微[5]。随着人们对人参等植物遗传信息的逐步认识,开始利用转录组学、蛋白组学等方法研究人参中一些可能具备功能的基因,进而通过遗传学、基因工程技术方法获得了转基因人参,通过上调或下调人参皂苷生物合成过程中的相关基因,可获得比人参植物组织细胞培养更高产量水平的人参皂苷类产物。例如:Lee等[19]研究了角鲨烯合酶在植物甾醇和三萜类化合物生物合成中的作用,并通过农杆菌介导角鲨烯合酶基因(PgSS1)在人参中过表达,结果表明:过表达PgSS1的转基因人参中伴随着下游基因,如角鲨烯环氧酶、β-香树素合酶和环阿屯醇酶的上调,使得人参皂苷的含量明显增加。由此可见,在转基因人参中过表达角鲨烯合酶(PgSS1)、角鲨烯环氧酶基因(PgSQE1和PgSQE2)和细胞色素P450家族基因(CYP716A52v2和CYP716A53v2)等可能会提高人参皂苷的含量。但由于人参中次生代谢途径众多,转基因人参细胞表达一些酶的特异性尚不够,难以实现较为定向的人参皂苷生物合成调节。此外,转基因植物的稳定性与表达效率有待进一步优化,才能满足人参皂苷单体与稀有人参皂苷的定向生物合成。
3 人参皂苷的合成生物学制备探索
3.1 人参皂苷的生物合成途径解析
人们利用现代测序技术,得到了人参全基因序列图谱,从而对人参皂苷空间分布和人参组织层面的分子表达模式进行了研究,关联分析并筛选出潜在的合成人参皂苷的多个关键基因,阐述出人参皂苷可能的生物合成途径及其调控机制[17]。人参皂苷类植物的次生产物代谢主要通过甲羟戊酸(MVA)途径和甲基赤藓糖醇磷酸(MEP)途径,在一系列酶的作用下,经连续20多步的级联催化反应而形成[17,20]。涉及人参中三萜类物质生物合成过程中起作用的关键酶,即3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR),以及法尼基焦磷酸合酶(FPS)、鲨烯合酶、鲨烯环氧酶、达玛烷二醇合酶、香树素合酶、细胞色素P450酶和糖基转移酶等一系列酶类的有序协作催化。当然,人参植物体内也拥有着丰富的互补途径,有利于三萜类人参皂苷产物合成的灵活调控。通常,在人参等植物中,人参皂苷三萜类化合物的生物合成主要有几个关键步骤(图2和3):异戊二烯单位3-异戊二烯焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP)的生物合成,再由IPP和DMAPP衍生出法尼基二磷酸酯(FPP),两个FPP头对头组装,生成线性C30角鲨烯,进一步生成重要中间体2,3-氧化鲨烯,最后经过角鲨烯环化及多种官能团修饰,生成具有不同羟基化位点的苷元物质,最后经糖基化修饰形成数量众多的人参皂苷产物[17]。
IPP和DMAPP的生物合成:IPP和DMAPP的产量水平对植物中人参皂苷的生物合成起着重要作用。人参中通常存在两种主要的生物途径可分别合成人参皂苷的重要前体物质IPP和DMAPP:位于细胞质的MVA途径和位于质体的MEP途径(图2)[20-21]。迄今为止,研究者认为人参中主要优先利用MVA途径来产生IPP,关于人参的MVA途径已有很多植物化学、转录组学和基因组学研究的报道[22-24]。然而,对于产生DMAPP的MEP途径来说,其研究还处于初始阶段。例如:Xu等[25]研究发现:人参基因组研究中存在MEP途径转录组中间体,Xue等[26]对人参转录组的研究表明:与MEP途径相关的基因主要在人参叶片中进行表达,其次是在侧根或根皮中表达,在茎和根中的表达量最低。MEP途径和MVA途径具有几乎相同的转录丰度,表明MEP途径在人参质体或叶绿体组织中的人参皂苷生物合成中也起着重要作用。
MVA合成途径以葡萄糖氧化生成的乙酰 CoA为起始。由图2可知:先后在乙酰乙酰-CoA转移酶(AACT)和3-羟基-3-甲基戊二酰CoA合成酶(HMGS)作用下形成 3-羟基-3-甲基戊二酰CoA(HMG-CoA),接着在人参皂苷生物合成途径中的第一个限速酶——HMGR的作用下合成MVA,依次在甲羟戊酸激酶(MVK)、二氧磷基甲羟戊酸激酶(PMK)和甲羟戊酸焦磷酸脱羧酶(MVD)的作用下生成IPP。MVA途径生成的IPP可在异构酶(IDI)的作用下形成DMAPP[27]。DMAPP也可以由MEP途径生物合成:人参植物中存在的MEP途径以葡萄糖经糖酵解生成的3-磷酸甘油醛为起始先后在1-脱氧-D-木酮糖-5-磷酸合酶(DXS)和1-脱氧-D-木酮糖-5-磷酸还原异构酶(DXR)作用下生成MEP,接着在2-C-甲基-D-赤藓糖醇4-磷酸胞苷转移酶(IspD)、4-(胞苷-5-二磷酸)-2-C-甲基-赤藓糖醇激酶(IspE)、2-C-甲基-D-赤藓糖醇2,4-环二磷酸合酶(IspF)、4-羟基-3-甲基丁-2-烯基-二磷酸合酶(IspG)和4-羟基-3-甲基丁-2-烯基二磷酸还原酶(IspH)等一系列酶的连续催化下合成DMAPP[26]。
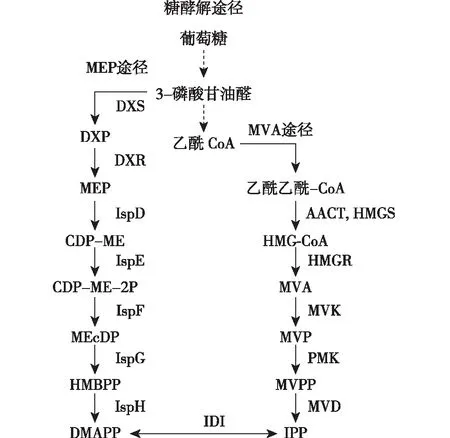
图2 MEP途径和MVA合成途径[26]
2,3氧化鲨烯的生物合成:MVA途径产生的前体物质IPP与异构或经MEP途径产生的DMAPP在牻牛儿基焦磷酸合成酶(GPS)作用下,首先形成牻牛儿基焦磷酸(GPP)[28]。GPP和IPP由人参中的关键酶法尼基焦磷酸合成酶(FPS)催化形成FPP,FPS在三萜类人参皂苷化合物的生物合成中起着至关重要的作用。FPP再由鲨烯合成酶(SS)等酶的作用下合成鲨烯,鲨烯经鲨烯环氧酶(SE)催化转变为2,3-氧化鲨烯[28],该反应步骤中鲨烯合成酶的活性大小对最终人参皂苷的产量起着重要的调节作用。
氧化鲨烯的环化及官能团修饰:2,3-氧化鲨烯在不同酶的催化下衍生出多样的环化产物,一方面若是经环阿屯醇合酶(CAS)催化作用,可生成环阿屯醇;或在羊毛甾醇合酶(LAS)催化下,可生成羊毛甾醇,然后经一系列生物合成反应产生植物甾醇。另一方面若是达玛烷二醇合成酶(DS)催化可生成达玛烷二醇(dammarenediol),有研究表明:超表达DS可望显著提高人参皂苷的产量,之后再经细胞色素 P450 单加氧酶对人参中三萜类产物进行氧化和羟基化作用得到人参皂苷苷元物质[29]。最后,由糖基转移酶等糖基化修饰后形成达玛烷型人参皂苷;或是由β-香树素合成酶(β-AS)的作用下合成β-香树素,后经糖基转移酶和糖苷酶等催化作用,形成齐墩果烷型人参皂苷(图3)[30]。
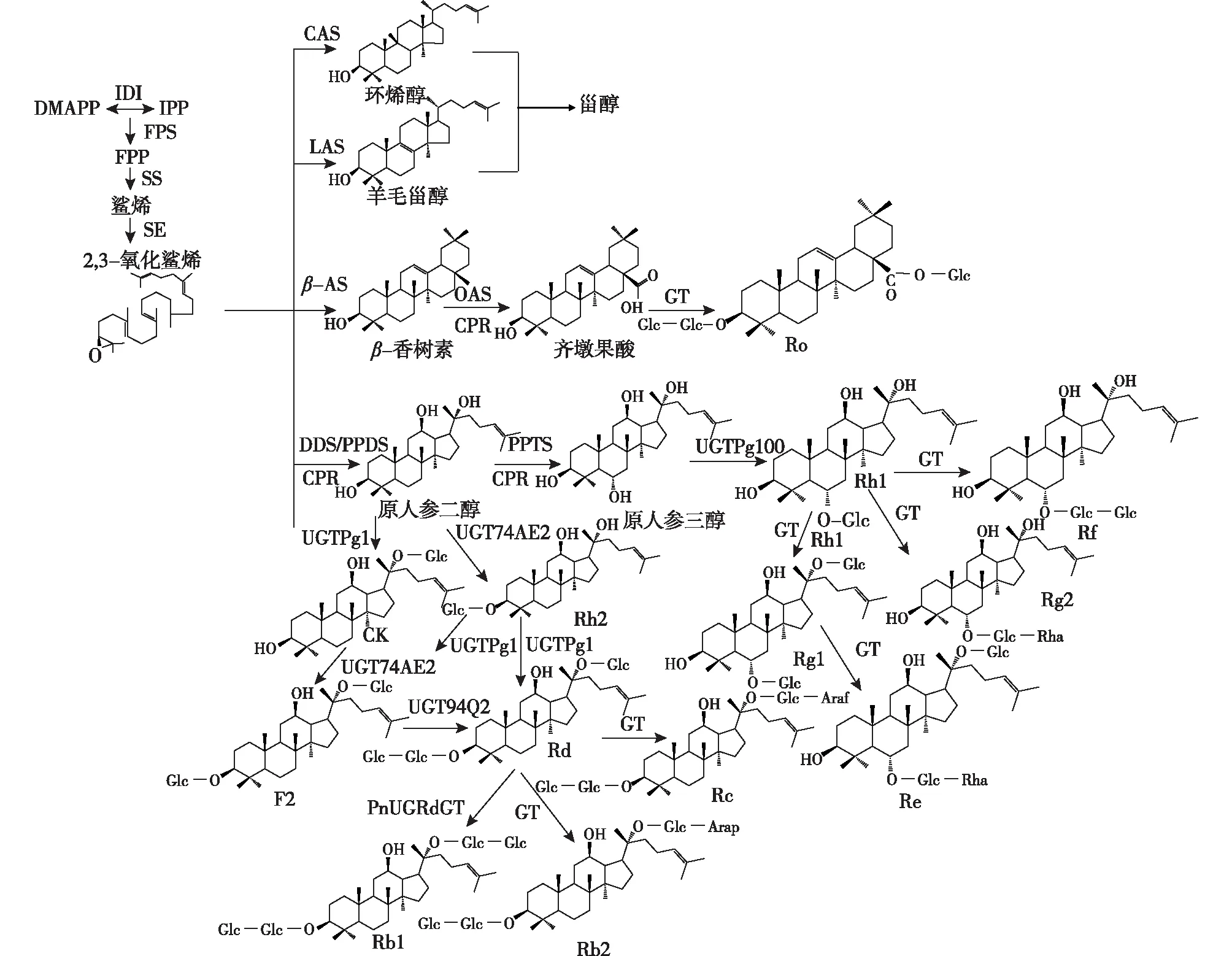
图3 人参皂苷在植物体中的合成途径[27]
3.2 人参皂苷生物合成的糖基转移酶
在人参、三七和西洋参等人参属植物中,数量丰富的UDP-糖基转移酶类(UGTs)可催化原人参三醇/原人参二醇(PPT/PPD)的糖基化修饰,该步骤是人参皂苷生物合成途径的最后一步,也是最为关键的一步,决定了最终生成的人参皂苷产物种类,进而能影响其生物活性及功能用途[31]。药理研究表明:人参皂苷苷元糖基化和修饰方式不同,形成的不同类型的人参皂苷可发挥不同的药理作用[32-35]。人参中已发现并注释220多个糖基转移酶,是人参基因组中最大基因家族之一。人参基因组在进化过程中富集了大量的UGTs,决定着人参皂苷产物的多样性。在人参植物中,不同糖基转移酶可能具有不同的功能,表现在对多种苷元前体物质的糖基化位点的选择、糖基化程度等也不同,PPD型人参皂苷苷元的糖基化主要在C3和/或C20位点,PPT型人参皂苷苷元的糖基化则主要在C6和/或C20位点。人参皂苷中糖苷键以O-糖苷键存在,且C3、C6位多糖结构间多为β-1,2糖苷键,而C20的多糖结构间位多为β-1,6糖苷键[5]。
人参、三七等植物中富含人参皂苷,且拥有相似的代谢途径,一些UGTs的催化人参皂苷苷元的糖基化作用已经阐明[36-37]。例如:人参中糖基转移酶PgUGTPg100通过糖基化PPT的 C6位合成人参皂苷Rh1[38];而在植物三七中的糖基转移酶PnUGRdGT对人参皂苷Rd的C20位糖基化从而合成人参皂苷Rb1[39]。而人参中糖基转移酶PgUGTPg1可以糖基化PPD形成人参皂苷Rh2、Rg3、CK、F2和Rd等产物[40]。人参中的糖基转移酶PgUGTPg45可糖基化PPD 的C3—OH形成人参皂苷Rh2,而糖基转移酶PgUGTPg29则可进一步催化人参皂苷Rh2糖基化形成人参皂苷Rg3产物。这些人参、三七等植物来源糖基转移酶的功能鉴定可为多种稀有人参皂苷的定向生物合成提供重要参考。
有意思的是,与植物来源的UGTs相比,只具有较低相似性的几种微生物源的UGTs,也可以催化合成几种人参皂苷产物,展现了一些微生物来源的糖基转移酶在生物法制备稀有人参皂苷产物方面诱人的前景。 例如:枯草芽孢杆菌来源的BSGT1催化人参皂苷F1的C3位并合成了稀有的人参皂苷Ia(0.20 g/L)[41-42]。来源于枯草芽孢杆菌的UGT109A1,可将糖基化PPD和PPT的C3—OH和C12—OH,生成非天然人参皂苷产物。据报道,3β,12β-Di-O-Glc-PPD表现出比Rg3更高的抗肺癌活性[43]。同样来源于枯草芽孢杆菌的Bs-YjiC对PPD和PPT均表现出很好的糖基化活性,生成Rh2、F12等人参皂苷产物[44-45]。
然而,大多数糖基转移酶具有“底物泛杂性”,导致其糖基化反应较难应用于定向生物合成特定的人参皂苷产物,特别是稀有人参皂苷CK、Rg3等。深入认识与理解人参皂苷合成的糖基转移酶,开展结构与功能关系研究,对高选择性地获得具有较高价值的稀有人参皂苷具有重要意义。对人参皂苷合成的最后一步关键酶——糖基转移酶进行筛选、高效表达与酶分子改造等研究,进而耦联优化构建的生物合成途径,利用合成生物学构建细胞工厂,有望实现稀有人参皂苷的高效定向生物合成。
3.3 人参酵母细胞工厂
为了解决天然产物含量极低、分离困难、提取成本高、难以大量制备获取、收益低及不能满足供需等一系列问题,在基因组学研究的基础上,对一些天然化合物的生物合成酶基因进行表征与鉴定,在一些易于实现遗传操作的底盘细胞中设计、装配与集成以及重构天然产物的代谢合成途径,可更精确地控制目标产物的生物合成途径,构建出适合天然产物人工合成的细胞工厂。合成生物学是当前最有前途的天然产物绿色环保制备技术之一,可以有效解决植物来源的稀有天然产物匮乏等问题。例如:酿酒酵母是广泛用于食品和饮料生产的安全菌种,也是用于基础分子生物学研究的重要真核模式微生物。近年来,已经通过合成生物学手段成功将酿酒酵母改造为多种生产高附加值产物的细胞工厂,涉及的天然产物包括生物碱类、萜类[40]、黄酮类[46]和多酚类[47]等。此外,酿酒酵母具有膜定位和翻译后修饰功能,可为植物和动物来源的异源酶功能表达提供相似的物理和生理环境[48]。可见在酵母底盘细胞中构建完整的人参皂苷类产物的生物合成途径是切实可行的。
近年来,对人参皂苷生物合成途径的研究取得了一些进展,为研究者们致力于利用合成生物学技术、构建酵母细胞工厂来生产多种不同人参皂苷萜类成分奠定了基础。Han等[49]克隆、表达并鉴定了PPD,合成途径关键酶细胞色素P450(CYP716A47),构建了可以生产PPD的酵母细胞,次年又鉴定出了细胞色素P450(CYP716A53v2),可以催化原人参二醇产生PPT[50]。中国科学院天津工业生物技术研究所与中国中医科学院中药资源中心合作,将人参来源的达玛烯二醇-Ⅱ合酶(PgDDS)、细胞色素P450(CYP716A47)等导入酵母细胞,构建了可以合成PPD的酵母细胞[51]。后对其合成代谢路径中最先影响人参皂苷前体合成的关键酶HMGR进行表达优化,构建高效的生物合成途径,结合双相发酵工艺优化,最终将PPD的产量提高至1 g/L水平[52]。近期,进一步通过基因模块组合优化的方法,已将细胞工厂合成人参三萜类产物的通量提高至10 g/L,并创建出人参皂苷前体产量可达 15 g/L的高效酵母细胞工厂[53]。在此研究基础上,进一步通过引入不同植物来源的β-香树酯合酶、齐墩果酸合酶和原人参三醇合酶,构建了多种类型人参皂苷苷元的代谢合成模块,实现了人工设计的酵母细胞可同时生物合成齐墩果酸(0.021 0 g/L)、原人参二醇(0.017 2 g/L)和原人参三醇(0.015 9 g/L)这3种人参皂苷苷元类人参功效物质(图4)[52]。这些合成生物学研究的探索都说明了人工设计的人参酵母等细胞工厂生物合成人参皂苷苷元均达到了相当可观的水平,并可用于人参皂苷苷元等产物的大量生产,为最终的多种人参皂苷生物合成奠定了重要基础。
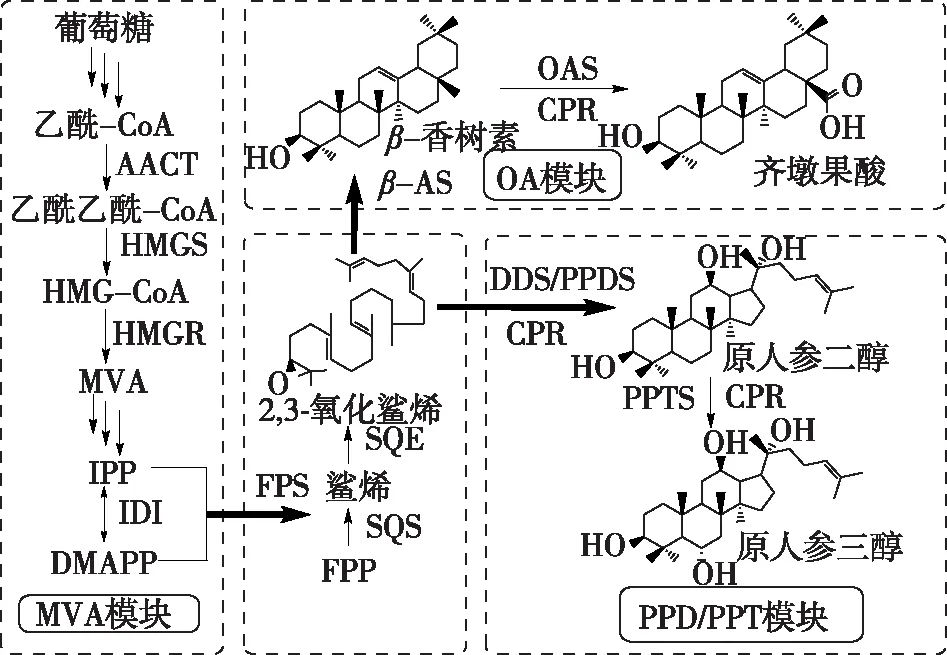
图4 人参酵母中3种人参皂苷苷元的合成途径设计[52]
生物合成的人参皂苷苷元最终目的是为了获取连接由糖基修饰的人参皂苷产物,该步骤由UGTs催化苷元的糖基化反应来完成。糖基转移酶催化人参皂苷苷元的糖基化反应,合成人参皂苷产物是整个生物合成途径中的最后一个关键步骤,是多样性人参皂苷产物生物合成的关键。中国科学院上海植物生理生态研究所与中国科学院上海药物研究所合作[38,40,54],对13 个人参属植物的cDNA 数据库中相关合成原件进行发掘,选取长度大于1 320 bp的带有PSPG(植物次级代谢产物糖基转移酶C端的保守序列,用于结合高能糖供体[55])模序的开放阅读框,通过逆转录聚合酶链反应(RT-PCR)从人参愈伤组织制备的mRNA中成功克隆并表达了 80 多个新UGTs,将其导入酵母底盘细胞进行功能表征分析,鉴定了参与稀有人参皂苷 CK、Rh2、Rg3、Rh1和F1合成的5个 UGTs。在此基础上,分别将稀有人参皂苷 CK、F1、Rh1、Rh2和Rg3 单体的合成途径引入酵母底盘细胞(图5),成功实现了从葡萄糖到多种稀有人参皂苷单体的一步制备法(产量分别可达2.4×10-4、0.042、0.093、0.017和0.049 g/L)。近期,通过酵母底盘细胞关键糖基转移酶优化,Rh2产量已大于2 g/L[56]。Zhuang等[57]通过分析酿酒酵母来源的UGT51结构,对酶与底物进行分子对接和定点突变等进行半理性设计,成功使其催化原人参二醇的效率(kcat/Km)提升了1 800倍,并将UGT51构建到酵母底盘细胞,通过代谢途径优化和分批补料式发酵可得到约0.30 g/L的Rh2。目前,虽然利用合成生物学技术已制备出一些稀有人参皂苷,但如人参皂苷CK、Rh2等的产量仍具有很大的提升空间。因此,对人参皂苷合成的生物元件糖基转移酶类的挖掘、鉴定与改造,可为定向合成不同人参皂苷单体以及进一步获得高产人参皂苷的人工细胞工厂提供重要借鉴。
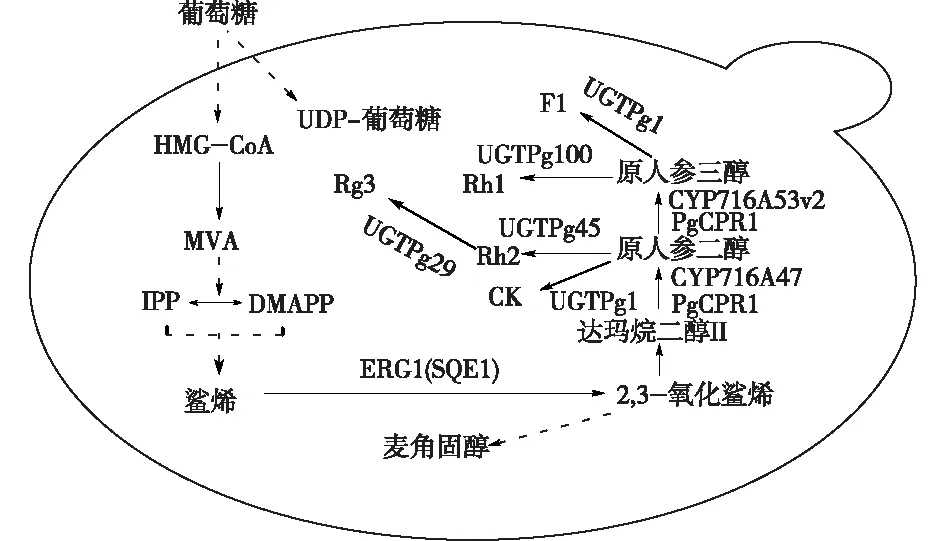
图5 人参酵母工厂示意[38,40,54]
4 结论与展望
人参皂苷是植物人参中的重要活性物质。人参皂苷产物的结构鉴定、生物活性研究及其生物合成途径的关键酶探索、代谢合成模块设计优化、生物合成策略设计调控和生产方法的改进与创新一直是研究热点。人参皂苷的糖基配体数目、键合位置和类型各不相同,形成了生物活性差异显著且数量较多的人参皂苷产物,其中大多数是达玛烷或齐墩果烷型且具有重要药用价值的人参皂苷产物。然而,生物活性较高的稀有人参皂苷在天然人参植物中的含量极低,甚至是痕量的,难以大量获取。迄今为止对植物组织培养和反应器的研究已经比较成熟,但在植株中的人参皂苷含量依然较低,定向制备高活性的人参皂苷单体仍然是目前尚需解决的问题。
随着人们对人参等植物全基因组序列的生物信息学分析,对人参皂苷生物合成途径的关键基因解析,阐述了人参皂苷的生物合成途径及其调控机制,为合成生物学人工构建人参皂苷的生物合成途径与模块化设计优化奠定了重要基础。研究者利用合成生物学方法在工程酵母细胞中构建了一些人参皂苷的完整合成途径,成功实现了人参酵母细胞工厂,制备出PPD、PPT和齐墩果酸苷元以及几种人参皂苷单体,其中部分人参皂苷苷元产物的产量水平能达10 g/L。目前,定向生物合成稀有人参皂苷CK、Rg3等产物的产量尚不尽如人意,其主要环节可能在糖基转移酶这一最后的重要环节。此外,与传统路线相比,现有的人参皂苷生物合成技术的经济优势仍不明显。随着现代生物学技术的发展,植物基因组的测序技术将低成本化,对于高通量化学合成基因技术,特征元件的挖掘鉴定、底盘细胞的性能、发酵方法的优化都将得到进一步的完善,最终有望实现多种稀有人参皂苷的高效人工合成。合成生物学等生物法策略有望发展成为提高人参皂苷生产的有效技术手段,解决稀有人参皂苷类产物直接提取成本高、收益极低等重要问题,从而缓解稀有人参皂苷的市场供需不足,为人参产业的发展提供技术帮助。
