生物电化学系统降解废水中抗生素的研究进展
2021-11-05陈子璇吴夏芫陈雪茹潘正勇白佳莹雍晓雨谢欣欣贾红华
陈子璇,吴夏芫,陈雪茹,潘正勇,崔 衍,白佳莹,周 俊,雍晓雨,谢欣欣,贾红华,韦 萍
(南京工业大学 生物与制药工程学院 生物能源研究所,江苏 南京 211800)
自20世纪50年代以来,抗生素被广泛应用于人类医药和畜牧业。大量抗生素经由人类和动物排泄物、农业和制药工业废水排放以原药或代谢产物的形式进入水环境中,造成了极大的污染[1]。更为严重的是,抗生素可能诱导环境中抗生素抗性菌(ARB)及抗性基因(ARGs)的产生与传播,从而对人类健康构成更大的威胁。因此,采取适当的措施解决抗生素污染问题已刻不容缓。
大部分抗生素抗菌活性强,具有可生化性差、难降解的特点,对传统废水处理方法提出了巨大的挑战。多种处理方法如生物处理[2]、氯化法[3]、高级氧化技术[4]、电化学处理[5-6]、吸附[7]、膜过程[8]和超声空化效应法[9]已被用于去除抗生素。但这些方法都需要特殊的材料、大量的能源或化学品的输入、复杂的运行工艺且易造成二次污染,单独的物理化学或生物方法也并不能完全去除和降解抗生素。
生物电化学系统(BES)是一种利用微生物催化阳极(氧化)或阴极(还原)反应的新兴技术,主要包括微生物燃料电池(MFC)和微生物电解池(MEC)[10]。BES相较于一般的厌氧生物技术和电化学技术具有更强的污染物降解能力,且具有效率高、成本低、环境可持续性和能源回收等优点,这为抗生素类废水的处理提供了一条新路径[11]。然而,BES降解废水中抗生素的研究仍处于起步阶段,相关降解途径和机制尚不明晰,国内外关于BES降解废水中抗生素的文献综述也较少。因此,基于近年来BES降解抗生素的方法和机制,已用于BES降解的抗生素种类,影响抗生素降解的关键因素以及降解过程中可能对ARGs传播造成的影响等方面的研究进行了系统的归纳和讨论,旨在为加快BES技术在抗生素类废水处理方面的应用进程提供参考。
1 传统方法与生物电化学方法降解废水中抗生素的比较
1.1 传统方法
关于废水中抗生素的传统降解处理技术主要有物理法、高级氧化技术及生物法。具体在处理抗生素废水时方法的优缺点及抗生素去除效率见表1。

表1 传统方法处理抗生素废水的优缺点及去除效率
1.2 生物电化学方法
利用BES降解抗生素的方法根据其工作原理大致可以分为以下3类:
第一类为抗生素在BES生物阳极(氧化性环境)中进行降解,这主要包括使用双室MFC和单室空气阴极MFC两种反应器。铁氰化钾(双室MFC)或O2(单室空气阴极MFC)通常作为非生物阴极中的电子受体[18],生物阳极中抗生素作为唯一电子供体或与有机碳源共代谢被混合菌群降解。Wang等[19]发现磺胺甲恶唑及其降解产物3-氨基-5-甲基异恶唑(3A5MI)可在BES的生物阳极中得到有效降解,且在其降解过程中形成的有毒化学物质3A5MI可以进一步被矿化。在空气阴极单室MFC的生物阳极降解青霉素的过程中,MFC运行24 h后青霉素(初始质量浓度50 mg/L)降解效率达到98%[20]。
第二类为抗生素在BES阴极(还原性环境)中进行降解。这主要包括非生物阴极(抗生素接受来自阴极的电子直接进行电化学还原)与生物阴极(抗生素在阴极混合菌群的作用下接收电子进行还原裂解)两种机制。Kong等[21]使用非生物阴极降解氯霉素,外加电压0.8 V下反应160 h,初始质量浓度200 mg/L的氯霉素降解效率为98.5%,表明电化学还原可以有效降解氯霉素。呋喃西林在BES生物阴极降解的过程中,施加电压为0.2 V时降解效率为(46.62±4.95)%,施加电压0.8 V时降解效率为(65.27±0.13)%,均高于开路时的降解效率(7.33±5.43)%[22]。尽管非生物阴极与生物阴极都可以对目标抗生素进行有效降解,但由于反应机制的差异,降解途径及中间产物也会有所不同。在非生物阴极氯霉素的还原过程中明显积累毒性较大的羟基胺基产物(HOAM)和亚硝基(NO)[23]。生物阴极中氯霉素则定向还原为另外的硝基芳香烃化合物并最终脱氯生成毒性极弱的一氯芳香胺(AMCl)。
第三类为通过BES与其他技术的耦合强化对抗生素的降解,主要包括MFC耦合人工湿地、MFC耦合膜生物反应器(MBR)等。利用MFC耦合人工湿地在处理四环素与磺胺甲恶唑时(图1),四环素进水质量浓度为400、1 000和1 600 μg/L,对应出水质量浓度分别为0、0和1.65 μg/L;同样进水质量浓度的磺胺甲恶唑对应出水质量浓度为0.90、1.70和2.40 μg/L。在不同的进水抗生素浓度下,阳极层和阴极层两种抗生素的积累浓度有所差异,阳极层中四环素质量浓度较高,其次是阴极层,中间层质量浓度最低,与磺胺甲恶唑趋势相同,表明在抗生素去除过程中底物吸收、微生物降解、植物吸收、水解反应和电化学反应都受到了一定的影响[24]。
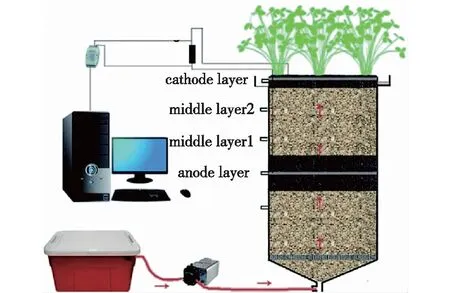
图1 BES耦合人工湿地[24]
Li等[25]将BES和MBR耦合(图2),使用聚偏二氟乙烯涂覆的碳布作为阴极膜。最终该反应器去除了模拟废水中体积90%以上的四环素,解决了常规MBR高能耗的问题。MFC将MBR系统中体积2.93%的COD转化为电能,MBR将O2扩散到MFC的阴极中,整个过程具有更高的能量转换效率和更少的能量消耗。
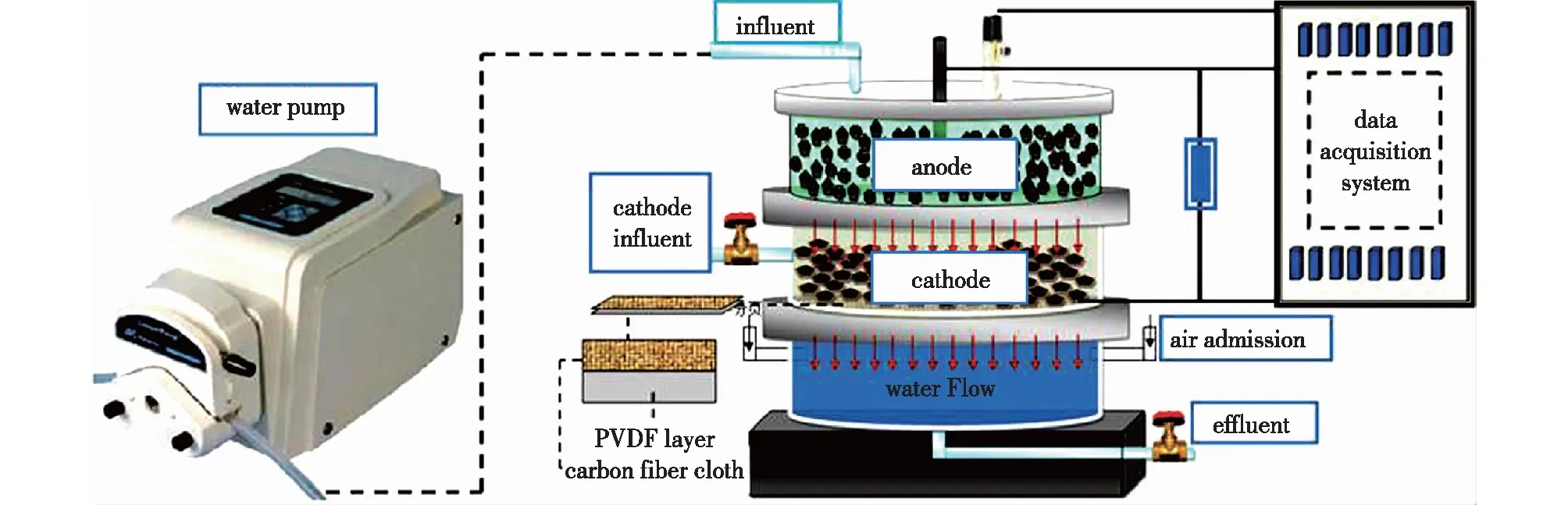
图2 BES耦合MBR[25]
1.3 生物电化学降解废水中抗生素的优势
与传统技术相比,BES降解废水中的抗生素展现了较多的优势:1)能经济有效地去除抗生素,且效率高,降解周期短,整个过程中不需要大量能源或化学品的投入[14];2)能减少有毒中间代谢产物的生成,抗生素降解过程中生成的中间代谢产物,可能比母体化合物毒性更大,BES则可使得某些毒性更大的中间代谢产物被进一步降解和矿化[22-23];3)具有绿色可持续化特征,BES降解抗生素的过程无二次污染,绿色环保,而且还可利用有机废水作为电子供体,兼具能源回收、以废治废的特点;4)易与其他技术进行创新整合,由于传统的单一技术难以将抗生素完全去除,将多种技术进行耦合是抗生素废水处理发展的必然趋势,BES则易于与其他技术进行创新性整合[26]。
2 已用于生物电化学降解的抗生素
2.1 抗生素的种类
目前,已用于BES降解的废水中抗生素大致分为β-内酰胺类、硝基咪唑类、硝基呋喃类、磺胺类、四环素类和氯霉素类。β-内酰胺类包括头孢呋辛、头孢曲松钠及青霉素等;硝基咪唑类主要为甲硝唑;硝基呋喃类目前被研究的仍较少,仅有Kong等[22]对呋喃西林进行了研究;磺胺类抗生素被研究较多的为磺胺甲恶唑;被研究最多的是四环素类和氯霉素类。由于不同抗生素化学结构不同,BES降解抗生素废水的反应条件设置也各不相同,表2对已有的研究进行了总结。
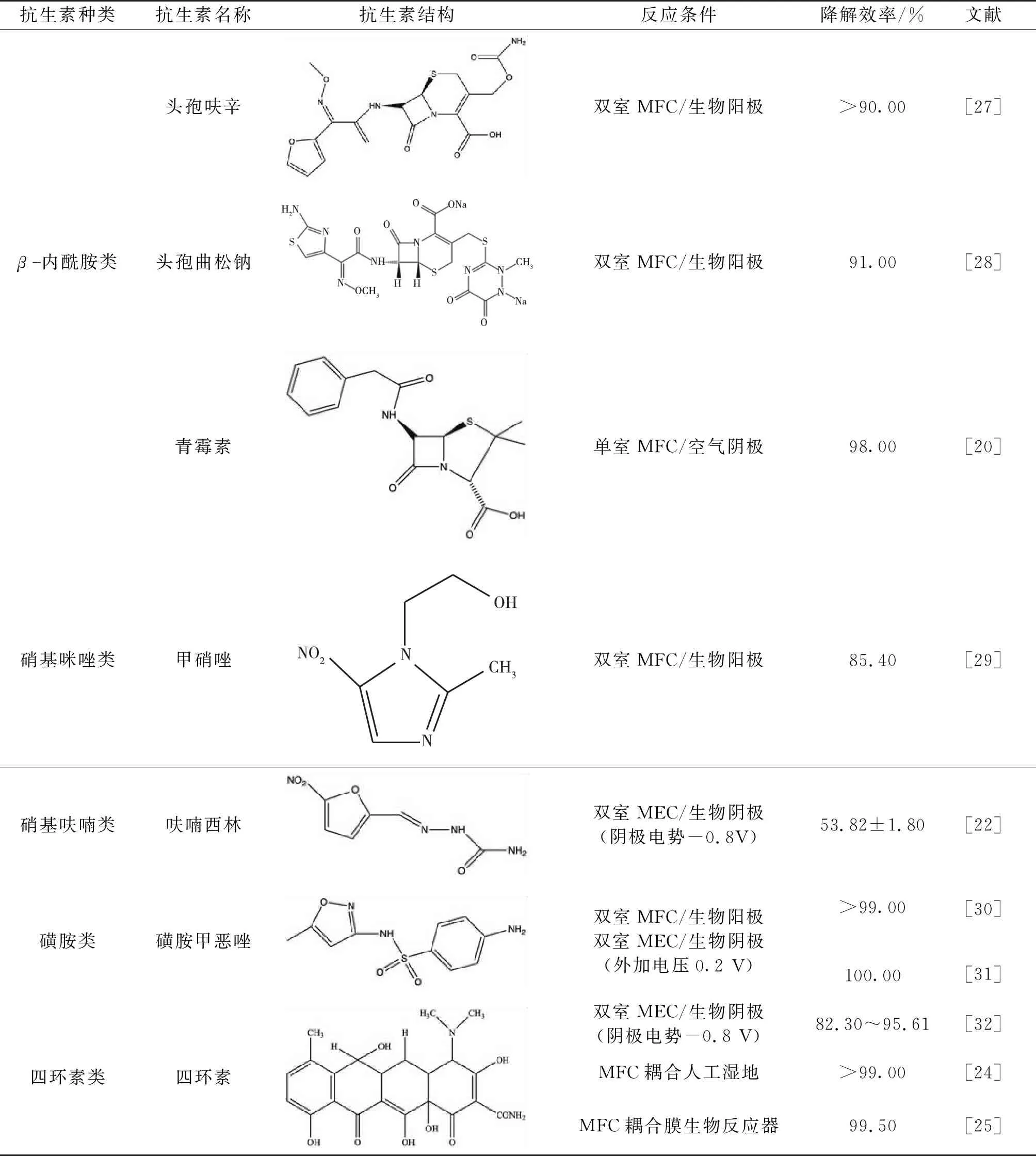
表2 已用于生物电化学降解的抗生素分类、结构、反应条件及降解效率
2.2 抗生素的降解路径及产物
BES降解抗生素废水的过程中,抗生素的降解产物主要通过高效液相色谱法(HPLC)、液相色谱-质谱联用仪(LC-MS)进行测定[36-38]。以氯霉素为例,MFC生物阳极降解氯霉素的过程中,反应初期氯霉素被转化为两个主要的代谢中间体,其中硝基转化为胺基形成了二氯芳香胺AMCl2,3-羟基氯霉素发生乙酰化生成氯霉素乙酰化产物,随后乙酰化产物的硝基进一步被还原为胺基,最终被还原为AMCl2,因此在MFC生物阳极运行96 h后仅能检测到一种代谢产物AMCl2[33]。在BES阴极还原氯霉素的过程中,Liang等[23]发现在非生物阴极还原氯霉素过程中需积累中间产物HOAM和NO,然后进一步转化为AMCl2,通过加氢脱氯的机制最终生成一氯芳香胺(AMCl)。生物阴极则可以定向还原氯霉素硝基基团到胺基产物AMCl2,随后AMCl2由于微生物分泌的还原脱卤素酶脱氯转化为AMCl(图3)。生物阴极与非生物阴极还原脱氯途径有所不同,生物阴极催化速率明显快于非生物阴极。但是,BES系统降解氯霉素的主要最终产物AMCl2和AMCl还含有Cl-,仍然可能对环境存在毒害作用。
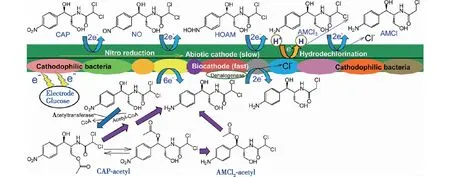
图3 氯霉素在MEC生物阴极中的降解途径[23]
磺胺甲恶唑在双室MFC生物阳极降解过程中,产生了5种不同的中间产物,从而得出了磺胺甲恶唑可能发生的不同降解途径,但最终产物都为4-氨基苯磺酰胺[39]。同样为磺胺类抗生素的磺胺嘧啶在双室MFC生物阳极降解过程中,苯胺环与磺胺嘧啶磺酸基团之间的S—N键断裂,最终产生了两种主要的产物:嘧啶-2-氨基磺氨酸和苯胺[40]。与氯霉素相似的是,磺胺类抗生素最终产物均为具有苯胺环结构的芳香胺产物。目前并没有研究显示BES可以将抗生素彻底降解为不具有苯胺环结构的产物,因此后续应重点研究如何在BES中彻底矿化抗生素,使其降解为不具有苯胺环、无毒害作用的产物。
3 生物电化学降解抗生素的影响因素
BES降解抗生素的性能受到很多参数的影响,例如:抗生素本身的特性和浓度、碳源、电极材料、施加电势等[41-44]。对这些关键影响因素展开研究和讨论,将有利于该体系的进一步被优化和应用。
3.1 抗生素的电化学性质和浓度
抗生素的分子结构以及官能团会对生物电化学的反应活性有着显著的影响[35,45]。因此,抗生素的电化学性质为目标抗生素是否适合被用于电化学降解提供了判断依据。抗生素的电化学性质通常可用循环伏安法(CV)进行测定,由CV曲线获得目标物质可能发生氧化还原反应的不同电势电位条件[35,45]。呋喃西林经CV分析后约在-0.35、-0.60和-0.95 V有3个还原峰电位,表明呋喃西林可以在生物阴极上被还原,并且在不同的阴极电位下会发生3个还原反应[32]。氯霉素在CV扫描下发现不同的阴极电位,导致氯霉素的转化反应和代谢产物都不同[21-22]。除抗生素本身的电化学性质外,BES系统中抗生素的初始质量浓度也会直接影响着降解效能。氯霉素在双室MEC生物阴极中的降解效率随着初始质量浓度的增加(10、20和50 mg/L)而降低[46]。磺胺甲恶唑MFC生物阳极的降解研究中,随着磺胺甲恶唑的质量浓度从20 mg/L增加到200 mg/L,磺胺甲恶唑的去除周期从24 h延长到72 h[30]。然而,头孢曲松钠在空气阴极单室MFC生物阳极中降解时,初始质量浓度50 mg/L的去除效率(91%)远远高于初始质量浓度30 mg/L的去除率(51%)[28]。
3.2 碳源的影响
碳源除了可以用来维持微生物的生长代谢,在BES的抗生素降解中还是重要的共代谢底物和电子供体[47-48]。BES生物阳极降解抗生素的研究主要涉及的是有无额外添加有机碳源以及共代谢方面的影响,生物阴极降解抗生素的研究中还涉及添加有机碳源与无机碳源的区别。土霉素在MFC生物阳极中充当电子供体运行330 d后,10 mg/L土霉素的去除效率在78 h内达到99%,且运行过程中MFC最大电压约为0.6 V,表明土霉素可以作为微生物群落代谢的唯一碳源从而进行降解[49]。在空气阴极单室MFC的生物阳极使用葡萄糖-青霉素混合物作为碳源时,50 mg/L青霉素添加1 g/L葡萄糖时的最大电流密度(10.73 A/m2)是青霉素(3.03 A/m2)的3.5倍,青霉素与葡萄糖进行共代谢增强了青霉素的降解效率(50 mg/L青霉素24 h降解效率为98%)[20]。BES生物阴极降解呋喃西林时以NaHCO3作为碳源时,3种降解产物的降解动力学的总体趋势与葡萄糖作为碳源的生物阴极一致,阴极电位-0.8 V时降解效率约为65%,证明使用无机碳源的生物阴极生物催化能力仍然较强[22]。BES生物阴极降解氯霉素时,随着葡萄糖质量浓度的增加(0.6 g/L增至1.0 g/L),生物阴极获得了更大的阴极电流,阴极反应在葡萄糖质量浓度增加时,电子转移速率也有所增加[23]。由此,BES降解抗生素的过程中有机碳源的添加,可以强化抗生素降解和电能回收。然而有机碳源的加入,不仅会提高处理成本,还可能导致二次污染,利用一些有机废水来作为抗生素降解的共代谢底物或电子供体将是未来朝着应用化进程发展的一个方向[39]。
3.3 电极材料
BES中电活性微生物附着在电极材料表面形成生物膜,可用于抗生素降解并进行电子转移,因此电极材料是影响BES降解效能的基础[50]。目前,BES降解抗生素的研究大都以碳基材料(例如碳毡、碳布和碳刷等)作为电极材料。Wu等[51]使用碳棒、铜泡沫和镍泡沫作为阴极电极,在MEC非生物阴极中对氯霉素进行降解。铜泡沫电极在12 h内去除了32 mg/L氯霉素,明显大于碳棒24 h和镍泡沫120 h的去除率。不同的电极材料会形成不同的最终产物,氯霉素在铜泡沫的作用下完全矿化成CO2和H2O,在碳棒作用下的最终产物是硝基苯,镍泡沫作用下的最终产物为4-硝基苄醇。运行过程中泡沫铜电极有最高的还原电流。
3.4 施加电势
在BES阴极降解抗生素的过程中,施加电势的变化可以对BES中电化学活性生物膜提供不同程度的电刺激,不同数量的电子供体也会影响抗生素的降解速率及矿化程度[52]。Kong等[22]在MFC生物阴极降解呋喃西林时,阴极电势为-0.2 V的还原速率常数为(0.677±0.069) h,还原效率为(42.25±1.35)%;阴极电势变为-0.8 V的还原速率常数和还原效率分别增加至(1.202±0.124) h和(70.60±4.21)%。且阴极电势为-0.2 V时呋喃西林的两种中间产物(5-氨基-2-呋喃基)-亚甲基-肼甲酰胺(AMN)和(5-硝基-2-呋喃基)-甲胺(NFF)在72 h显著积累,未进行下一步降解;当阴极电势变为-0.8 V时,AMN和NFF在48 h内得到迅速降解。氯霉素在MEC生物阴极进行降解时随着施加电势的增加(-0.5 V增至-1.25 V)降解速率及去除效率增加,被氯霉素还原的中间产物AMCl2可以在-1.25 V下进一步降解生成AMCl,但在-0.5 V不能进行[53]。更大的施加电势显著提高了抗生素的去除效果,但过高的电压会导致其他副反应的发生(如析氢)并增加能源的消耗。
4 生物电化学降解抗生素废水过程中对ARGs的影响
随着抗生素药物使用的增加,越来越多ARB和ARGs的增殖与传播对公众健康造成了威胁[54]。因此,BES降解抗生素的过程中是否对ARGs的传播和扩散存在潜在风险值得思考。
MFC生物阳极以土霉素为电子供体运行330 d后,MFC流出物中ARGs和活动遗传元件为1.736 4和0.006 5标准拷贝数,且土霉素的初始质量浓度与MFC流出物中的ARGs含量无显著相关性[51]。MFC生物阴极降解氯霉素的过程中较低的初始质量浓度(10 mg/L)可有效抑制ARGs的传播;负阴极电位较高(-1.25 V)时ARB的含量增加,诱导了ARGs的表达,但在中等阴极电位下(-1 V)ARB的富集和ARGs的表达均可被调节[46]。MEC非生物阴极去除四环素时,随着阴极电流的增加(7 mA增至28 mA)sulI和intI1的丰度也有所增加,intI1丰度与电流之间具有显著的相关性,由此,更高的电流可能促进ARGs的水平转移[55]。MFC耦合人工湿地去除四环素装置在长期运行后生物膜中的sulI和tetC丰度增加,均高于出水中的丰度;在运行期间大多数ARGs均未显著增加,ARGs与16SrRNA基因拷贝数之间未发现显著相关性[26]。尽管上述实验结果表明:在ARB与ARGs传播方面,将BES用于抗生素的去除有一定风险,但与传统处理方式相比,BES可以最小化ARB和ARGs的增殖与传播。Yan等[49]发现用于降解土霉素的MFC生物阳极生物膜中总ARGs的标准化拷贝数明显低于传统的厌氧处理。同样在MFC生物阴极降解氯霉素的过程中ARB的丰度与floR和cmlA基因的相对表达均随着氯霉素的完全降解而下降[46]。
5 结语
基于微生物代谢和电化学氧化还原的耦合,BES被认为是降解废水中抗生素最有前景的方法之一。抗生素种类繁多、结构复杂且电化学性质各异,适用的BES降解方式也会不同,同时可将BES与其他技术进行耦合,尤其是与传统污水处理厂已有的手段进行整合应用。尽管BES降解废水中的抗生素已展现出诸多优势,但目前相关研究还处于初级阶段,抗生素降解效率还较低,反应机制尚不明晰,一些复杂的抗生素还不能完全彻底矿化,降解中间产物仍可能对环境存在着潜在的危害。因此,可以开发一些低成本电极材料,并对不同BES降解废水中抗生素的机制进行深入探讨。另外,在关注BES降解抗生素效率的同时还应关注过程中ARGs丰度的变化,这将是评估这一技术是否具备应用前景的关键考量因素之一。
