改进的QuEChERS-气相色谱-质谱法测定中式腊肉中8 种挥发性N-亚硝胺
2021-11-05戴裕杰关荣发黄海智孙玉敬何荣军
戴裕杰,关荣发,,黄海智,孙玉敬,何荣军,杨 开,蔡 铭
(1.中国计量大学生命科学学院,浙江 杭州 310018;2.浙江工业大学食品科学与工程学院,浙江 杭州 310014)
作为N-亚硝基化合物中的一类,目前已知的N-亚硝胺约有300 种,其基本结构为R1(R2)N—N=O,且大部分具有致癌性。N-亚硝胺广泛存在于饮料和酒类[1-2]、酱油[3]、 蔬菜制品[4-6]、水产品[7-9]、肉及肉制品[10-11]等食品中。食品中的N-亚硝胺可分为挥发性N-亚硝胺和非挥发性 N-亚硝胺两类,而挥发性N-亚硝胺的致癌作用强于非挥发性N-亚硝胺[12]。食品中常见的挥发性N-亚硝胺包括 N-亚硝基二甲胺(N-nitrosodimethylamine,NDMA)、N-亚硝基甲乙胺(N-nitrosomethylethylamine,NMEA)、N-亚硝基二乙胺(N-nitrosodiethylamine,NDEA)、N-亚硝基二丙胺(N-nitrosodipropylamine,NDPA)、N-亚硝基二丁胺(N-nitrosodibutylamine,NDBA)、N-亚硝基哌啶(N-nitrosopiperidine,NPIP)、N-亚硝基吡咯烷(N-nitrosopyrrolidine,NPYR)、N-亚硝基吗啉(N-nitrosomorpholine,NMOR)等。1987年国际癌症研究机构将N-亚硝胺定义为强致癌性食品污染物,并将NDMA和NDEA列为2A类致癌物[13]。
中式腊肉是一种以畜肉为原料,配以其他辅料,经腌制、烘干(或晒干、风干)、烟熏(或不烟熏)等工艺加工而成的非即食肉制品[14]。烟熏腊肉主要在四川和湖南生产消费[15-16],因其独特的风味和易于保存的特性而深受当地居民的喜爱。在腊肉腌制过程中常会加入亚硝酸盐,以起到发色、抗氧化和抑菌的作用[17],进而提高产品的食用品质和生物安全性。但在腊肉加工和后续贮藏过程中,特别是在酸性条件下,亚硝酸盐会和蛋白质分解产生的仲胺通过亚硝化反应生成N-亚硝胺[18]。此外,以猪肉这类红肉作为制作原料[11,19]以及采用烘烤烟熏的热加工方式[20-21]都会提高腊肉中N-亚硝胺的含量水平。腊肉中N-亚硝胺的存在,严重影响其食用安全性并对公众健康安全构成威胁。GB 2762—2017《食品中污染物限量》要求肉制品中NDMA含量应不大于3.0 μg/kg[22];而美国农业部规定腌制肉类中总挥发性N-亚硝胺的限量标准为10.0 μg/kg。目前,尚未有研究报道中式腊肉中N-亚硝胺的风险水平,因而有必要对代表性产地中式腊肉中N-亚硝胺的种类和含量进行检测并评估其风险水平。
QuEChERS方法通过使用萃取盐和吸附剂将前处理中的提取和净化相结合,相比固相萃取[23-24]和固相微萃取[11,25]无需专用设备,具有简便、廉价的特点。该方法目前已在部分动物性食品中N-亚硝胺检测的前处理环节使用[8,10,26-27],但尚未用于中式腊肉。此外,腊肉中N-亚硝胺含量低,且基质复杂(含脂肪、烟熏和香辛料等成分),因此需基于QuEChERS法对前处理中的提取、净化和浓缩环节进行系统优化。目前,色谱-质谱联用技术凭借其出色的分离能力和高灵敏度已广泛应用于食品中N-亚硝胺的检测[1,6,11]。综合仪器的灵敏度和通用性,本研究采用GB 5009.26—2016《食品中N-亚硝胺类化合物的测定》第1法中的气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)法[28]进行分离定量。
本研究旨在采用改进的QuEChERS和GC-MS法建立测定中式腊肉中8 种挥发性N-亚硝胺(包括NDMA、NMEA、NDEA、NDPA、NDBA、NPIP、NPYR和NMOR,化学结构见图1)的检测方法。系统优化提取溶剂种类、超声时间、冷冻时间、吸附剂种类和用量、氮吹水浴温度以及氮吹定容体积,并从线性关系、基质效应、灵敏度、准确度和精密度方面对方法进行评价。同时,应用该方法检测12 份代表性市售样品,评估目前中式腊肉中N-亚硝胺的风险水平,并分析产地和猪肉种类对N-亚硝胺含量影响的显著性。以期能为腊肉及其他肉制品中N-亚硝胺的控制工艺研发、风险评估和法规完善提供方法支持和数据借鉴。
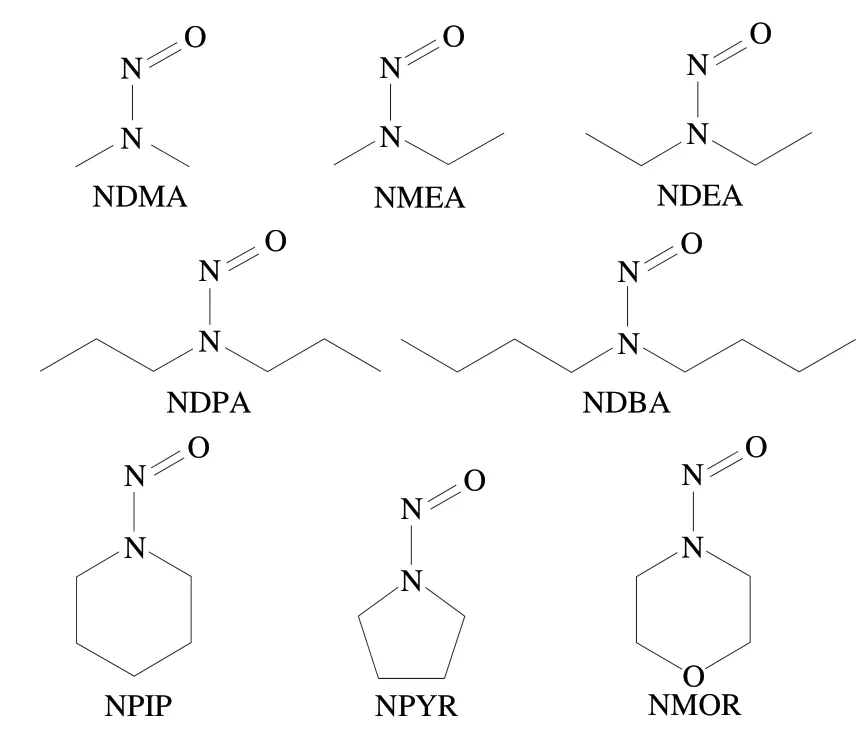
图1 8 种挥发性N-亚硝胺的化学结构式Fig. 1 Chemical structures of eight volatile N-nitrosamines
1 材料与方法
1.1 材料与试剂
12 份代表性中式腊肉样品(四川和湖南各6 份)均购自电商平台;通过预实验选择基质最复杂的7号中式腊肉(猪五花)样品作为前处理优化和方法评价中的实验基质,计算回收率时扣除其N-亚硝胺本底含量。
乙腈、甲醇、正己烷、二氯甲烷、乙酸乙酯、氯化钠、无水硫酸镁、无水硫酸钠(均为分析纯) 杭州高晶精细化工有限公司;N-丙基乙二胺(primary secondary amine,PSA)、十八烷基硅烷键合硅胶(octadecylsilane,C18) 上海安谱实验科技股份有限公司;甲壳素、壳聚糖、多壁碳纳米管(multi-walled carbon nanotubes,MWCNTs)、纳米Fe3O4上海阿拉丁生化科技股份有限公司;N-亚硝胺混标(2 mg/mL,含NDMA、NMEA、NDEA、NDPA、NDBA、NPIP、NPYR和NMOR) 美国o2si公司。
1.2 仪器与设备
BCD-215YD E冰箱 青岛海尔股份有限公司;PL403电子天平 梅特勒-托利多仪器(上海)有限公司; NP-30旋涡混合器 常州恩培仪器制造有限公司; KQ-100E超声波清洗器 昆山市超声仪器有限公司;DW-FW251超低温冷冻储存箱 中科美菱低温科技有限责任公司;Allegra X-30R高速冷冻离心机 美国 Beckman Coulter公司;7890A-5975C GC-MS联用仪 美国Agilent公司。
1.3 方法
1.3.1 样品前处理
1.3.1.1 提取
将样品去皮后切成约0.5 cm×0.5 cm×0.5 cm的肉丁,混匀后-20 ℃冷冻3 h以上。取适量样品放入粉碎机中绞碎,称取10 g(精确至0.01 g)试样至50 mL聚丙烯离心管中。加入10 mL乙腈,涡旋10 s混匀;再加入1 g氯化钠和4 g无水硫酸镁,涡旋10 s、振荡5 s混匀;30 ℃超声波辅助提取10 min。
1.3.1.2 净化
-40 ℃冷冻20 min后,0 ℃、8 000 r/min离心10 min。将上清液转移至另一含300 mg PSA和900 mg无水硫酸钠的50 mL离心管中,涡旋1 min后,0 ℃、8 000 r/min离心10 min。
1.3.1.3 浓缩
将上清液转移至另一50 mL离心管中,30 ℃水浴氮吹至约1 mL。将浓缩液移取至浓缩管中,室温氮吹至300 μL。用1 mL注射器吸取样液,过0.22 μm尼龙滤膜后注入含内插管的进样瓶中,-20 ℃保存待测。
1.3.2 标准溶液的配制
混标储备液(1 000 ng/mL)的配制:准确移取25 μL混标原液于50 mL容量瓶,乙腈定容。
溶剂混标工作液的配制:用乙腈将混标储备液逐级稀释,配制成质量浓度分别为5、10、15、20、50、150、500 ng/mL的溶剂混标工作液。
基质混标工作液的配制:取7号样品按1.3.1.1节和1.3.1.2节处理,将上清液转移至50 mL离心管,30 ℃水浴完全氮吹干后分别加入300 μL 5、10、20、50、150 ng/mL 和500 ng/mL的溶剂混标工作液,涡旋混匀。
上述标液均置于-20 ℃保存。
1.3.3 GC-MS条件
参考相关文献[27,29]方法进行分析。DB-WAX极性毛细管色谱柱(60 m×0.25 mm,0.5 μm);程序升温:初始温度50 ℃,以20 ℃/min升至120 ℃,再以5 ℃/min升至200 ℃,最后以20 ℃/min升至240 ℃;进样口温度240 ℃;载气(氦气)流速1.0 mL/min;不分流进样;进样量2 μL。
电子电离源;离子源温度230 ℃;四极杆温度150 ℃;采用选择离子监测模式。8 种挥发性N-亚硝胺的保留时间和质谱参数见表1,色谱图见图2。
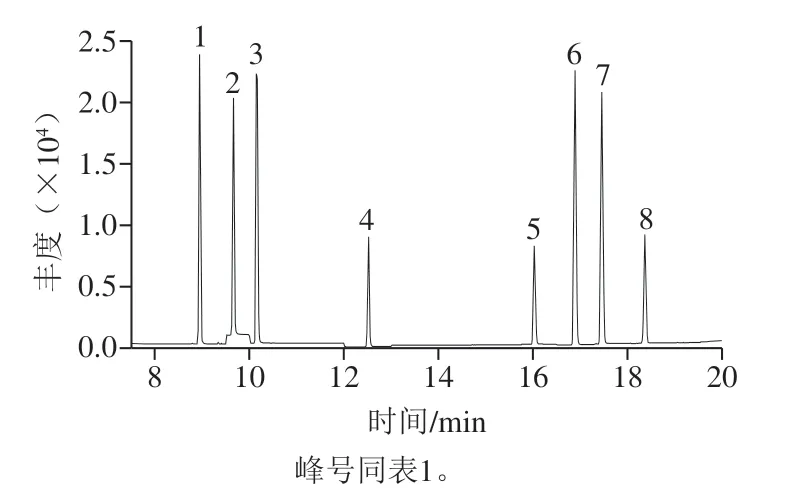
图2 8 种挥发性N-亚硝胺标准品色谱图(500 ng/mL)Fig. 2 Chromatograms of a mixture of eight volatile N-nitrosamine standards (500 ng/mL)
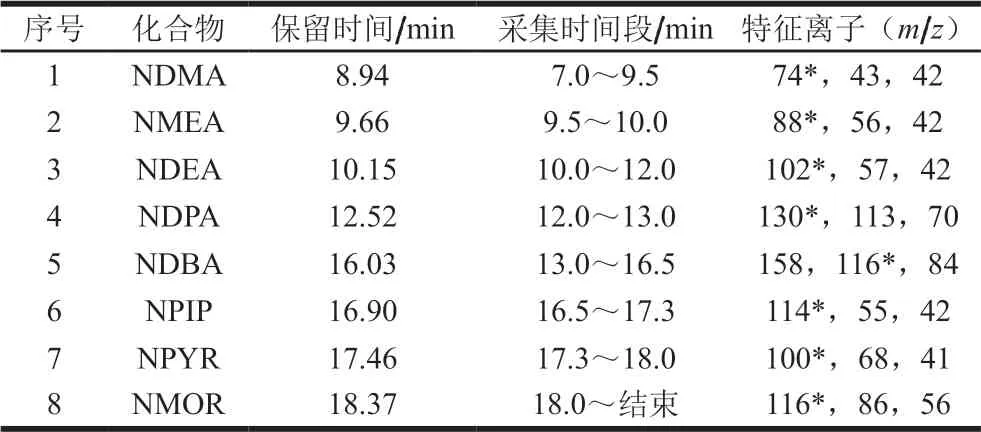
表1 8 种挥发性N-亚硝胺的保留时间和质谱参数Table 1 Retention time and mass spectrometric parameters for eight volatile N-nitrosamines
1.4 统计分析
利用Excel 2019软件进行数据处理,利用GraphPad Prism 8软件进行作图和统计分析。实验设置3 个重复,结果以±s表示。分别采用单因素方差分析Tukey检验和独立样本t检验确定多组和2 组数据均值间的差异显著性(P<0.05)。
2 结果与分析
2.1 前处理优化
2.1.1 提取溶剂种类和超声时间
提取不同动物性食品基质中N-亚硝胺实验确定的最佳提取溶剂有所不同[9,24,29]。因此,本实验综合采用5 种不同极性的溶剂(乙腈、甲醇、正己烷、二氯甲烷和乙酸乙酯)对加标样品中8 种不同极性的N-亚硝胺[30]进行提取。样品按1.3.1.1节提取,加入不同溶剂前均匀滴加200 μL 500 ng/mL的溶剂混标工作液并室温静置15 min[10]进行加标处理(后续加标方式同此),其中超声提取0 min;并按1.3.1.2节净化,其中-40 ℃冷冻10 min,仅使用900 mg无水硫酸钠作为净化填料。将提取净化后的样液50 ℃水浴充分氮吹,上述溶剂对应的共提取杂质体积分别约为0.2、0.5、1.0、1.4 mL和1.8 mL。可见正己烷、二氯甲烷和乙酸乙酯这3 种亲油性溶剂对高脂肪食品中油脂的溶解性较高[24,27]。为降低后续净化难度同时满足500 μL以下氮吹定容体积的要求,因此选择乙腈作为提取溶剂(图3a)。此外,Qiu Yuesheng[8]和Dong Hao[9]等的研究结果表明,采用乙腈提取N-亚硝胺相比其他溶剂具有更高的回收率。
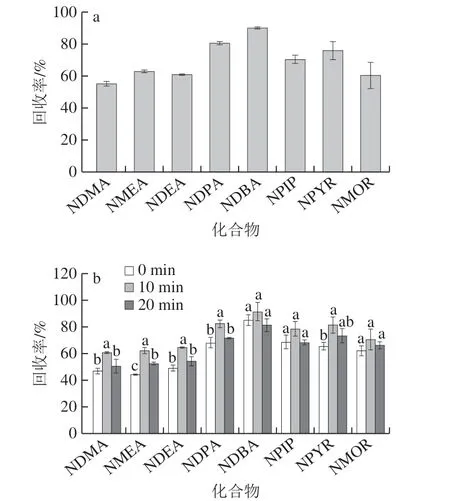
图3 提取条件对8 种挥发性N-亚硝胺回收率的影响Fig. 3 Effect of extraction conditions on recoveries of eight volatile N-nitrosamines
而陶森等[29]的实验结果表明,乙酸乙酯(96.3%)相比乙腈(87.4%)对NDMA的提取回收率更高。为进一步提高8 种N-亚硝胺的回收率,采用乙腈结合超声波辅助提取。加标样品按1.3.1.1节提取,超声提取不同时间(0、10 min和20 min);净化处理同提取溶剂种类优化;按1.3.1.3节浓缩,其中水浴温度50 ℃、氮吹浓缩至500 μL。如图3b所示,超声提取10 min相比不处理(0 min),5 种N-亚硝胺(除NDBA、NPIP和NMOR)的回收率均有显著提高(P<0.05)。而随着超声时间延长到20 min,部分小分子质量、低沸点的N-亚硝胺(NDMA、NMEA、NDEA和NDPA)的回收率相比10 min出现显著下降(P<0.05),这可能是萃取盐进一步吸水放热和超声提取热效应造成的损失。因此,选择超声提取时间为10 min。
2.1.2 冷冻时间、吸附剂种类和用量
中式腊肉中脂肪含量较高,尤其是以猪五花肉为原料制作的腊肉。虽然采用乙腈提取能够明显减少脂肪类共萃取物,但提取液中仍会保留少量的脂类物质。提取液经氮吹浓缩,其中杂质的比例会进一步提高,从而影响结果定量的准确性。根据脂类在低温下易凝固的特性及其与N-亚硝胺熔点的差异,可利用冷冻和低温离心的方法使脂肪从提取液中析出并与之分离[13,29]。加标样品按1.3.1.1节提取;按1.3.1.2节净化,分别冷冻不同时间(0、10、20 min和30 min),其中仅使用900 mg无水硫酸钠作为净化填料;浓缩处理同超声时间优化。随着冷冻时间的延长,除脂效果会更加彻底,但当时间延长至30 min,NMOR的回收率出现显著下降(P<0.05) (图4)。因此,确定最佳冷冻时间为20 min。
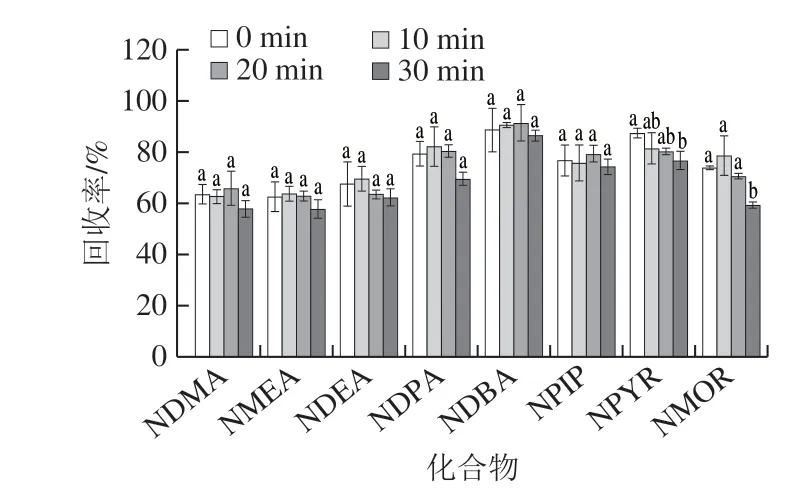
图4 冷冻时间对8 种挥发性N-亚硝胺回收率的影响Fig. 4 Effect of freezing time on recoveries of eight volatile N-nitrosamines
冷冻净化后的上清液呈淡黄绿色,将其充分氮吹,离心管底部仍有微量红色油状杂质。本实验分别采用6 种不同除杂效果的吸附剂(PSA[3,27]、C18[3,26]、甲壳 素[31-33]、壳聚糖[32-33]、MWCNTs[34-35]和纳米Fe3O4[36])结合无水硫酸钠作为QuEChERS净化填料进行第2步净化。样品按1.3.1.1节提取;按1.3.1.2节净化,其中净化填料分别采用6 种不同吸附剂+900 mg无水硫酸钠的形式。在200、300 mg和400 mg添加量条件下,提取液经PSA净化并充分氮吹后离心管底部无明显油状物残留,其净化效果均明显优于其他5 种吸附剂。这可能是由于经冷冻净化后提取液中保留的主要是少量极性共萃取物,它们更易通过极性相互作用与PSA结合。在已加入PSA的50 mL离心管中添加10 mL 10 ng/mL的溶剂混标工作液,涡旋1 min后0 ℃、8 000 r/min离心10 min,浓缩处理同超声时间优化,考察不同PSA用量(200、300 mg和400 mg)对8 种N-亚硝胺回收率的影响。由表2可知,当用量增加到400 mg时,NDMA、NDBA和NPYR的回收率均出现显著下降(P<0.05),因而选择300 mg作为PSA的最终用量。在此基础上,确定净化填料的最佳组合为300 mg PSA+900 mg无水硫酸钠。

表2 吸附剂种类和用量对8 种挥发性N-亚硝胺回收率的影响Table 2 Effects of adsorbent types and amounts on recoveries of eight volatile N-nitrosamines
2.1.3 氮吹水浴温度和氮吹定容体积
8 种N-亚硝胺为低分子质量、易挥发性物质,根据超声提取温度实验结果(该因素未列出),其回收率易受温度影响。取10 mL 10 ng/mL溶剂混标工作液按1.3.1.3节浓缩至500 μL,考察不同水浴温度(30、40、50、60 ℃和70 ℃)对8 种N-亚硝胺回收率的影响。如图5a所示,当水浴温度从30 ℃升至40 ℃,NDMA、NMEA和NDEA 3 种N-亚硝胺的回收率出现显著下降 (P<0.05)。为保证小分子质量N-亚硝胺的回收率,最终采用30 ℃的氮吹水浴温度。

图5 浓缩条件对8 种挥发性N-亚硝胺回收率的影响Fig. 5 Effects of condensation conditions on recoveries of eight volatile N-nitrosamines
为提高方法的灵敏度,需将样液浓缩至微量体积。取10 mL 10 ng/mL溶剂混标工作液按1.3.1.3节氮吹浓缩至不同体积(0、100、300 μL和500 μL)。如图5b所示,当采用完全吹干(0 μL)后加对应体积溶剂的定容方式时,会造成8 种N-亚硝胺回收率的显著下降 (P<0.05),这与Dong Hao等[9]的研究结果一致。而选择氮吹至近干后定容的方式,在微量定容体积条件下会使结果产生较大偏差。因而选择先将样液水浴氮吹至约1 mL再转移至浓缩管常温氮吹至对应定容体积的方式进行浓缩。分别考察浓缩至100、300 μL和500 μL对8 种N-亚硝胺回收率的影响,结果表明当氮吹浓缩至300 μL时8 种N-亚硝胺的回收率相较500 μL无显著下降,同时能在一定程度上降低方法的定量限。而当浓缩至100 μL时,由于定容体积过小,无法保证部分N-亚硝胺的回收率。因此,最终选择将样液氮吹浓缩至300 μL。
2.2 方法评价
2.2.1 线性关系、基质效应、检出限和定量限结果
按1.3.3节方法分别对6 个质量浓度梯度(5、10、20、50、150 ng/mL和500 ng/mL)的溶剂和基质混标工作液进行检测,以质量浓度(ng/mL)为横坐标、目标物定量离子峰面积为纵坐标进行线性回归,分别得到相应的线性方程和相关系数。基质和溶剂线性方程的相关系数均大于0.997(表3仅为基质的),表明目标物在相应质量浓度范围内线性关系良好。
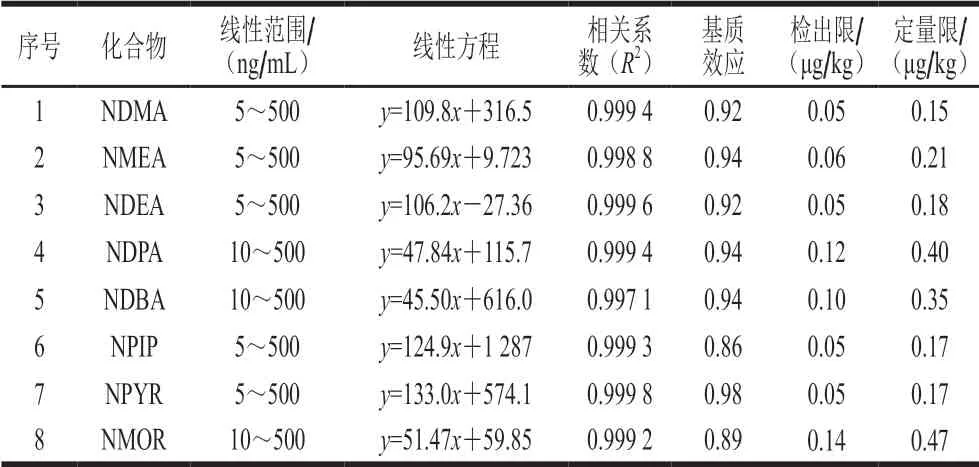
表3 8 种挥发性N-亚硝胺的线性范围、线性方程、相关系数、 基质效应、检出限和定量限Table 3 Linear ranges, linear equations, correlation coefficients, matrix effects, limits of detection and limits of quantification for eight volatile N-nitrosamines
通过计算基质与溶剂标准曲线间斜率的比值考察基质效应[8]。根据SANTE文件[37],当基质效应为0.8~1.2时,表明基质效应较弱,可忽略其对结果的影响。由表3可知,8 种N-亚硝胺的基质效应为0.86~0.98,表现为不同程度的基质抑制,但整体较弱,这表明通过低温冷冻结合PSA两步净化实现了良好的除杂效果。但为获得更准确的结果,本研究仍采用基质标准曲线对目标物进行校正定量。
分别将定量离子信噪比为3∶1和10∶1时每种目标物的含量定义为该方法的检出限和定量限。如表3所示,该方法8 种挥发性N-亚硝胺的检出限和定量限范围分别为0.05~0.14 μg/kg和0.15~0.47 μg/kg,其定量限水平均低于GB 5009.26—2016《N-亚硝胺类化合物的测定》第一法的定量限(1.0 μg/kg)[28],这表明方法的灵敏度较高。
2.2.2 平均回收率和相对标准偏差结果
取10 g粉碎后的7号样品于50 mL离心管中,分别添加200 μL 15、50 ng/mL和150 ng/mL低中高3 个添加量(0.3、1.0 μg/kg和3.0 μg/kg)的溶剂混标工作液进行加标处理。按1.3.1节和1.3.3节进行加标回收实验,每个添加量设置6 个重复。如表4所示,8 种挥发性N-亚硝胺的平均回收率为71.3%~94.1%,相对标准偏差为0.4%~11.2%,均在SANTE文件规定的可接受范围内(70%≤平均回收率≤120%、相对标准偏差≤20%)[37]。
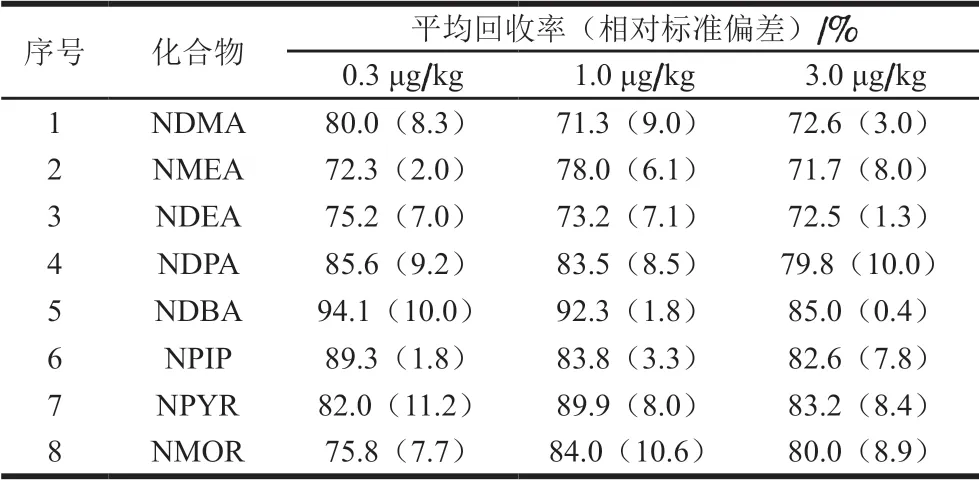
表4 8 种挥发性N-亚硝胺的平均回收率和相对标准偏差Table 4 Average recoveries and relative standard deviations of eight volatile N-nitrosamines
2.3 实际样品测定结果
采用建立的方法对12 份代表性中式腊肉样品进行检测,结果如表5所示,中式腊肉中主要的挥发性N-亚硝胺为NDMA、NDEA、NDBA、NPIP、NMEA和NDPA,其检出率和平均含量分别为41.7%~58.3%和0.33~0.74 μg/kg, 其中NMOR未检出。目前国标中尚未对总挥发性N-亚硝胺含量进行限定,本研究以样品中8 种挥发性N-亚硝胺含量之和作为样品中的总挥发性N-亚硝胺含量。参照GB 2762—2017和美国农业部的限量标准,将单项和总N-亚硝胺的限量水平分别设置为3.0 μg/kg和10.0 μg/kg。12 份样品中仅1 份样品的NDEA含量(3.06 μg/kg)超标,而总挥发性N-亚硝胺含量均未超标,这表明目前市售中式腊肉中挥发性N-亚硝胺的含量水平整体较低。这可能与近年来腊肉生产工艺的不断改进有关,如亚硝酸盐添加量的控制、卫生状况的改善和低温烟熏技术的运用等。此外,由表6可知,产地和猪肉种类对中式腊肉中总挥发性N-亚硝胺含量均未产生显著影响(P>0.05)。
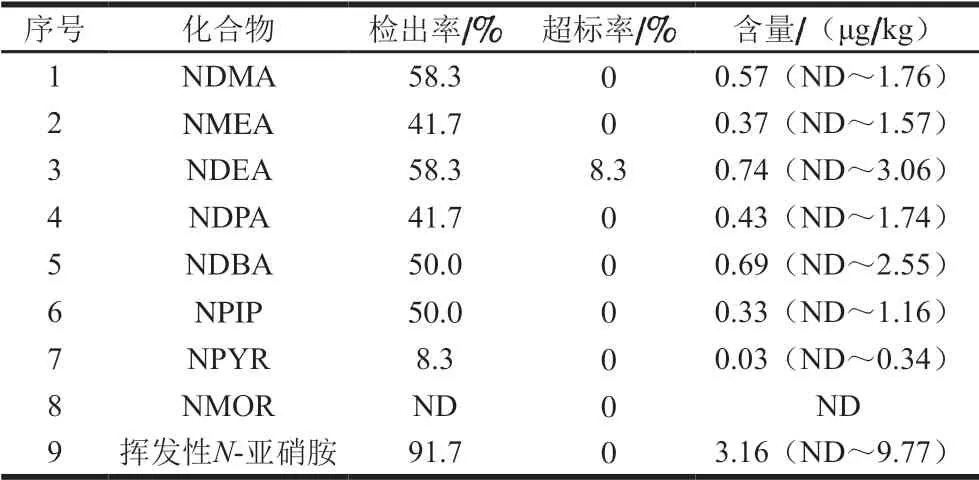
表5 12 份中式腊肉样品中8 种挥发性N-亚硝胺的含量水平Table 5 Contents of eight volatile N-nitrosamines in 12 Chinese bacon samples

表6 产地和猪肉种类对12 份中式腊肉样品中总挥发性 N-亚硝胺含量的影响Table 6 Effect of geographical origin and pork cuts on contents of total volatile N-nitrosamine in 12 Chinese bacon samples
3 结 论
本研究基于QuEChERS前处理方法进行系统优化。采用冷冻和PSA两步净化降低基质效应(0.86~0.98);通过氮吹浓缩至300 μL提高方法灵敏度(定量限0.15~0.47 μg/kg);利用乙腈结合超声波辅助提取提高方法准确度(回收率71.3%~94.1%)。基于改进的QuEChERS法和GC-MS法建立的检测方法,操作简便、成本低廉,适用于中式腊肉中8 种挥发性N-亚硝胺的测定。而该法是否适用于其他原料种类的腊肉制品及动物性食品中N-亚硝胺的检测,则需通过进一步的实验验证。该方法的建立有助于为中式腊肉中N-亚硝胺控制技术的研发提供方法支持。
将该方法用于市售样品中N-亚硝胺水平的评估,结果表明,目前中式腊肉中8 种挥发性N-亚硝胺和总挥发性N-亚硝胺的风险水平均较低。但今后仍需对其风险水平进一步全面评估,包括增大样本量、扩大原料种类和产地的范围等。目前国标中仅规定了NDMA的限量要求,但市售样品中还检出了其他6 种挥发性N-亚硝胺,因此需增加标准中应检测的N-亚硝胺种类,尤其是补充总N-亚硝胺含量这一指标。
