海鲈鱼肉蒸制过程中品质及风味特性的变化
2021-11-05赵洪雷徐永霞仪淑敏李学鹏郭晓华励建荣
赵洪雷,冯 媛,徐永霞,,仪淑敏,李学鹏,步 营,谢 晶,郭晓华,励建荣,
(1.渤海大学实验中心,辽宁 锦州 121013;2.渤海大学食品科学与工程学院,海洋食品精深加工关键技术省部共建协同创新中心,辽宁 锦州 121013;3.上海海洋大学食品学院,上海 201306;4.山东美佳集团有限公司,山东 日照 276800)
大部分鱼制品和肉制品在生产过程中需要进行热加工,不仅可以杀灭病原微生物,提高食用安全性,而且可以赋予产品良好的色泽、风味,同时对产品的质构有重要影响[1]。现有的热加工方式主要有蒸制、煮制、油炸、烘烤和微波等,不同的加热方式由于温度、时间、导热介质等的差异会对食品品质造成不同程度的影响[2-4]。 Li Jinlin等[5]研究发现油炸可以明显改善草鱼片的滋味和气味,但同时也会降低鱼片的营养价值。Hu Lvlin等[6]研究了5 种不同加热方式对鲟鱼肉蛋白氧化的影响,结果表明蒸制和煮制能最大程度降低鱼肉蛋白的氧化程度,而油炸和烤制则明显加剧了氧化程度。蒸制和煮制是最常用的热加工方式,相比之下,蒸制能较好地保持食材的原汁原味,有效避免因高温烹调所造成的营养素流失,且蒸制过程中油、盐的添加均较少,符合人们对健康饮食的追求,蒸制的温度、时间等条件直接影响产品的质量及出品率[7-8]。沈清等[9]研究发现高压蒸制的扣肉与常压相比颜色较深,脂肪氧化程度较大,而硬度、咀嚼度较小。范婷婷等[10]研究表明,蒸制15 min的鸡胸肉中挥发性风味成分种类及数量明显高于蒸制5 min和25 min的样品。郑皎皎等[11]研究发现,随蒸制时间的延长,鲤鱼肌肉组织的失水率和pH值均呈上升趋势,蒸制后鱼肉纤维间隙明显增大。董志俭等[12]研究发现不同蒸制时间下南美白对虾的质构明显不同,其中自由水的损失直接导致虾肉质构的变化。
海鲈鱼(Perca fluviatilis)是我国沿海地区重要的经济鱼类,属鲈形目、鲈亚目、鮨科、花鲈属,主要分布于我国的渤海、黄海等海域[13]。海鲈鱼肉质鲜美,口感细嫩,风味独特,肌肉中富含蛋白质、氨基酸、维生素和矿物质,同时富含二十碳五烯酸和二十二碳六烯酸等营养成分而深受消费者的青睐[14]。蒸制对海鲈鱼肉的质构、水分及风味等具有重要影响,而目前关于此方面的研究鲜见报道。本实验研究海鲈鱼肉蒸制过程中理化指标及风味特性的影响,探寻适宜的热加工条件,以期为海鲈鱼的精深加工及食品化菜品的开发提供一定的理论参考和依据。
1 材料与方法
1.1 材料与试剂
新鲜海鲈鱼购于辽宁锦州市林西街水产市场,每尾质量1~1.2 kg。
甲醇(色谱纯) 天津市风船化学试剂科技有限 公司;磷酸氢二钠、乙腈(均为色谱纯) 上海阿拉丁科技股份有限公司;三氯乙酸(分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
CR-400色差仪 日本柯尼卡美能达公司;PEN3便携式电子鼻 德国AIRSENSE公司;SA402B电子舌 日本Nikon公司;TA.XT.Plus质构仪 英国Stable Micro System公司;MesoMR23-060H-1型核磁共振成像分 析仪 上海纽迈电子科技有限公司;UV-2550紫外-可见光分光光度计 岛津仪器(苏州)有限公司;SL-8900全自动氨基酸分析仪 日本Hitachi公司;PHS-3C-3E精密台式数显酸度计 上海仪电科学仪器股份有限公司; 台式高速冷冻离心机 美国Thermo Fisher Scientific 公司;1260高效液相色谱仪 美国Agilent公司;MS105DU分析天平 梅特勒-托利多仪器(上海)有限公司;C21-DC005型电磁炉、MP-ZG24G02蒸锅 美的股份有限公司。
1.3 方法
1.3.1 样品预处理
取海鲈鱼背部肌肉,洗净沥干,去皮后切成大小均匀的鱼块(5 cm×5 cm×1.5 cm),摆放在带孔不锈钢盘中,置于蒸锅中分别加热4、6、8、10 min和12 min,取出吸去表面水分得到蒸制样品,并以新鲜鱼块为对照组。
1.3.2 质量损失率的测定
用滤纸吸干鱼块表面水分,然后精确称质量,蒸制加热前后样品的质量差与加热前样品的质量之比即为质量损失率。
1.3.3 色度的测定
将样品放至室温,切成2 cm3的立方体,采用色差计测定新鲜及蒸制不同时间后鱼肉样品的亮度值L*、红绿值a*、黄蓝值b*。
1.3.4 水分分布状态的测定
横向弛豫时间T2测定:鱼肉样品在室温条件下静置30 min后切成适宜大小的长方体并装入核磁管中,采用多脉冲回波序列进行测试,利用核磁共振弛豫时间反演拟合软件得到T2图谱。测定条件:磁场强度0.5 T,质子共振频率21 MHz。测量参数:硬脉冲90°脉宽5.6 μs,硬脉冲180°脉宽12 μs,采样频率250 kHz,重复采样等待时间4 000 ms,回波个数8 000,回波时间0.1 ms,累加采集次数32。
核磁共振成像:采用T1和T2加权成像,通过纽迈核磁共振成像软件及MSE序列实现,并用Image-J软件测定样品灰度。参数设置:层数6,层厚0.9 mm,层间隙1.9 mm,识别大小256,相位大小192,扫描次数2,T1加权成像的重复时间360 ms,回波时间20 ms,T2加权成像的重复时间1 800 ms,回波时间50 ms。
1.3.5 质构特性的测定
将样品放至室温,切成2 cm3的立方体,采用质构仪对样品的质构特性进行测定。质构仪探头型号为P50,测试前速率为2 mm/s,测试速率、测试后速率均为1 mm/s,压缩比为60%,时间间隔为5 s,每组样品平行测定4 次。
1.3.6 游离氨基酸的测定
参考Li Jinlin等[5]的方法并作适当修改。准确称取5 g鱼肉样品,加入20 mL超纯水,匀浆,然后加入20 mL 5%的三氯乙酸溶液,充分混匀后于4 ℃静置12 h,过滤,取滤液定容至50 mL,摇匀后过0.22 µm滤膜,待氨基酸自动分析仪检测。
1.3.7 电子舌检测
准确称取50 g鱼肉样品,按料水比1∶5(g/mL)加入蒸馏水,匀浆后离心,取35 mL上清液于电子舌专用样品杯中,按照设置的序列放置在电子舌自动进样器上进行检测,单次采样时间为120 s,1 次/s。每组样品重复检测4 次,对后3 次采集到的数据进行味觉特征分析。
1.3.8 电子鼻检测
准确称取5 g捣碎的鱼肉样品于50 mL烧杯中,用保鲜膜密封,室温静置30 min后用电子鼻对挥发性气味进行检测,每组样品重复测定3 次。电子鼻测试时间为120 s,清洗时间为60 s,利用电子鼻自带的Winmuster软件对80~85 s内的数据进行分析。
1.4 数据分析
采用SPSS 19.0、Origin 8.5以及Excel软件对实验数据进行处理、作图及显著性分析,P<0.05,差异显著;采用Gwyddion 2.53对图片进行处理。
2 结果与分析
2.1 质量损失率的变化
由图1可知,随着蒸制时间的延长,鱼肉的质量损失率逐渐上升,蒸制4 min质量损失率为16.97%,蒸制12 min质量损失率达到29.15%,这是由于热加工使鱼肉中的水分、蛋白质和脂肪等化合物流失所致[1]。在加热过程中,肌肉中的游离水运动速率加强,更容易被释放出来[15];此外,蛋白质受热发生变性,尤其是肌原纤维蛋白和胶原蛋白受热后剧烈收缩,使肌肉的持水力降低,同时疏水基团逐渐暴露,使得蛋白质之间的疏水相互作用增强,而鱼肉中的水与蛋白质之间的氢键作用减弱,因此鱼肉中的水分不易被结合而损失,最终造成鱼肉的质量降低[16]。

图1 蒸制时间对海鲈鱼肉质量损失率的影响Fig. 1 Effect of steaming time on mass loss rate of sea bass muscle
2.2 水分分布的变化
不同蒸制时间下海鲈鱼肉的T2弛豫信息如图2所示,可以看出,在0.01~10 000 ms弛豫时间内共有3 个弛豫峰T21、T22和T23,分别代表鱼肉中不同存在状态的水,其中T21为结合水,T22为不易流动水,T23为自由水[17]。蒸制过程中鱼肉中3 种状态水的相对含量变化如图3所示,不易流动水是鱼肉中含量最多的水分,其中新鲜鱼肉中不易流动水相对含量最高,表明新鲜海鲈鱼的肌肉组织结构更为致密、有序,蛋白的持水力较强。鱼肉中的结合水含量较低且不同处理组之间无显著差异。随着蒸制时间的延长,鱼肉中不易流动水相对含量先降低后又升高,而自由水相对含量先升高后又降低,这可能是由于加热过程中肌肉蛋白变性收缩,不易流动水被挤出并向自由水转化,而长时间的加热又导致了肌肉中水分的流失所引起[16]。

图2 不同蒸制时间海鲈鱼肉的水分弛豫时间T2Fig. 2 Transverse relaxation time (T2) spectra of sea bass muscle at different steaming times

图3 不同蒸制时间海鲈鱼肉中3 种状态水的相对含量Fig. 3 Relative contents of three states of water in sea bass muscle at different steaming times
图4为不同蒸制时间下海鲈鱼肉的核磁共振成像图,灰度值范围为0~250,灰度值的大小用不同颜色表示,图中的红色区域为T1加权成像部分,代表高氢质子信号量,体现短弛豫时间;蓝色区域为T2加权成像部分,代表低氢质子信号量,体现长弛豫时间[18]。通过观察鱼肉核磁成像图中的颜色分布,可以直观比较不同蒸制时间下鱼肉的水分分布情况。由图4可见,新鲜海鲈鱼肉中不易流动水及自由水主要集中在鱼肉的中心部位,而蒸制后鱼肉中的不易流动水逐渐向自由水转化,并从中心部位向周边扩散,这可能是由于肌肉纤维组织遭到破坏,蛋白质受热变性,保水性降低。此外,随着蒸制时间的延长,图中红色区域逐渐缩小,表明鱼肉中的不易流动水和自由水在逐渐减少,并在蒸制10 min后变化趋于平缓。
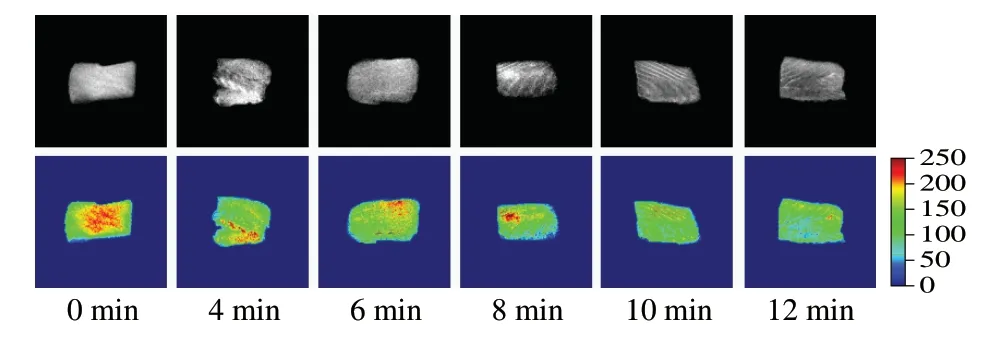
图4 不同蒸制时间海鲈鱼肉的核磁共振成像Fig. 4 Nuclear magnetic resonance images of sea bass muscle at different steaming times
2.3 质构特性的变化
肌肉的水分、胶原蛋白、弹性蛋白和肌纤维本身以及他们之间的相互作用决定了食品的质构特性[19]。由表1可知,随着蒸制时间的延长,鱼肉的硬度和咀嚼度呈先下降后又增大的趋势,而弹性先升高后又降低。在蒸制0~6 min内,随着加热时间的延长,鱼肉的硬度下降但无显著性差异(P>0.05),可能是由于蒸制6 min内由于加热时间较短,鱼块中心部位的肌肉还没有熟化,从而使鱼块硬度变化不显著[1];当加热达到8 min及更长时间时,鱼肉的硬度明显增大(P<0.05),这可能是由于肌肉蛋白发生热变性而凝固、结缔组织收缩及肌动球蛋白脱水收缩等共同作用的结果[12]。新鲜海鲈鱼肌肉的回复性明显高于加热后的样品,可能是由于加热导致肌肉纤维收缩,肌肉无法在受力后继续维持原有形态,从而使回复性降低。

表1 蒸制时间对海鲈鱼肉质构特性的影响Table 1 Effect of steaming time on texture properties of sea bass muscle
2.4 色度的变化
由表2可知,与对照组鱼肉相比,经蒸制后样品的亮度值L*和黄蓝值b*显著升高(P<0.05),而红绿值a*值显著降低(P<0.05),可见加热使鱼肉颜色变白、亮度增加,这可能是由于热处理导致鱼肉肌纤维收缩、水分流失和蛋白质变性所导致的[16]。肌肉中的红色素主要来源于血红蛋白,而加热使鱼肉中的血红蛋白发生变性,生成了其他衍生物,使鱼肉颜色发生变化[20]。此外,当亚铁肌红蛋白被氧化成高铁肌红蛋白时,会导致a*值的下降,当球蛋白构象破坏,亚铁血红素氧化被取代后,可导致L*值的增大[21]。从表2可以看出,蒸制8 min鱼肉的L*值达到最大值,之后随着蒸制时间的延长L*值呈下降趋势,但无显著差异(P>0.05),可见当鱼肉熟化到一定程度后,蒸制时间的进一步延长对L*值的影响不大。

表2 蒸制时间对海鲈鱼肉色泽的影响Table 2 Effect of steaming time on color of sea bass muscle
2.5 游离氨基酸含量的变化及滋味活性值(taste activity value,TAV)分析
游离氨基酸的含量、组成及阈值共同决定了水产品的滋味强度[22]。蒸制时间对海鲈鱼肉中游离氨基酸含量及TAV的影响分别如表3、4表示。由表3可知,海鲈鱼肉中共检测出16 种氨基酸,其中甘氨酸含量最高,其次是脯氨酸、组氨酸、丙氨酸、赖氨酸和丝氨酸等。根据氨基酸不同的结构特性,主要将其分为鲜味、甜味和苦味氨基酸,呈味氨基酸含量越高可使呈味更加浓厚、丰富[23]。海鲈鱼肉中鲜味、甜味氨基酸的总量显著高于苦味氨基酸,其中谷氨酸是鱼肉中主要的鲜味氨基酸,甜味氨基酸中的甘氨酸含量最高,甘氨酸不但可以赋予清香甜味,而且能够降低鱼肉的苦味。甜味氨基酸丙氨酸和谷氨酸共存时具有协同增效作用,可以增强鱼肉的鲜味感[24]。随着蒸制时间的延长,鱼肉中游离氨基酸的总量呈先增大后降低的趋势,在蒸制10 min时总量达到最高值226.82 mg/100 g,这可能是由于蒸制过程中蛋白质受热分解逐渐释放出游离氨基酸,从而使其含量不断增加;而随着加热时间的进一步延长,由于氨基酸自身发生热降解,且可能与还原糖类发生美拉德反应[25], 从而导致游离氨基酸总量又减少,此外长时间的加热使鱼肉汁液流失加剧,鱼肉中游离氨基酸也会随之损失。由表4可以看出,不同蒸制时间下海鲈鱼肉中组氨酸的TAV最大,其次是甘氨酸、丙氨酸、谷氨酸和赖氨酸等,游离氨基酸中除组氨酸的TAV大于1,其他氨基酸的TAV均小于1。虽然甘氨酸、丙氨酸的TAV小于1,但它们可与鱼肉中的其他呈味物质如IMP协同作用, 增强鲜味[26]。此外,Lioe等[27]研究发现,一些苦味氨基酸的含量低于其呈味阈值时,可以增强鲜味、甜味氨基酸的呈味强度。

表3 蒸制时间对海鲈鱼肉游离氨基酸含量的影响Table 3 Effect of steaming time on contents of free amino acids in sea bass muscle

表4 蒸制时间对海鲈鱼肉游离氨基酸TAV的影响Table 4 Effect of steaming time on TAVs of free amino acids in sea bass muscle
2.6 电子舌分析结果
电子舌可模拟人体味觉系统快速并准确地鉴定样品的滋味,与传统的感官评价相比,电子舌对样品的评价更具客观性和重复性。电子舌的主成分分析(principal component analysis,PCA)可反映样品之间的差异,距离越远,说明样品之间的滋味差异越大,反之则 越小[28]。不同蒸制时间下海鲈鱼肉的电子舌PCA如图5所示,PC1和PC2的累计方差贡献率达到98.33%,大于85%,表明这2 个PC包含了样品的大部分信息,可以充分反映鱼肉样品的整体滋味轮廓,且图中PC1贡献率远大于PC2,说明样品在横坐标轴上间距越大其滋味差异也越大[29]。从图5可以看出,不同蒸制时间的鱼肉样品PC得分值分布于4 个象限内,且分别构成一个独立的组群,相互之间几乎没有重叠,说明样品之间的滋味差异显著,电子舌的PCA能有效区分不同蒸制时间的鱼肉样品。此外,蒸制12 min的样品和其他组样品沿PC1方向相距较远,说明其滋味成分差别较大,可能是由于较长时间的加热产生了更多的呈味物质。
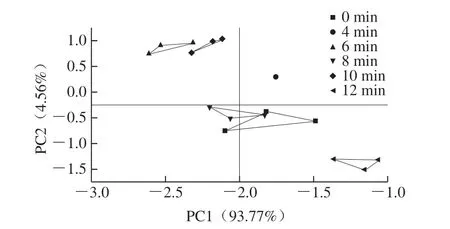
图5 不同蒸制时间海鲈鱼肉电子舌的PCAFig. 5 PCA plot of electronic tongue responses to sea bass muscle at different steaming times
2.7 电子鼻分析结果
电子鼻的PCA是将电子鼻传感器的数据进行转换和降维,并对降维后的特征向量进行线性组合,使它们之间的响应值既不相关,又能反映出样品的整体信息[30]。不同蒸制时间下海鲈鱼肉电子鼻响应值的PCA和线性判别分析(linear discriminant analysis,LDA)如图6所示。由图6A可知,PC1和PC2的贡献率分别为90.08%和9.63%,累计贡献率为99.71%,超过85%,说明这2 种PC包含了鱼肉气味物质的大部分信息,可以充分反映样品的整体气味特征。PCA图中蒸制12 min的样品分布于最右侧,说明其气味显著区别于其他样品。由图6B可知,LD1和LD2的贡献率分别为83.84%和10.59%,总贡献率为94.43%,表明电子鼻的LDA能有效识别不同样品间的气味差异。其中对照组样品位于最左侧,沿横坐标轴距离其他5 组样品较远,说明蒸制后鱼肉的风味发生了显著变化,其挥发性风味物质的组成及含量发生改变。其中蒸制6、8 min和10 min的样品距离较近,说明其风味差异较小,而4 min和12 min的样品与其他组相距较远,可能是因为加热熟化程度不够或加热时间过长使样品的风味产生较大差异。

图6 不同蒸制时间海鲈鱼肉电子鼻响应值的PCA(A)和LDA(B)Fig. 6 PCA (A) and LDA (B) of electronic nose responses to sea bass muscle at different steaming times
3 结 论
随着蒸制时间的延长,海鲈鱼肉的质量损失率显著升高,汁液流失逐渐增加;鱼肉的硬度和咀嚼度呈先下降后增大的趋势,而弹性先升高后又降低,在蒸制8 min时质地较好;鱼肉中的不易流动水逐渐向自由水转化并流失,而结合水变化不明显;蒸制后鱼肉的L*值和b*值显著增大,a*值显著降低。经蒸制后鱼肉中游离氨基酸的总量先增大后降低,在蒸制10 min时达到最高值,组氨酸、甘氨酸、丙氨酸、赖氨酸和谷氨酸是海鲈鱼肉中主要的呈味氨基酸;电子舌和电子鼻结果显示不同蒸制时间下鱼肉的滋味和气味特征区别明显。综上,限定规格的海鲈鱼块在蒸制8~10 min时的理化品质及风味特性较好。
