基于UPLC-Q-TOF-MS技术分析原料乳冷藏 过程中脂类代谢组学
2021-11-05李璞钰罗玉龙王媛媛
李璞钰,剧 柠,罗玉龙,王媛媛,苟 萌
(宁夏大学食品与葡萄酒学院,宁夏 银川 750021)
原料乳富含多种天然成分,易被微生物分解利用。在多数国家中,原料乳挤出后并不立即加工,需进行冷藏,整个过程可能长达6~7 d[1-2]。4 ℃冷藏可有效抑制微生物生长,降低生化反应速率,减缓原料乳品质劣变。但随冷藏期的延长,原料乳仍会发生脂类氧化、蛋白质变性等多种化学反应,从而造成酸度、黏度的增加及絮状物的出现,最终导致原料乳腐败[3]。其原因与原料乳中微生物特别是嗜冷微生物的种类和数量密不可分[4-6],课题组前期对4 ℃冷藏7 d的原料乳菌群数量及多样性展开研究,发现冷藏3 d和6 d时微生物菌群构成较之前发生了显著改变。冷藏3 d优势菌群从不动杆菌、链球菌、梭菌属向假单胞菌、黄杆菌属演替,冷藏6 d优势菌群又转变为不动杆菌及乳球菌属;而原料乳冷藏2 d和5 d菌群变化趋势不显著[7-8]。菌群多样性的复杂变化决定了乳代谢物逐步改变直至原料乳宏观的品质劣变,无法用于加工。
非靶向代谢组学是检测生物体整体水平代谢特征的组学技术应用,通过使用大规模、高通量技术对涉及样品的内源性代谢物进行全局性分析,尽可能多地定性和相对定量生物体系中的代谢物[9-10]。超高效液相色谱-四极杆串联飞行时间质谱(ultra-high performance liquid chromatography quadrupole time-of-flight mass spectrometry,UPLC-Q-TOF-MS)技术相较于其他代谢组学检测技术,在峰容量、灵敏度、分辨率、分析速度上具有绝对优势。其适合检测含有极为复杂的小分子质量代谢物体系的样品,是目前国内外使用较为普遍的分析检测手段,被广泛应用于乳品质量、安全及加工等方面研究。针对原料乳,多项研究依靠该技术剖析不同母体、饲养方式、贮藏条件下乳代谢物差异[11-12],其结果为乳品质改善提供了研究基础。但随冷藏时间的延长,原料乳中代谢物必定发生变化影响乳品质,最终导致原料乳的腐败变质,但其变化情况却鲜有报道。本研究基于该技术对4 ℃冷藏过程中原料乳复杂的代谢物体系进行定性定量分析。通过正交偏最小二乘法判别分析(orthogonal partial least squares-discrimination analysis,OPLS-DA)方法,将不同冷藏时间原料乳代谢产物的种类进行归纳,总结冷藏阶段乳代谢产物的分布变化情况。结合T检验重点筛选脂类显著性差异代谢物并分析其相关通路,探讨冷藏阶段乳脂类代谢的变化规律及相关机理,以期为原料乳保藏及乳制品加工提供理论依据。
1 材料与方法
1.1 材料与试剂
原料乳样品(体细胞数小于2×105个/mL,菌落总数小于1×104CFU/mL,蛋白质质量浓度大于3.0 g/100 mL)来自于宁夏银川当地乳品厂。采集过程严格遵循无菌操作,样品采集后将采样瓶迅速装入含冰袋的隔热包中放置,并于2 h内运回实验室置于4 ℃冷藏。根据前期微生物多样性分析及细菌计数结果,选取菌群变化显著的时间点,即0、1、3、4、6 d进行乳代谢分析。分组编号为B0、B1、B3、B4、B6,每组样本做6 个平行。其中B1 vs B0、B3 vs B1、B4 vs B3、B6 vs B4表示不同冷藏时间原料乳样品的对比组。
乙醇(纯度95%) 国药集团化学试剂有限公司;乙腈(色谱纯) 德国Merck公司;乙酸铵、氨水(均为色谱纯) 德国Sigma公司。
1.2 仪器与设备
1290 Infinity LC UPLC仪 美国Agilent公司;Triple TOF 5600/6600质谱仪 美国AB SCIEX公司;ACQUITY UPLC®BEH C18液相色谱柱(2.1 mm×100 mm,1.7 μm) 美国Waters公司;5430R型低温高速离心机 德国Eppendorf公司。
1.3 方法
1.3.1 质控样本的制备
样品等量混合制备质控(quality control,QC)样本。QC样本用于测定进样前仪器状态及平衡色谱-质谱系统,监测和评价系统的稳定性及实验数据的可靠性。
1.3.2 样品预处理
在-80 ℃取出样本,4 ℃缓慢溶解后分别取各组样本100 μL,加入400 μL预冷的甲醇-乙腈(1∶1)溶液,涡旋60 s,-20 ℃放置1 h沉淀蛋白,4 ℃、14 000 r/min离心20 min,取上清液冷冻干燥,-80 ℃保存样本。
1.3.3 色谱条件
采用1290 Infinity LC UPLC系统,HILIC色谱柱(2.1 mm×100 mm,1.7 μm)对样品进行分离,柱温25 ℃,流速0.3 mL/min,流动相A由水、25 mmol/L乙酸铵及25 mmol/L氨水组成,流动相B为乙腈。梯度洗脱程序如下:0~0.5 min,5% A,95% B;0.5~7 min,5%~35% A,95%~65% B;7~8 min,35%~60% A,65%~40% B;8~9 min,60% A,40% B;9~9.1 min,60%~5% A,40%~95% B,9.1~12 min,5% A,95% B。
1.3.4 质谱条件
分别采用电喷雾离子源,正负离子模式进行检测。样本采用AB Triple TOF 6600质谱仪对代谢物进行鉴定。雾化气压1为40 psi,辅助气压2为80 psi,气帘气压力为30 psi,离子源温度为650 ℃,喷雾电压(ISV9F)为±5 000 V(正负2 种模式);二级质谱采用数据依赖型扫描(information dependent acquisition,IDA)获得,并且采用高灵敏模式,去簇电压为±60 V(正负2 种模式),碰撞电压为(35±15)eV,IDA设置如下:除排同位素4 Da,每周期要监测的候选离子:10。
1.3.5 理化指标测定
酸价的测定参照GB 5009.229—2016《食品中的酸价测定》[13],过氧化值的测定参照GB 5009.227—2016《食品中过氧化值的测定》[14]。实验均重复3 次。
1.4 数据处理
利用SPSS 22.0对指标进行差异性分析,采用Origin 2018绘制折线图。代谢数据进行完整性检查,剔除极值,总峰面积归一化,以确保各样本间和代谢物间可平行性比较。导入SIMCA-P 16.2软件,进行无监督的主成分分析(principal component analysis,PCA)、OPLS-DA,观察各样本间是否可靠、稳定。随后根据OPLS-DA结果筛选组间差异代谢物,结合T检验筛选组间显著性差异代谢物。通过http://www.genome.jp/kegg/pathway.html查找京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路。利用R语言绘制聚类热图,采用Excel 2010绘制通路占比图。
2 结果与分析
2.1 冷藏过程中原料乳酸价与过氧化值的变化
由图1可知,冷藏0~6 d原料乳氧化过程持续进行,表现为酸价、过氧化值不断升高。酸价可以代表原料乳中游离脂肪酸的总量[15]。由图1A可知,随冷藏时间的延长,原料乳酸价不断上升(0.95~1.90 mg/g),不同阶段其上升速度均有所差异,其中冷藏0~1 d酸价上升明显(0.95~1.33 mg/g),随后上升速度降低。
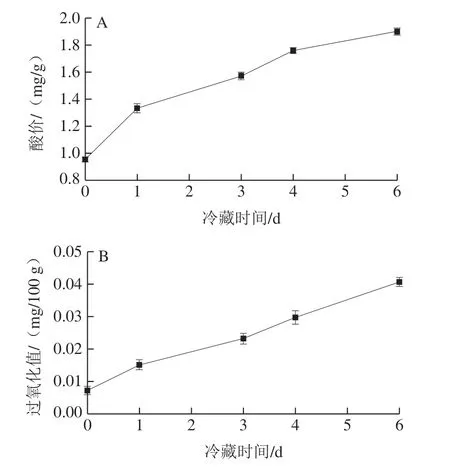
图1 冷藏过程中原料乳脂肪氧化变化Fig. 1 Evolution of lipid oxidation in raw milk during cold storage
过氧化物为脂肪氧化的初级氧化产物,其分解会产生难闻气味的低分子质量有害物质如醛、酮、醇等氧化物及氢过氧化物[16],故其值可判断脂肪氧化程度[15]。由图1B发现,原料乳过氧化值整体偏低(0.007 2~0.040 6 mg/100 g)。其中冷藏0~1 d过氧化值的增加在整个冷藏阶段最为明显,其变化趋势与酸价相似,随后过氧化值随冷藏时间延长缓慢增加。
2.2 基于UPLC-Q-TOF-MS对冷藏过程中原料乳的多元变量分析
2.2.1 样本QC分析
如图2所示,各色谱峰的响应强度和保留时间基本重叠,表明在整个实验过程中仪器误差引起的变异较小,信号较为稳定。将所有实验样本和QC样本提取得到的峰,经Pareto-scaling处理后进行PCA,其得分图见图3。所有QC样本在PCA空间紧密聚集,各实验样本之间分离效果较好,说明代谢物数据结果可靠。
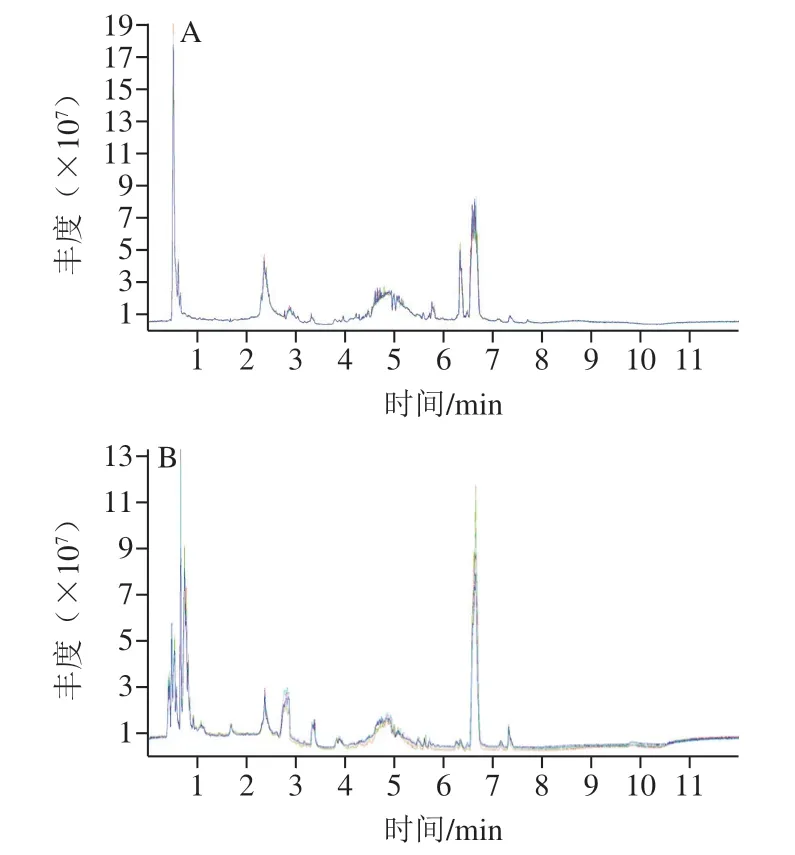
图2 QC样品正负离子模式总离子流重叠图谱Fig. 2 Overlapped total ion current chromatograms of QC samples in positive and negative ion modes
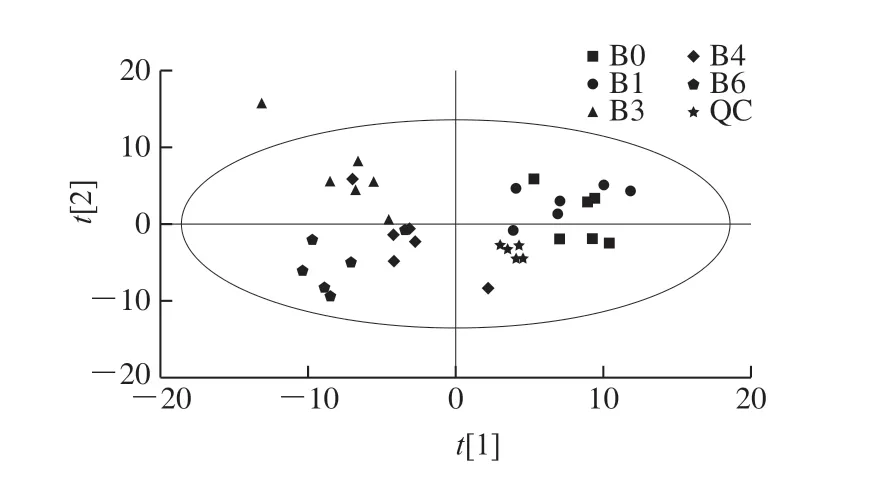
图3 QC组和实验组样本质控PCA得分图Fig. 3 PCA score plot of QC group and experimental sample quality control
2.2.2 OPLS-DA结果
为比较不同冷藏时间对比组间代谢物差异,采用多变量分析法分割有效区域,并进行OPLS-DA。如图4所示,4 组模型的R2、Q2值相对较高,且置换检验图回归线在Y轴上截距小于0,Q2的斜率均大于R2,表明该模型的稳健性可靠。在OPLS-DA得分图中分析得出各个组间分散,组内相互聚集,即不同冷藏时间对比组存在显著代谢差异。
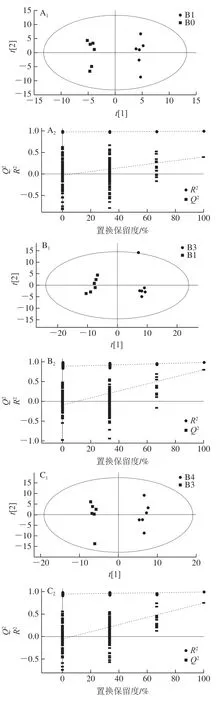
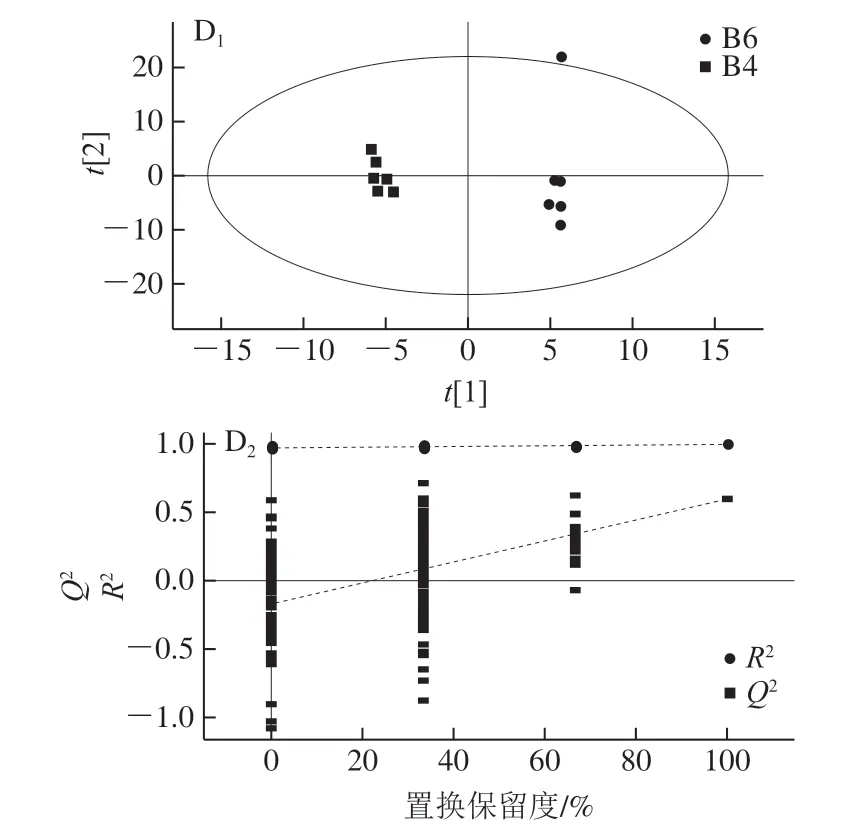
图4 负离子模式下OPLS-DA得分图及置换检验图Fig. 4 OPLS-DA score plots for differential metabolites identified in negative ion mode and permutation test plots
2.3 冷藏过程中原料乳显著性差异代谢物筛选
变量投影重要性(variable importance projection,VIP)可反映变量对样本分类判别的影响和解释能力,当VIP值大于1时,变量对组间分离有显著贡献。本实验以VIP值大于1为条件,根据OPLS-DA模型的VIP值从原料乳的正离子(9 483 个)和负离子(8 682 个)代谢物中筛选潜在差异代谢物。结合T检验,将P值小于0.05的物质作为显著性差异代谢物。由表1可知,整个冷藏过程中显著性差异代谢物数量呈先增(0~3 d)后减(4 d)再增(6 d)的趋势。各类代谢物变化较为复杂,无明显规律。其中上调代谢物数量在冷藏0~3 d无较大变化,冷藏4 d时数量明显增加,后随时间的延长数量下降。下调代谢物数量波动趋势与显著性差异代谢物数量变化一致。
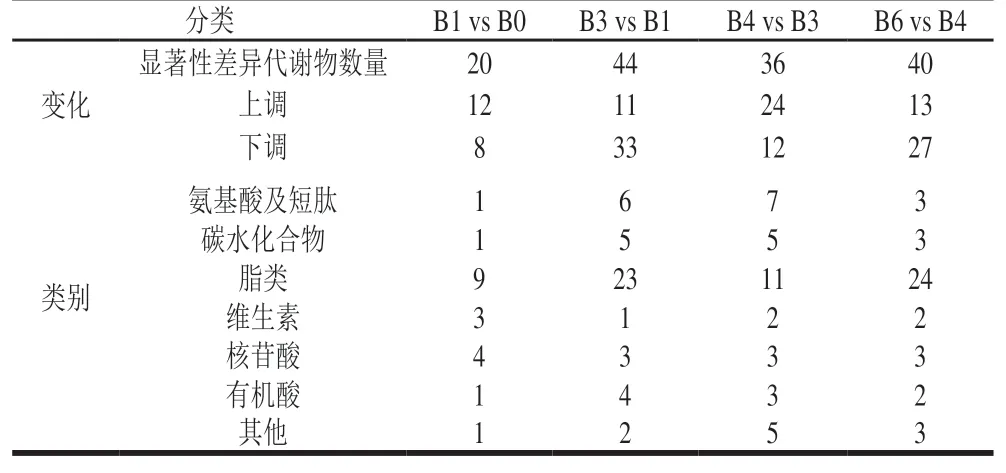
表1 显著性差异代谢物的筛选结果Table 1 Results of screening for significantly differential metabolites
1 d与0 d相比,存在20 种显著性差异代谢物 (表1),多为上调代谢物,且以脂类为主。3 d与1 d相比,筛选出44 种显著性差异代谢物,上调数明显低于下调数,其中氨基酸、碳水化合物、脂类及有机酸数量存在不同程度的增长。4 d与3 d相比,显著性差异代谢物降至36 种,上调数高于下调数,氨基酸、维生素基本上调,脂类下调。6 d与4 d相比,显著性差异代谢物有40 种,其中13 个代谢物上调,27 个代谢物下调,除脂类外,其余代谢物数量变化不大。在整个冷藏过程中脂类代谢物表现出高活跃性,相较于各类代谢物其数量始终占比最大,变化过程较为复杂。在冷藏3~4 d时脂类数量急剧下降,而冷藏6 d又恢复原有数量,可见脂类在冷藏中期会发生剧烈变化,这可能是由于原料乳本身成分复杂,脂肪氧化各阶段变化不一所导致。
2.4 冷藏过程中原料乳脂类代谢物聚类、种类变化及其通路分析
代谢组学结果显示冷藏过程中脂类物质在乳体系最为活跃(表1)。脂肪是乳的重要成分,相较于其他组分占比大(3%~5%)、消化率高(95%)[17]。乳脂类物质在冷藏过程极易被氧化分解,产生大量的自由基及过氧化物,同时在脂肪酸降解途径中会产生有害醛酮等物质,从而造成乳品风味、色泽、质地等发生改变,最终导致乳品质变质[18]。因此,探究原料乳脂类代谢物在冷藏过程中的变化情况尤为重要。
将冷藏各阶段原料乳显著性脂类差异代谢物进行可视化聚类分析,具体划分为I、II两个区域。结果见图5。I区中大部分代谢物在冷藏期内变化复杂,无明显规律,包括月桂酸、3-羟基十二酸、柠苹酸、1-棕榈酸-2-油酰磷酸甘油及二十碳五烯酸等。其中,代谢物2-乙基-2-羟基丁酸、2-甲基-3-羟基丁酸仅在冷藏6 d富集。II区显著性差异代谢物数量居多,占总量的60.5%,在冷藏0~1 d显著富集(26 种)。单亚油酸甘油酯、肉豆蔻油酸及亚油酸等代谢物在冷藏0~1 d含量最高,并随冷藏时间的延长逐渐减少。二软脂酸磷脂酰胆碱、N-棕榈酰神经鞘氨醇及鞘磷脂在冷藏3~6 d呈现大幅下降趋势。由于乳脂代谢物的种类复杂、变化多样,本研究将其分为甘油脂、游离脂肪酸及磷脂(表2)三大类进一步分析。结合脂类差异代谢物平均表达量的变化在KEGG数据库中寻找相关代谢通路。结果显示脂类显著性差异代谢物参与的代谢通路种类较多。归类后共整理出9 条涉及脂类代谢的通路(图6,KEGG第三层级)。结合代谢通路对甘油脂、游离脂肪酸及磷脂三类代谢物变化进一步分析。
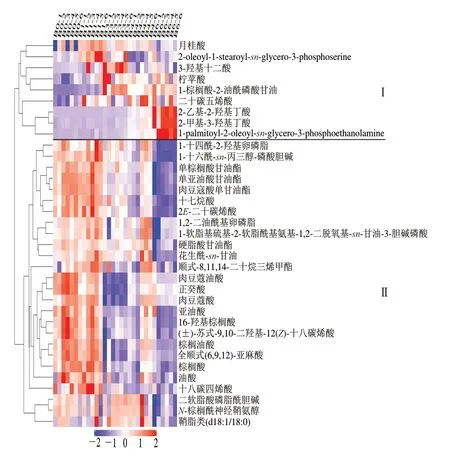
图5 冷藏过程中原料乳显著性差异脂类代谢物的聚类热图Fig. 5 Clustering heat map of significantly differential lipid metabolites in raw milk during refrigerated period
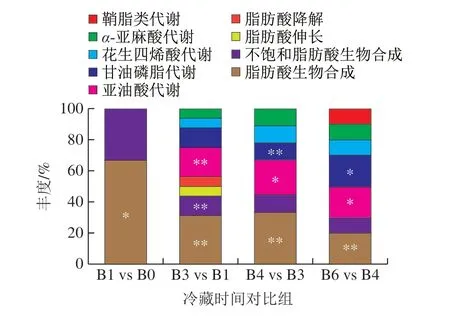
图6 显著性脂类差异代谢物在脂代谢通路中的占比Fig. 6 Percentage of significantly differential lipid metabolites in metabolic pathway

表2 冷藏阶段脂类代谢物表达量Table 2 Expression patterns of significantly differential lipid metabolites during refrigerated storage
2.4.1 甘油酯的变化
乳腺上皮细胞分泌的乳脂由甘油酯组成,以乳脂球(milk fat globule,MFG)的形式存在,被乳脂球膜(milk fat globule membrane,MFGM)的复杂三层膜包围[19]。由表2可知,参与脂类代谢的甘油酯代谢物整体上较少,共6 种。包括1-棕榈酰-2-油酰磷酸甘油酯、硬脂酸甘油酯、1-硬脂酰-2-花生酰-sn-甘油酯、单棕榈酸甘油酯、单亚油酸甘油酯及肉豆蔻酸单甘油酯。其中, 1-棕榈酰-2-油酰磷酸甘油酯表达量在冷藏0~3 d上调,而冷藏4 d开始下调,至冷藏6 d表达量变化不大;硬脂酸甘油酯在冷藏3~4 d呈现与前者相反的变化趋势,而冷藏6 d表达量又转为下调。冷藏整个阶段,1-硬脂酰-2-花生酰-sn-甘油、单棕榈酸甘油酯、单亚油酸甘油酯及单肉豆蔻酸甘油酯表达量均呈不断下调趋势。
2.4.2 游离脂肪酸的变化
乳脂中含有大量的游离脂肪酸(表2)。含量排前3位的游离脂肪酸依次为棕榈酸(C16:0)、油酸(C18:1)、肉豆蔻酸(C14:0)。该结果与Liu Zhiqian[20]、李磊[21]等所得结论基本一致。实验结果显示饱和脂肪酸、单不饱和脂肪酸及多不饱和脂肪酸占比分别约为50%、17%、33%。检测到的饱和脂肪酸为月桂酸、正癸酸、棕榈酸、16-羟基棕榈酸、肉豆蔻酸、十七烷酸、3-羟基-十二烷酸、2-甲基-3-羟基丁酸及2-乙基-2-羟基丁酸;单不饱和脂肪酸为肉豆蔻油酸、棕榈油酸及油酸;多不饱和脂肪酸为顺-6,9,12,15-十八碳四烯酸、二十碳五烯酸、亚油酸、(±)-苏式-9,10-二羟基-12(Z)-十八碳烯酸、全顺式(6,9,12)-亚麻酸及2E-二十碳烯酸。参与脂质代谢的游离脂肪酸表达量变化在各时间点均有所区别。冷藏阶段,有7 种游离脂肪酸表达量下调,即饱和脂肪酸棕榈酸、16-羟基棕榈酸及十七烷酸,单不饱和脂肪酸油酸,多不饱和脂肪酸亚油酸、(±)-苏式-9,10-二羟基-12(Z)-十八碳烯酸及2E-二十碳烯酸;5 种表达量上调,即饱和脂肪酸肉豆蔻酸、3-羟基十二烷酸、2-甲基-3-羟基丁酸及2-乙基-2-羟基丁酸,多不饱和脂肪酸二十碳五烯酸。6 种游离脂肪酸在冷藏阶段呈现较强的波动性,无明显规律,即月桂酸、正癸酸、肉豆蔻油酸、棕榈油酸、顺-6,9,12,15-十八碳四烯酸及全顺式(6,9,12)-亚麻酸。整个冷藏过程中,各类游离脂肪酸变化过程多集中在冷藏3~4 d,且多数呈下调。可见冷藏3~4 d这一阶段是原料乳各类游离脂肪酸代谢物变化的关键时间点。
冷藏3 d时脂类代谢通路数量达到高峰(图6),其原因是该阶段各类游离脂肪酸数量及表达量的明显变化所导致。其中脂肪酸生物合成、不饱和脂肪酸生物合成、亚油酸代谢通路均表达极显著(P<0.01),参与其通路的最活跃代谢物为棕榈酸。冷藏4 d时棕榈酸表达量无明显变化,从而导致脂类代谢通路数量整体减少。
2.4.3 磷脂的变化
磷脂约占原料乳脂的1%,其作为MFGM的主要组成成分维持着乳脂的物理稳定性[22]。一般将磷脂分为甘油磷脂(glycerophospholipid,GP)和鞘脂(sphingolipid,SP)两大类[23-25]。由表2可知,GP有磷脂酰胆碱(glycerophosphatidylcholine,PC)及磷脂酰乙醇胺(glycerophosphatidylethanolamine,PE)2 种亚类,PC包含1-十六酰-sn-丙三醇-磷酸胆碱、1,2-二油酰基卵磷脂、2-oleoyl-1-stearoyl-sn-glycero-3-phosphoserine、 1-软脂基硫基-2-软脂酰基氨基-1,2-二脱氧基-sn-甘油-3-胆碱磷酸、二软脂酸磷脂酰胆碱、磷酰胆碱及1-十四酰-2-羟基卵磷脂8 种显著性差异代谢物。PE含有1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoethanolamine、1-棕榈-sn-甘油-3-磷酰乙醇胺2 种显著性差异代谢物。SP有神经酰胺和鞘磷脂2 种亚类。神经酰胺含有N-棕榈酰神经鞘氨醇1 种代谢物。鞘磷脂含有鞘磷脂(d18:1/18:0)1 种代谢物。整个冷藏阶段,4 种GP代谢物表达量变化并无明显规律,1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoethanolamine表达量上调,其余磷脂代谢物 (7 种)均呈现下调。整体观察发现,近一半的磷脂代谢物在冷藏0~4 d表达量无明显变化,而冷藏6 d开始大幅下调,其原因有待后续进一步探究。
冷藏3~6 d均具有与磷脂相关的代谢通路(图6),且冷藏3~4 d二软脂酸磷脂酰胆碱表现活跃,参与多种脂质代谢,如亚油酸代谢、不饱和脂肪酸代谢、甘油磷脂代谢、花生四烯酸代谢及α-亚麻酸代谢。冷藏6 d鞘磷脂(d18:1/18:0)表达量显著上调,使鞘脂类代谢较活跃。
3 讨 论
通常,原料乳挤出后会立即冷却并进行4 ℃冷藏。即便如此,低温仍会损坏原料乳的结构,无法完全避免脂肪氧化、酶促反应及微生物降解等反应。通过分泌上皮细胞、乳腺自身合成等途径产生的内源酶及贮存过程中嗜冷微生物产生的外源酶等在低温下仍会分解、代谢原料乳中的营养物质,使原料乳成分改变,导致其最终腐败。
冷藏过程中,乳体系代谢复杂,无明显规律。显著性差异代谢物结果显示,整个代谢过程中脂类代谢占主导地位,该结论与Tribst等[2]研究结果一致。大量报道显示,微生物特别是嗜冷微生物冷藏过程中的生长是导致乳及乳制品品质劣变的主要原因。假单胞菌、不动杆菌、黄杆菌及沙雷氏菌等[26-27]会产生稳定性较高的蛋白酶,其作用于MFG的保护膜,导致MFGM破裂,从而释放出膜内包裹的脂肪。嗜冷微生物产生的脂肪酶及内源性酯酶会共同分解MFG中释放的脂类物质,随时间变化的脂类代谢物不断改变,最终造成原料乳产生酸败味、苦肽等异味,并导致乳中营养成分的劣变[28]。
聚类热图及脂类代谢物表达量分析显示大部分脂类代谢物在冷藏0~1 d时表达量无明显变化,而变化多集中在冷藏3~6 d,尤其是冷藏6 d。将脂肪氧化指标与各类脂类代谢物表达量变化结合分析,发现虽然二者冷藏阶段均具有较大的转变,但是脂肪氧化速度降低时(冷藏1~3 d)大部分逐渐积累的脂类代谢物表达量却下调,可见乳脂氧化并不是影响脂类代谢物变化的关键因素,受复杂乳成分及乳环境的影响,乳脂肪氧化反应并不会同步推动脂类物质变化,乳中脂类代谢物的变化是脂肪氧化分解与脂质合成共同作用的结果。
在3 类显著性脂类差异代谢物中,游离脂肪酸、磷脂变化尤为突出。其中大部分游离脂肪酸进入冷藏中期(3 d)表达量下调,且随冷藏时间的延长含量逐渐减少。KEGG通路分析显示,该阶段新增游离脂肪酸表现活跃且主要参与了脂肪酸生物合成、不饱和脂肪酸生物合成及亚油酸代谢。这种现象可能与3 d后假单胞菌成为原料乳优势菌属相关[1]。研究表明,假单胞菌位于编码lipA基因胞外脂肪酶的多顺反子操纵子起始位置的 aprx基因[29-30],其表达的脂肪酶可能作用于甘油三酯的α部位[31],将乳中游离脂肪酸代谢水解为小分子物质。然而游离脂肪酸中2-乙基-2-羟基丁酸、2-甲基-3-羟基丁酸含量变化较为特殊,即冷藏4~6 d上调且含量随冷藏时间延长成倍增加,其变化可能与脂肪酶选择性地释放丁酸有关[32]。关于磷脂变化,本研究发现SP及部分GP在原料乳冷藏6 d下调。KEGG通路分析显示冷藏6 d时新增了一条与磷脂代谢相关的通路。前期在乳内源酶黄嘌呤氧化酶、过氧化物酶及碱性磷酸酶的作用下MFGM被分解,此阶段(冷藏6 d)作为MFGM的重要组成成分的磷脂类物质与乳体系中其他物质发生反应[33-34],导致磷脂含量降低。同时此时的荧光假单胞菌所产生的磷脂酶C对磷脂的水解程度达到最大化[35-36],且磷脂酶C与脂肪酶协同作用加快了磷脂的脂解速度[37]。
脂类代谢物的变化会使乳品质发生转变,而导致脂类代谢物转变的各类因素同样影响乳组织及风味。冷藏3 d假单胞菌与脂肪酶作用使乳黏度逐渐增强,蛋白酶溶解乳中部分酪蛋白,导致胶束稳定性破坏、苦肽形成及氨基酸分解,最终乳组织出现乳清蛋白沉淀、凝块等现象并产生苦味物质[38-39]。同时各类嗜冷菌生成的脂酶会共同攻击乳中MFG,使球状甘油三酯暴露,导致乳表面出现絮状物。而磷脂酶的水解产物会产生类油气味的烷烃、烷-2-烯醛和烷-2,4-二烯醛[40]。综上,内源酶、嗜冷微生物及其酶类作用可能是冷藏3~6 d游离脂肪酸、磷脂表达量剧烈变化的主要因素,最终导致乳品风味、质地、组织趋于劣变状态。因此冷藏3 d可作为原料乳冷藏品质控制的关键节点。
