云南牟定酸浆水中优势产酸菌的分离 鉴定及生长特性
2021-11-05张宸瑞薛桥丽白彬阳胡永金
张宸瑞,薛桥丽,白彬阳,胡永金,
(1.云南农业大学食品科学技术学院,云南 昆明 650201;2.云南农业大学学报编辑部,云南 昆明 650201)
腐乳作为我国特有的大豆发酵食品,其风味醇厚、浓香,口感滑润、细腻,营养丰富[1]。云南牟定县地理环境优越,气候适宜,从明末清初时期生产腐乳,随着生产工艺不断精进,其口感、风味不断丰富,如今牟定腐乳远近闻名,成为云南腐乳的代表[2]。
牟定腐乳的独到生产工艺为酸浆水点浆,酸浆水是豆腐压制过程中渗出的黄浆水经乳酸菌、醋酸菌、酵母菌等微生物[3-4]发酵形成。自然环境中的微生物接触黄浆水后,以黄浆水中的蛋白碎片、纤维碎片、多糖等大量营养物质作为营养源,通过酶解代谢产生大量醋酸、乳酸、草酸等几十种有机酸,因此溶液整体酸价下降[5-6]成为豆腐点浆的酸浆水。酸浆水作为天然凝固剂不仅避免引入无机金属离子,还赋予腐乳独特风味,最大限度地开发黄浆水的应用效率,极大地减少黄浆水排放造成的环境污染[7-8]。但由于自然引入的微生物群落结构复杂,含有益菌的同时也掺杂有害微生物,导致产品存在安全隐患[9]。自然发酵的酸浆水受外界环境因素影响较大,难以保证每个批次的稳定品质,因此从自然发酵的酸浆水中分离优势菌群,分析菌群的生长特性以筛选生长繁殖快、产酸能力强的菌株,采用分离筛选的纯种菌发酵黄浆水即可解决上述问题。
目前,国内外对酸浆水中微生物的研究主要集中于筛选鉴定优势乳酸菌、分析生长特性及测定代谢 产物[10-11],对酸浆水中的其他高产酸菌株及其特性研究鲜见报道。因此,本实验分离、筛选、鉴定云南牟定2 家腐乳生产公司自然发酵酸浆水中的高产酸菌株,并通过生长特性研究明确不同高产酸菌株的生长条件及产酸性能,从中筛选生长迅速、产酸能力强的菌株,以期为综合利用高产酸菌发酵生产提供具有潜在应用价值的菌株。
1 材料与方法
1.1 材料与试剂
酸浆水样品 云南牟定两家腐乳生产公司(A、B公司);改良MRS固体培养基、MRS液体培养基 上海抚生实业有限公司;增强革兰氏染色液 北京雷根生物有限公司;新型生化鉴定管 广东环凯微生物科技有限公司; 无水碳酸钙、盐酸、氯化钠(均为分析纯) 天津市天力化学试剂有限公司;纳他霉素(食品级) 浙江新银象生物工程有限公司。
1.2 仪器与设备
BCM-1000A超净工作台 苏州安泰技术有限公司; Eppendorf移液枪 南京贝登医疗股份有限公司;9053A烘箱 上海实研电炉有限公司;HHPX-9272ME恒温培养箱 上海博讯实业有限公司;Nikon E200-F显微镜 南京新飞达光学仪器公司;LX-B高压蒸汽灭菌锅 北京市永光明医疗仪器有限公司;TF-B60超低温冰箱 上海赛默飞世尔科技公司;pH-10 pH计 广州市铭睿电子科技有限公司;725N分光光度计 南京晓晓仪器设备有限公司。
1.3 方法
1.3.1 产酸菌的分离
采用平板涂布法,将稀释后的酸浆水样品涂布于添加质量分数0.1%纳他霉素、质量分数2.0%碳酸钙的MRS分离培养基上[12],37 ℃恒温倒置培养24 h,挑取有溶钙圈的单菌落纯化3 代,转接于斜面4 ℃保存。
1.3.2 高产酸菌的筛选
挑取保存菌株接种于MRS液体培养基中,37 ℃恒温培养48 h,以总酸含量为指标,产酸量高于20 g/L的菌株为高产酸菌株。总酸测定参考王嘉琪等[13]的方法,以乳酸计,按下式计算待测液产酸量:
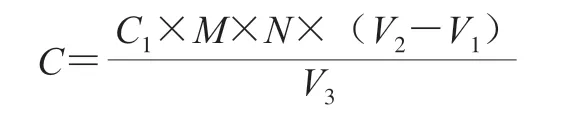
式中:C为待测液产酸量/(g/L);C1为标定的氢氧化钠浓度/(mol/L);M为乳酸摩尔质量/(g/mol); N为稀释倍数(10);V1为样品待测液消耗氢氧化钠溶液体积/mL;V2为空白待测液消耗氢氧化钠溶液体积/mL;V3为样品待测液体积/mL。
1.3.3 高产酸菌株的形态观察和生理生化鉴定
用革兰氏染色法对菌株进行形态学观察[14]。将菌株制成菌悬液接入生理生化鉴定管中,37 ℃恒温培养24 h后观察记录颜色变化,根据《常见细菌系统鉴定手册》[15]进行判定。
1.3.4 菌株分子生物学鉴定
将菌株送至北京擎科生物科技有限公司,进行DNA提取、聚合酶链式反应(polymerase chain reaction,PCR)扩增及16S rDNA测序。
将获得的测序结果提交NCBI的GenBank数据库通过BLAST进行比对,确定种属及亲缘关系并进行ITS同源性分析,选取同源性高的菌株16S rDNA基因序列,采用MEGA 7.0构建发育树。
1.3.5 自然发酵酸浆水及高产酸菌株的活化
将低温保藏不同产地的的酸浆水样品按体积分数3%接入MRS肉汤培养基中37 ℃恒温发酵24 h,连续培养2 代,获得活化酸浆水发酵液,将A公司活化酸浆水命名为Y,B公司活化酸浆水命名为X。用接种环挑取试管斜面保藏高产酸菌株分别接入MRS肉汤培养基中37 ℃恒温发酵24 h,取3%发酵24 h的纯菌种发酵液接入MRS肉汤培养基中,37 ℃恒温发酵24 h,连续培养2 代以获得活化高产酸菌发酵液。
1.3.6 生长曲线测定
取活化后的酸浆水发酵液、纯菌种发酵液均按体积分数3%分别接入MRS液体培养基中,37 ℃恒温发酵48 h,每隔4 h取发酵液,以灭菌后的MRS液体培养基为空白对照,采用分光光度计测定发酵液OD600nm值,重复测定3 次[16]。
1.3.7 产酸能力测定
取活化后的酸浆水发酵液、纯菌种发酵液均按体积分数3%分别接入MRS液体培养基中,37 ℃恒温发酵48 h,每隔4 h取发酵液作为待测液,测定总酸量及pH值,pH值用pH计测定,总酸测定同1.3.2节方法。
1.3.8 高产酸菌耐酸能力测定
取活化后的自然发酵酸浆水和纯菌种发酵液,按3%接种量分别接入初始pH值为1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0的液体MRS培养基中,37 ℃恒温培养24 h测定OD600nm值,重复测定3 次。
1.3.9 耐渗透压能力测定
取活化后的酸浆水发酵液和纯菌种发酵液,按体积分数3%分别接入NaCl质量浓度为0、2、4、6、8、10、12、14 g/100 mL的MRS肉汤培养基中,37 ℃恒温培养24 h测定OD600nm值,重复测定3 次。
1.4 数据分析
采用SPSS 18.0进行数据分析、Origin 9.0进行绘图,MEGA 7.0进行同源性分析及建立系统发育树。
2 结果与分析
2.1 牟定腐乳酸浆水中产酸菌的筛选与鉴定
2.1.1 产酸菌的初筛
由于产酸菌代谢产生的乳酸与培养基环境中的不溶性碳酸钙发生化学反应形成溶解度较大的乳酸[17],产生肉眼可见的透明溶钙圈,因此选取产生溶钙圈效果明显的菌落于MRS固体培养基上反复划线并分离、纯化,获得80 株产酸特征明显的单菌落并进行4 ℃试管斜面保存。
2.1.2 高产酸菌的复筛
将80 株产酸菌进行产酸性能测定,分离自云南牟定A公司酸浆水中的10 株菌产酸量均高于20 g/L,分离自云南牟定B公司酸浆水中的8 株菌产酸量均高于20 g/L。
2.1.3 菌株的初步鉴定
对18 株高产酸菌进行形态学观察,获得10 株不同菌群特征、菌体特征的的革兰氏阳性菌,对云南牟定A公司酸浆水中分离获得的高产酸菌株重新编号为YQZ1~YQZ5,将活化酸浆水内自然菌群Y、YQZ1~YQZ5统称为Y组,对云南牟定B公司酸浆水中分离获得的高产酸菌株重新编号为QJZ1~QJZ5,将活化酸浆水内自然菌群X、XJZ1~XJZ5统称为X组。
参阅《乳酸细菌分类鉴定及实验方法》[18]、《伯杰细菌鉴定手册》[19],根据生化鉴定结果比对《常见细菌系统鉴定手册》[15]确定菌株YQZ1、YQZ3、XJZ2、XJZ3、XJZ5为乳杆菌属(Lactobacillus),菌株YQZ4、XJZ1、XJZ4为肠球菌属(Enterococcus),菌株YQZ2为乳球菌属(Lactococcus),菌株YQZ5为微杆菌属(Microbacterium)。
2.1.4 菌株分子生物学鉴定及发育树建立
2.1.4.1 菌株基因序列测定
以10 株菌的DNA为模板,以27F、1492R为引物进行PCR扩增,产物进行1%尿蛋白普通琼脂糖凝胶电泳,16S rDNA PCR电泳结果如图1所示,10 菌株16S rDNA序列长度在1 500 bp有较清晰、明亮的特异性条带,可进行基因序列测定[20]。
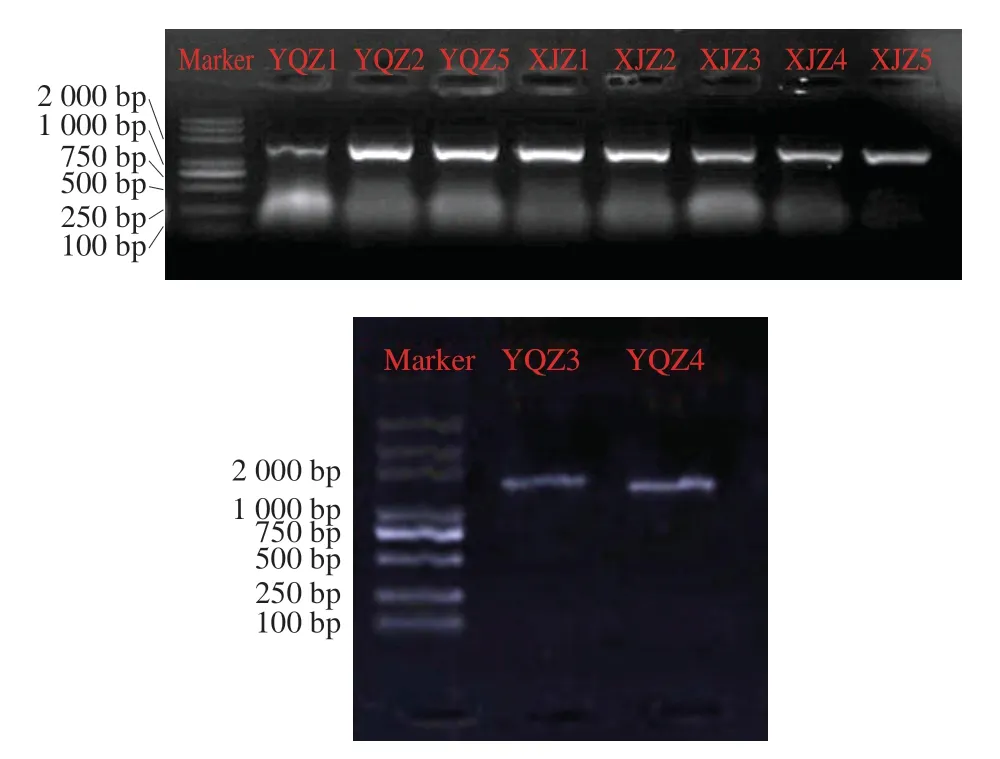
图1 10 株菌株16S rDNA PCR扩增电泳图Fig. 1 Electrophoresis of the PCR amplified products of 16S rDNA gene from 10 strains
2.1.4.2 菌株同源性分析及发育树建立
将10 株产酸菌株测定结果录入NCBI的BLAST程序上同源性分析比对,结果如表1所示。根据形态学分析、生理生化测定结果,结合同源性比对,确立菌株YQZ1~YQZ5分别为发酵乳杆菌(L. fermentum)、棉子糖乳球菌(L. raffinolactis)、植物乳杆菌 (L. plantarum)、铅黄肠球菌(E. casseliflavus)、氧化微杆菌(M. oxydans),菌株XJZ1~XJZ5分别屎肠球菌(E. faecium)、L. plantarum、副干酪乳杆菌 (L. paracasei)、海氏肠球菌(E. hirae)、L. paracasei。10 株菌中乳酸菌有6 株、肠球菌有3 株、微杆菌有1 株,可确定乳酸菌为酸浆水中主要菌群。根据同源性比对结果,采用Clustalx裁剪基因序列,采用MAGE7.0对修剪后的基因序列建立发育树,10 株菌系统进化树如图2、3所示。
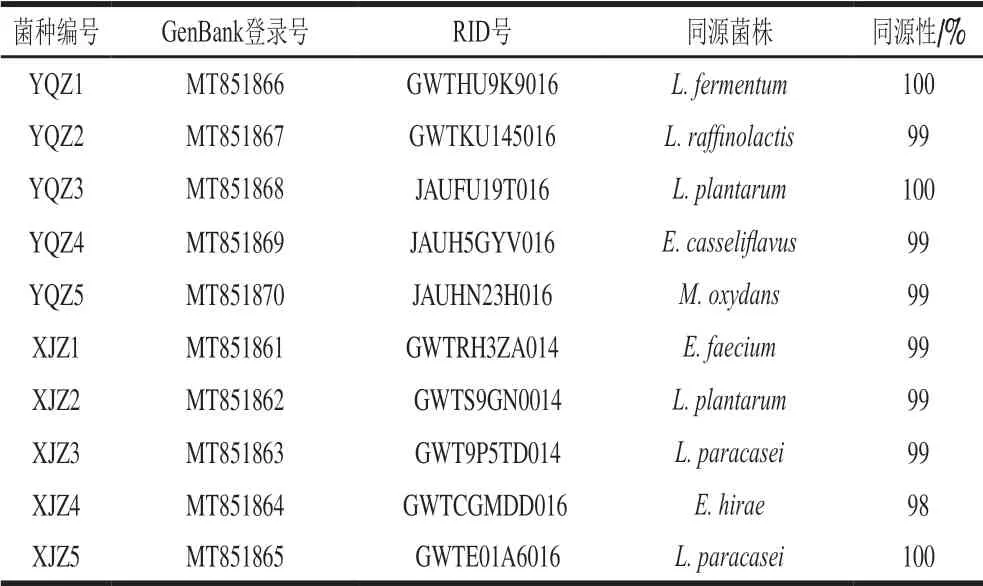
表1 10 株菌株同源性分析Table 1 Homology analysis of 10 strains
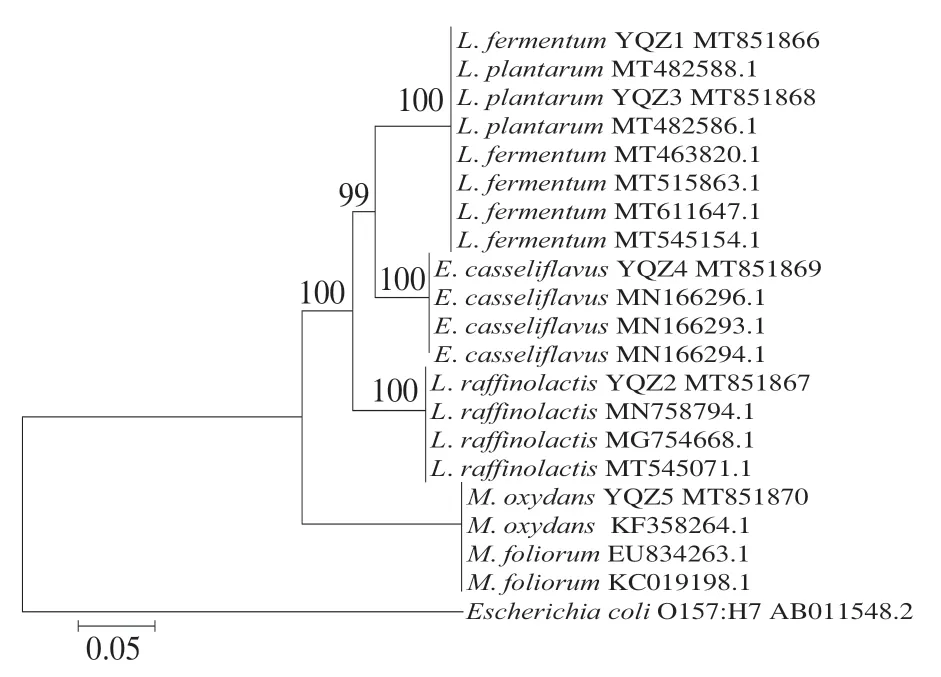
图2 YQZ1~YQZ5菌株系统进化树Fig. 2 Phylogenetic tree of strains YQZ1-YQZ5
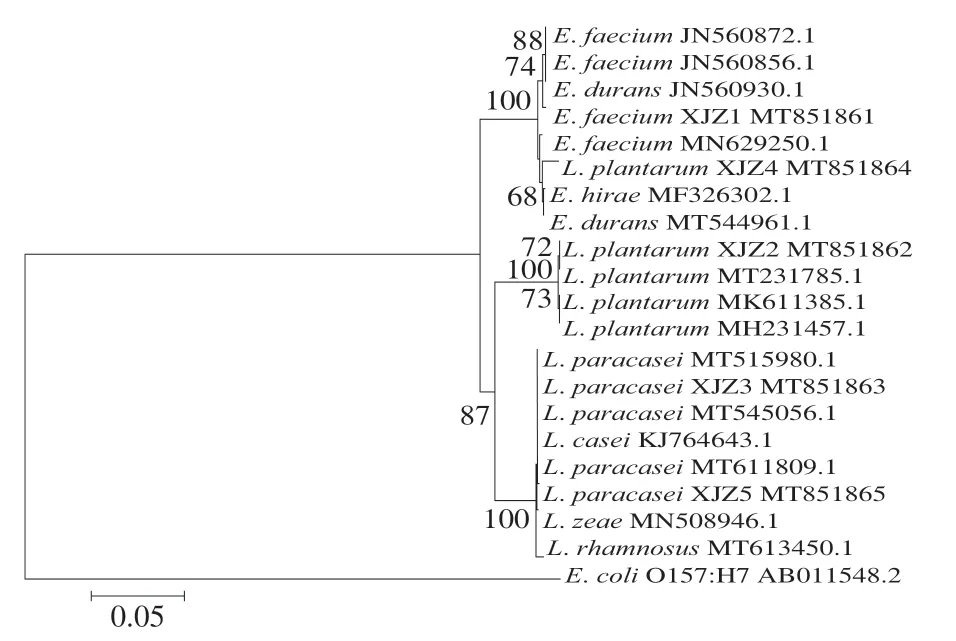
图3 XJZ1~XJZ5菌株系统进化树Fig. 3 Phylogenetic tree of strains XJZ1-XJZ5
2.2 产酸菌的生长特性分析
2.2.1 产酸菌生长曲线分析
如图4所示,不同产地酸浆水中的自然菌群在不同生长周期内相较于大部分单菌株有一定生长优势。自然菌群Y、X在短时间能迅速进入生长对数期,且对数生长期的生长速率明显高于大多数菌株,说明自然菌群具有较强的适应能力和较高的繁殖速率。自然菌群Y、X在8 h后进入生长稳定期,且整个生长稳定期均保持较高菌体浓度(OD600nm),其浓度基本稳定在2.2,未出现较大幅度的波动,说明自然菌群具有较强的繁殖能力,且种间不具有多重竞争关系。Y组包含的自然菌群Y、菌株YQZ3在0~8 h呈对数生长,菌株YQZ1、YQZ4在0~16 h呈对数生长,菌株YQZ2在0~24 h呈对数生长,YQZ2较其他菌株的对数生长周期较长,且生长速率较缓。相同培养时间内,菌株YQZ1生长速率仅次于Y、YQZ3,但繁殖能力最强,48 h时菌体浓度为2.26,自然菌群Y次之,YQZ2菌体浓度最低。X组包含的菌株XJZ2、XJZ4、自然菌群X在0~8 h呈对数生长,菌株XJZ5在0~12 h呈对数生长,菌株XJZ1、XJZ3在0~16 h呈对数生长。相同培养时间内菌株XJZ2生长速率最快、活菌数目最高,48 h菌体浓度2.44,自然菌群X次之,XJZ4最低,因此菌株YQZ1、XJZ2均有非常理想的生长繁殖能力。
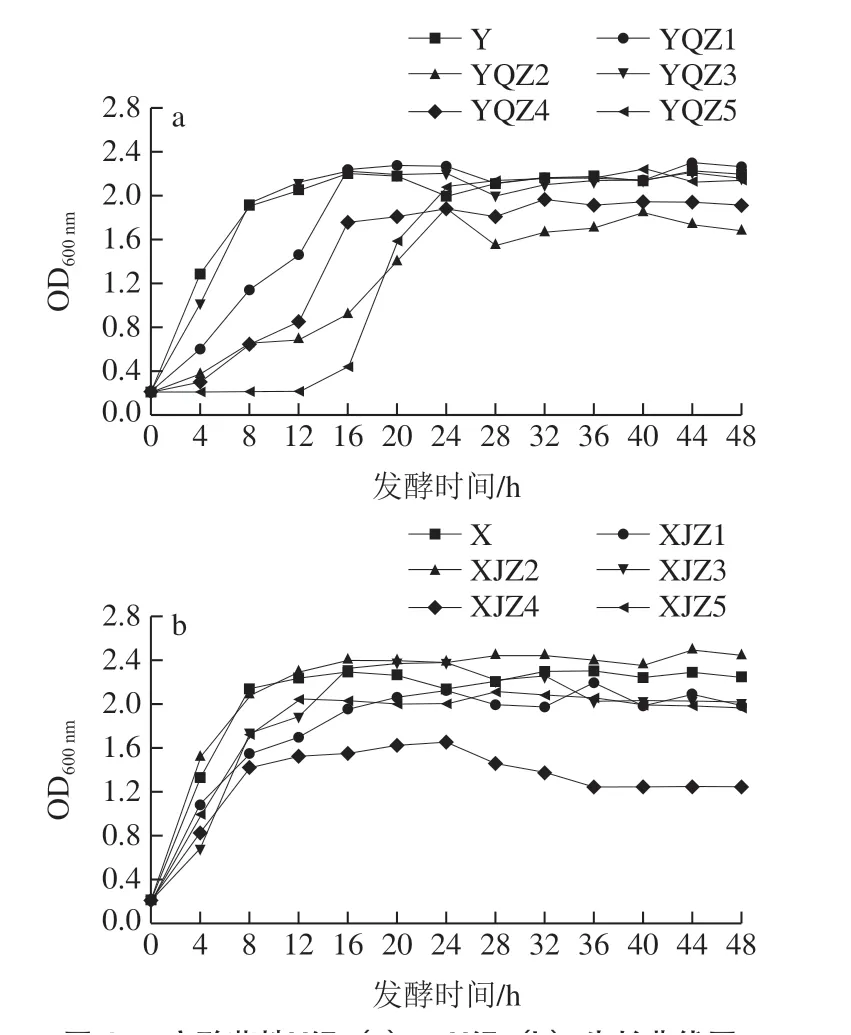
图4 产酸菌株Y组(a)、X组(b)生长曲线图Fig. 4 Growth curves of acid-producing strains from group Y (a) and group X (b)
2.2.2 菌株产酸性能分析
由图5可知,菌群、菌株的产酸速率与生长趋势呈正相关,即生长速度越快,产酸速率越快,尤其是处于生长对数期的菌株,能快速吸收培养基中的原营养物质和分解后的次级营养物质以代谢产酸,短时间内有机酸的累积量迅速增加。处于生长稳定期的菌株出生率和死亡率已逐渐达到平衡,营养物质的消耗率和代谢率基本稳定,该阶段产酸速率较对数生长期的产酸率缓慢,但酸累积量稳步上升,于第48小时达到最高点。自然菌群Y、X在0~16 h代谢产酸速率高,多种微生物能够在初始营养环境中最大限度地吸收各种营养满足自身生长,不同菌株之间可能存在一定互生关系,更利于彼此生长代谢,进一步提高产酸速率。自然菌群Y、X的乳酸积累量分别在28~48、20~32 h出现下降,其原因可能为以有机酸为次生碳源的菌群在该阶段生长活跃,有机酸分解代谢率高于产酸率,导致酸累积量下降,因此自然菌群中的乳酸累积并不稳定。从Y组可知,0~48 h内YQZ1的酸累积量最多,但在24~40 h产酸量大幅度下降后回升的原因可能为乳酸、乙酸、酒石酸代谢转化为其他小分子产物,随后又继续累积,有机酸累积量最高,最终产酸量为43.61 g/L。菌株YQZ4产酸速率较低,且产酸量最少,最终产酸量为25.21 g/L。由X组可知,自然菌群X的产酸量在20~36 h先下降后回升,其他菌株菌基本保持较为稳定的递增趋势,XJZ2产酸速率最快,有机酸累积量最多,最终产酸量为50.91 g/L,菌株XJZ1的最终产酸量仅次于XJZ2,最终产酸量为49.93 g/L,菌株XJZ4产酸速率最慢,最终产酸量为34.68 g/L。从图6可知,菌群的pH值在发酵初期随着有机酸的快速累积,氢离子浓度的迅速升高而快速降低,随之缓慢降低直至趋于平稳,Y组的自然菌Y、菌株YQZ1、YQZ2、YQZ3、YQZ4、YQZ5的最终pH值为3.98、3.75、3.84、4.01、3.98、4.02。X组的自然菌群X、菌株XJZ1、XJZ2、XJZ3、XJZ4、XJZ5的最终pH值为3.79、3.54、3.48、3.53、3.98、3.49。由图5、6可知,随YQZ1、XJZ2的产酸能力明显高于其他菌株。
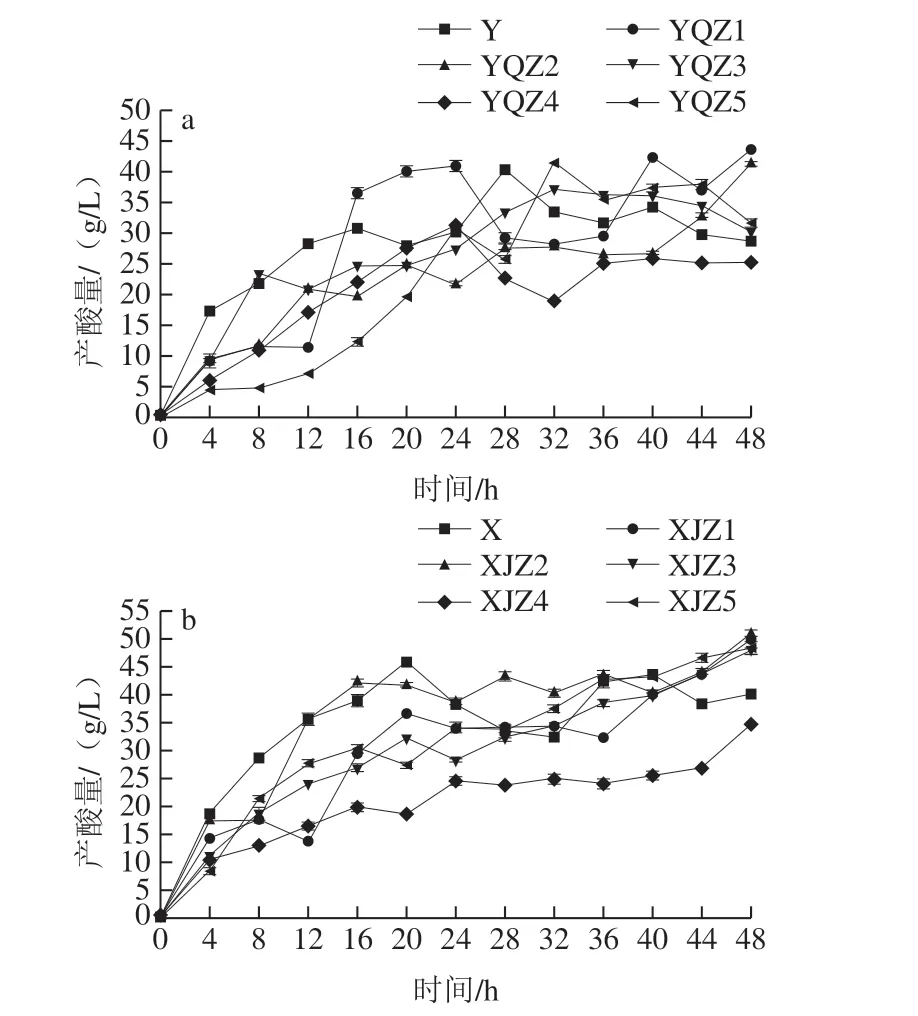
图5 产酸菌株Y组(a)、X组(b)的产酸量Fig. 5 Acid-producing capacity of acid-producing strains from group Y (a) and group X (b)
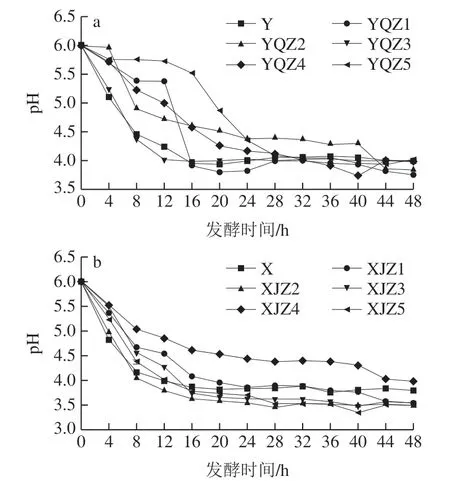
图6 产酸菌株Y组(a)、X组(b)的pH值变化趋势Fig. 6 pH trends of acid-producing strains from group Y (a) and group X (b)
产酸能力是衡量产酸菌发酵活力的重要指标,决定着发酵周期的长短。发酵过程产生的有机酸不仅抑制部分有害微生物的生长繁殖[21],而且对酸浆风味形成及酸浆豆腐的品质和风味均有重要影响[22]。仅X组菌株XJZ2产酸量高于50 g/L。Y组菌株YQZ1、YQZ2和X组菌株XJZ3的产酸量在40~50 g/L之间。Y、X组产酸量平均值为34.46、46.41 g/L,均高于叶青[23]优化后的最高产酸量34.25 g/L,2 组菌株从整体上表现较强的产酸能力,具有深入研究价值。
2.2.3 产酸菌耐酸性能分析
采用一定酸度的酸浆水点浆是大豆蛋白是否能够酸凝、豆腐压榨成型后能否保持一定品质的关键,因此产酸菌应该具有一定耐酸能力以保证酸浆酸度达到点浆要求及后续工艺顺利进行。
如图7所示,随pH值下降,菌体浓度呈现不同幅度的降低,相同pH值表现不同的耐受能力。自然菌群在pH 3.5~4.5的最佳点浆酸度范围内[24-25],相较于其他菌株表现较为脆弱的生长趋势,自然菌群Y、X的活菌数下降幅度明显,其原因可能为自然菌群中的大部分耐酸能力较差的菌群随酸度下降的生长受到明显抑制,因此整体体现较差的耐酸性。从Y组可知,菌株YQZ3、YQZ5的耐酸性最强,pH 2.5的菌体浓度仍保持在1.64、1.39的较高水平。菌株YQZ1在pH 4.0时生长状况保持良好,培养24 h后,菌体浓度为1.47。当pH值降至3.0时,YQZ1、YQZ2、YQZ4菌体浓度下降明显,pH值低于2.5则几乎不生长,其原因可能为pH值过低,环境中的氢离子浓度过高,菌株无法维持细胞内的电荷平衡,导致生长受到抑制,甚至死亡。从X组可知,pH值降至3.5前,XJZ2菌株耐酸能力始终高于其他菌株,pH 3.5时仍能保持最高繁殖能力,XJZ4菌株耐酸性最差,当pH值降至4.0时,菌体浓度仅为0.31。因此菌株YQZ1、YQZ3、YQZ5、XJZ2具有较好的耐酸能力。
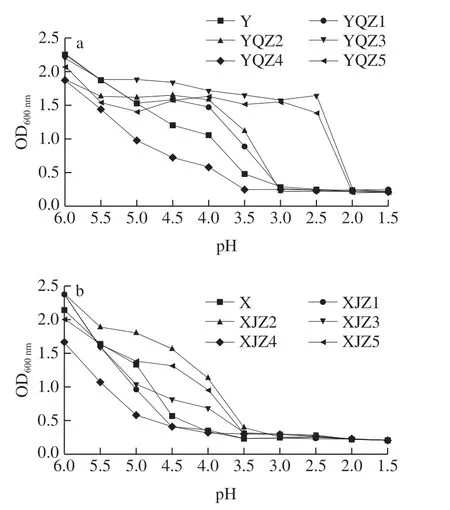
图7 产酸菌株Y组(a)、X组(b)的耐酸性Fig. 7 Acid tolerance of acid-producing strains from group Y (a) and group X (b)
2.2.4 产酸菌耐渗透压能力分析
微生物的生长繁殖需理想的渗透压境条件,渗透压过大会抑制微生物的生长繁殖,甚至脱水衰竭[26-27]。产酸菌株的耐盐性结果如图8所示。自然菌群虽具有一定丰度,各类微生物参与整个代谢环境,但随着盐质量浓度的增加,并未体现理想的耐受性和生存能力,NaCl质量浓度由0 g/100 mL增至4 g/100 mL时,活菌数大幅度下降,8 g/100 mL NaCl的菌落基本停止生长,其活菌数远小于不含NaCl培养基内的活菌数。由Y组可知,菌株YQZ2、YQZ3耐受性最弱,4 g/100 mL NaCl或6 g/100 mL NaCl条件下,菌落的生命活动受到明显抑制;NaCl质量浓度大于6 g/100 mL时,菌落无法生长而死亡。4 g/100 mL NaCl条件下菌株YQZ4生长良好,活菌数最高,培养24 h时,其OD600nm为1.53,当NaCl质量浓度大于4 g/100 mL时,生长受到明显抑制,但在NaCl质量浓度为10 g/100 mL时仍能存活。X组菌株整体耐盐性较差,菌株XJZ3、XJZ5对盐的耐受性最差,4 g/100 mL NaCl条件下基本不生长。菌株XJZ2在NaCl质量浓度由4 g/100 mL增至8 g/100 mL时表现理想的耐盐性,活菌数下降幅度小,8 g/100 mL NaCl条件下仍能够存活。因此菌株YQZ4具有非常理想的耐盐性。
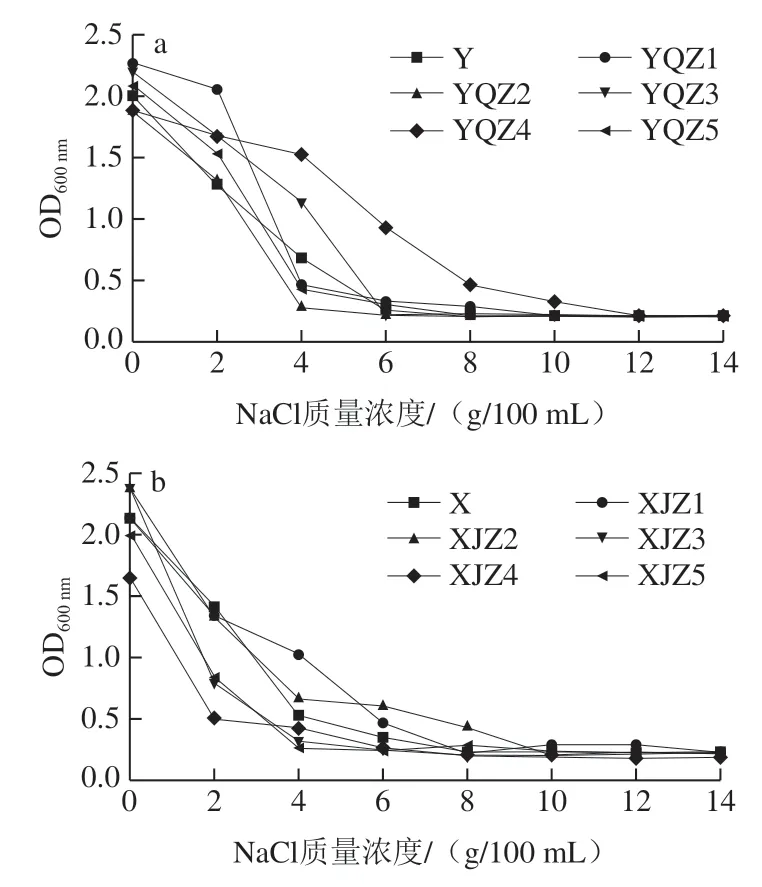
图8 产酸菌株Y组(a)、X组(b)的耐盐性Fig. 8 Salt tolerance of acid-producing strains from group Y (a) and group X (b)
3 讨 论
乳酸菌是有重要生理功能的益生菌,广泛分布于乳制品、腌制肉类、泡菜酱菜等各类发酵食品中,乳酸菌发酵不仅能够产生酸乳酸、甲酸、乙酸、γ-氨基丁酸等赋予食物独特的风味,而且大部分还能产生乳酸菌素,抑制甚至杀死许多导致食物腐败、变质的致病菌,不影响食物的品质风味,且延长食物的贮藏保鲜期[28-29]。目前国内外对酸浆水中的优势乳酸菌已有诸多研究[4,30-33]。Qiao Zhihong等[4]通过研究酸浆水中的不同有机酸含量得出乳酸菌为酸浆水中优势菌群的结论。Xu Yunhe等[30]通过高通量测序及研究大豆蛋白凝固机理,获得1 株凝乳能力强、产酸量大的干酪乳杆菌YQ336。Fei Yongtao等[31]优化酸水中分离获得菌株的发酵条件,获得酸度值为110 °T的淀粉乳杆菌L6。本研究经分离筛选鉴定、生长特性研究获得产酸量高达50.91 g/L的菌株XJZ2,是佟梓沂等[32]从酸浆水中分离得到的植物乳杆菌培养48 h产酸量40.80 g/L的1.25 倍。分离获得产酸量高达43.61 g/L的菌株YQZ1,其产酸性能强于贺云[33]从酸浆水分离得到的发酵乳杆菌。菌株XJZ2、YQZ1均有理想的产酸能力,均能大幅缩短酸浆水发酵周期、提高经济效益、发挥潜在应用价值。
肠球菌常见于乳制品、发酵肉制品、肠道内及粪便中,酸浆水中鲜见报道[34-36]。M. oxydans多从土壤中分离获得[37],酸浆水中未有报道。本研究从酸浆水中分离到3 株高产酸肠球菌,1 株微杆菌。菌株XJZ1(E. faecium)产酸量49.90 g/L,耐酸性较理想的菌株YQZ5(M. oxydans)产酸量31.59 g/L。本研究证明酸浆水中的优势菌群除乳酸菌外,还有其他产酸性能力强的菌群,其均对增加酸浆水酸度发挥重要作用,对酸浆水风味的形成可能具有重要影响。因此还需进一步研究3 株肠球菌、M. oxydans与乳酸菌协同发酵黄浆水的代谢机制、对人体有潜在危害代谢物、具有重要生理活性功能的代谢物及其对酸浆水风味的影响,以为改善酸浆豆腐品质、口感提供理论参考。
4 结 论
为探明云南牟定酸浆水中优势产酸菌株及其生长特性、高效应用黄浆水、减少排放污染,本实验从云南牟定A、B公司自然发酵酸浆水中分离筛选到10 株高产酸菌株,并对其进行形态学观察、生理生化实验、16S rDNA序列测定分析、同源性比对及发育树的构建。通过形态学观察、生理生化实验,可将10 株菌可分乳杆菌属、乳球菌属、肠球菌属、微杆菌属。将10 株菌进行16S rDNA序列测定分析及同源性比对得到菌株YQZ1为L. fermentum、菌株YQZ2为L. raffinolactis、菌株YQZ3为L. plantarum、菌株YQZ4为E. casseliflavus、菌株YQZ5为M. oxydans、菌株XJZ1为E. faecium、菌株XJZ2为L. plantarum、菌株XJZ3为L. paracasei、菌株XJZ4为 E. hirae、菌株XJZ5为L. paracasei。10 株高产酸菌种乳酸菌6 株、肠球菌3 株、微杆菌1 株,因此可确定乳酸菌为云南牟定酸浆水中优势菌群。
10 株菌及自然菌群的生长温度、生长曲线、产酸能力、耐酸能力的分析结果表明,菌株XJZ4最适生长温度为32 ℃,其余菌株的最适生长温度均为37 ℃。相同培养时间内,菌株XJZ2生长速率最大,菌株YQZ1、XJZ2繁殖能力最强;产菌株YQZ1、XJZ2产酸能力最强,有机酸累积量最多,培养至20 h时pH值分别降至3.80、3.58,二者于48 h产酸量分别高达43.61、50.91 g/L;菌株YQZ3、YQZ5的耐酸性最强;菌株YQZ1、XJZ2耐酸性良好,在pH 4.0时仍能保持菌体浓度高于1.00;菌株YQZ4耐盐性最强,菌株YQZ4在4 g/100 mL NaCl条件下仍能保持菌体浓度1.53,其余菌株在NaCl质量浓度大于4 g/100 mL时生长受到明显抑制;通过生长特性分析,菌株YQZ1、XJZ2均具有较强的繁殖能力和较高的产酸性能,二者可用于后续混合菌种发酵黄浆水研究。
