GnIH过表达载体构建及其对小鼠睾丸间质细胞的作用研究
2021-11-04汤亚茹阳美霞贾金美张虹亮王水莲
汤亚茹,阳美霞,贾金美,张虹亮,王水莲
(湖南农业大学动物医学院,长沙 410128)
睾丸间质细胞集中散布于睾丸曲精小管间的疏松结缔组织内,主要参与睾酮的合成与分泌,雄性机体内睾酮95%由睾丸间质细胞分泌,睾酮在维持雄性动物的生殖器官分化、雄性动物的第二性征、雄性副性腺的发育和功能以及维持精子发生中起着重要的作用[1-2];睾丸间质细胞的数量、形态改变和合成分泌睾酮的功能下降都会引起一系列的生殖障碍疾病[3]。
促性腺激素抑制激素(gonadotropin-inhibitory hormone, GnIH)是最初由Tsutsui等[4]在鹌鹑下丘脑中发现的一类含有精氨酰-苯丙酰胺(RF酰胺)的神经肽,在哺乳动物中,GnIH同源物为RF酰胺相关肽-3(RFamide-relatedpetide,RFRP-3,别称Npvf),具有拮抗下丘脑分泌的促性腺激素释放激素(GnRH)的作用[4-7]。有报道称,GnIH不仅对动物摄食[8]、行为[9]、应激[10]、能量代谢[11]和生物节律[12]有调节作用,而且对动物生殖活动也有重要的调节作用。相关研究表明,哺乳动物的GnIH可通过下丘脑作用于GnRH神经元来抑制促性腺激素的释放与合成[13],还可直接作用于垂体来抑制促性腺激素(FSH和LH)的合成和分泌[14-15],进而抑制动物的生殖。GnIH可参与雌性动物季节性发情调节和发情时期转换[16];影响卵泡的发育、凋亡和黄体化[17];影响颗粒细胞的增殖和卵巢类固醇的生成[17-18],从而影响雌性哺乳动物生殖。GnIH还可影响附睾的组织学变化、生殖细胞数量、精子的生成和睾酮水平[19-20],从而影响雄性哺乳动物生殖。但是,GnIH对睾丸间质细胞生长发育的直接影响和对睾丸间质细胞睾酮分泌的机制研究尚不完全清晰。本研究通过构建GnIH过表达载体并体外转染小鼠睾丸间质细胞,探究其对小鼠睾丸间质细胞(TM3细胞系)凋亡的效应及睾酮合成的调节作用,为揭示GnIH在雄性哺乳动物生殖调控过程中的作用及机制提供科学理论依据。
1 材料和方法
1.1 试验样品
成熟的6~8周雄性ICR小鼠购自斯莱克景达公司。根据美国国立卫生研究院指南对所有小鼠进行实验动物的护理和使用。饲养环境温度维持在(22±3)℃,相对湿度为50%~70%,并保持12 h的明暗循环。给小鼠饲喂标准日粮并自由饮水。TM3细胞系由本实验室冻存。
1.2 主要试剂
质粒PLVX-IRES-ZsGreen1从长沙市赢润生物公司购买;DH5α感受态细胞、反转录试剂盒、SYBR Premix Ex Taq购自TaKaRa公司;EcoR Ⅰ内切酶、BamH Ⅰ内切酶、无内毒素质粒大提取试剂盒、无内毒素质粒小提取试剂盒购自康为试剂公司;RNA提取试剂盒购自天恩泽公司;胎牛血清购自Gibco公司;Opti-MEM、LipofectamineTM2000购自Invitrogen公司;0.25%胰蛋白酶购自碧云天生物技术研究所;DME/F-12(1∶1)培养基购自浙江天杭生物科技有限公司;小鼠睾酮含量测定试剂盒购自武汉华美公司;细胞凋亡检测试剂盒购自吉凯生物。
1.3 GnIH过表达载体的构建与鉴定
小鼠脱颈处死后取睾丸组织,按RNA提取试剂盒说明书提取睾丸组织RNA。将组织RNA用TaKaRa逆转录试剂盒逆转录成cDNA(-20 ℃保存)。用表1设计的目的基因GnIH特异性引物(含EcoR Ⅰ、BamH Ⅰ酶切位点及保护碱基)进行目的基因的扩增、纯化及回收。用EcoR Ⅰ、BamH Ⅰ双酶切回收的目的片段和表达载体PLVX-IRES-ZsGreen1酶切产物,用T4 DNA连接酶于16 ℃水浴连接过夜。产物转化入DH5α 感受态,Amp+LB平板培养,挑取8个单菌落扩大培养,进行质粒小提,质粒分别进行酶切验证并送至华大基因公司测序鉴定。鉴定出的正确阳性菌株(含GnIH过表达质粒)再扩大培养,采用全式金无内毒素质粒大提试剂盒提取质粒(-20 ℃保存)。
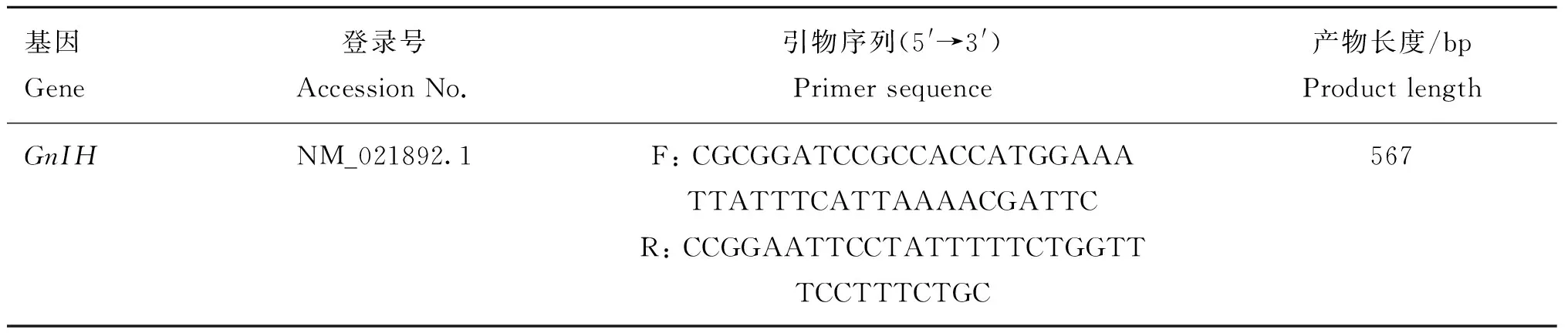
表1 GnIH基因引物序列
1.4 TM3细胞培养
复苏并培养TM3细胞(离心去除上清二甲基亚砜DMSO;DME/F-12+5% FBS+1%青链霉素),细胞长至90%时进行1∶1传代(含0.25%EDTA的胰酶消化)和培养,至少传两代。试验前将细胞消化、重悬并接种至新的培养板培养。
1.5 质粒转染
TM3细胞以5×105个·孔-1密度铺板于六孔板中,当细胞融合率到达80%左右时更换为无双抗无血清培养基(DME/F-12)饥饿处理2~4 h,转染步骤参照Lipofectamine TM 2000说明书进行,试验分为2组:PLVX-IRES-ZsGreen1质粒转染组(空质粒组),PLVX-IRES-ZsGreen1-GnIH过表达质粒转染组(GnIH过表达组),每组3个重复。转染后培养72 h,显微镜视野下观察荧光并收集细胞和上清液。
1.6 过表达GnIH对TM3细胞凋亡率影响
不同质粒转染TM3细胞72 h后收集各组细胞样,参照凋亡试剂盒说明书PI/FITC双染色法原理进行试验,最后利用流式细胞仪检测TM3细胞凋亡情况,并计算凋亡率。
1.7 TM3细胞睾酮分泌含量测定
收集转染72 h后空质粒组和GnIH过表达组的细胞上清液,采用武汉华美小鼠睾酮试剂盒测定各组中睾酮含量,具体步骤按说明书进行;在450 nm波长处依次测量各孔的吸光度(OD值),并计算睾酮浓度。
1.8 实时荧光定量PCR检测基因表达
收集空质粒组和GnIH过表达组质粒转染后的TM3细胞,提取细胞RNA,逆转录后以cDNA为模板进行实时荧光定量PCR,检测GnIH、睾酮合成相关酶基因(StAR、P450 scc、3β-HSD、17β-HSD和P450c17)和凋亡相关基因(Bax、Bcl-2和P53)mRNA 表达量变化。RT-PCR体系为:SYBR®Premix Ex Taq(2×)10 μL、Forward Primer(10 μmol·L-1)0.2 μL、Reverse Primer(10 μmol·L-1)0.2 μL、ROX Reference Dye(50×)0.4 μL、cDNA 2 μL、 dH2O 7.2 μL。 反应条件: 95 ℃ 30 s、95 ℃ 5 s、 57 ℃ 30 s、95 ℃ 15 s、61 ℃ 60 s、95 ℃ 15 s、40个循环, 最后利用CT值分析结果(β-actin作为内参)。基因引物序列如表2所示。

表2 qRT-PCR反应引物序列
1.9 统计学分析
所有试验都独立重复3次,结果用“平均值±标准误(Means±SEM)”表示。所有数据统计分析均使用SPSS19.0软件进行,P<0.05为差异显著,P<0.01为差异极显著。两组之间的差异显著性比较用独立样本t检验进行分析。
2 结 果
2.1 GnIH过表达质粒PCR和测序鉴定
阳性质粒GnIH过表达质粒经内切酶EcoRⅠ、BamHⅠ双酶切后切下约567 bp的GnIH基因片段和8 204 bp的载体片段,条带较明显(图1A)。GnIH过表达质粒送至华大基因公司进行序列测定,将测序所得的序列在NCBI中进行序列比对,显示构建序列与目的基因碱基序列一致(图1B),表明GnIH过表达质粒构建成功。

A. GnIH过表达质粒双酶切电泳图,泳道1.1 kb Plus DNA Ladder;泳道2.空质粒双酶切;泳道3.GnIH过表达质粒双酶切;泳道4.Trans2K DNA Marker. B. GnIH过表达质粒测序后比对结果,Query.比对序列; Sbjct.目标序列A. Dual-enzyme digestion of GnIH overexpression plasmid electropherogram, Lane 1. 1 kb Plus DNA Ladder; Lane 2. Dual-enzyme digestion of empty plasmid; Lane 3. Dual-enzyme digestion of GnIH overexpression plasmid; Lane 4. Trans2K DNA marker. B. Result of sequence comparison of GnIH overexpression plasmid, Query. Alignment sequence; Sbjct. Target sequence图1 GnIH过表达质粒PCR和测序鉴定Fig.1 PCR and sequencing identification of GnIH overexpression plasmid
2.2 质粒转染效率鉴定
空载体质粒和GnIH过表达质粒转染TM3细胞72 h,荧光显微镜观察各孔细胞中绿色荧光蛋白的表达情况,各组转染效率为60%左右(图2A、B),满足后续实验的要求。转染72 h后收集细胞,用qRT-PCR法检测不同转染组TM3细胞中GnIH基因的表达量,结果显示,过表达组GnIHmRNA与空质粒组相比极显著升高(P<0.01),表明GnIH过表达载体构建成功并在TM3细胞中表达(图2C)。

A. 空质粒组;B. GnIH过表达组;C. GnIH mRNA的相对表达量;组间比较:*.P<0.05;**.P<0.01.下同A. Empty plasmid group; B. GnIH overexpression group; C. Relative expression of GnIH mRNA; Comparison among groups:*.P<0.05;**.P<0.01.The same as below图2 质粒转染效率鉴定Fig.2 Plasmid transfection efficiency identification
2.3 过表达GnIH对TM3细胞凋亡的影响
空载体质粒和GnIH过表达质粒转染TM3细胞72 h后收集细胞,用流式细胞术和qRT-PCR法分别检测不同转染组细胞凋亡情况和细胞凋亡相关基因P53、Bax/Bcl-2 mRNA的表达情况。结果表明,细胞转染不同质粒后,过表达组细胞凋亡率(20.38±1.20)%相比于空质粒组细胞凋亡率(7.24±0.59)%显著增加,且差异极显著(P<0.01,图3C);与空质粒组相比,GnIH过表达组P53 mRNA表达量极显著上调(P<0.01);过表达组Bax/Bcl-2比值与空质粒组相比极显著增大(P<0.01,图3D)。
2.4 过表达GnIH对TM3细胞睾酮合成与分泌的影响
空载体质粒和GnIH过表达质粒转染TM3细胞,72 h后收集细胞培养液和细胞,用ELISA和qRT-PCR法分别检测不同转染组睾酮分泌水平和睾酮合成相关酶基因(StAR、P450scc、3β-HSD、17β-HSD和P450c17)mRNA表达水平。结果表明,与空质粒组相比,过表达组睾酮分泌水平极显著下降(P<0.01,图4A);过表达组StAR、3β-HSD和P450c17 mRNA表达量与空质粒组相比显著降低(P<0.05),P450 scc mRNA表达量与空质粒组相比极显著降低(P<0.01),17β-HSDmRNA表达量在两组间差异不显著(P>0.05,图4B)。
3 讨 论
在雄性动物中,睾丸间质细胞的凋亡会严重影响雄性动物的生殖[1-3]。现有文献报道称,GnIH也可影响雄性生殖,如诱导雄性成年鸟类的睾丸凋亡和曲细精管退化[21];诱导大鼠附睾细胞凋亡[19];影响小鼠生殖细胞的增殖和凋亡来抑制精子形成[20]。Bax、Bcl-2、P53均是参与调控细胞凋亡的关键细胞因子,Bcl-2是一种具有抑制凋亡作用的癌基因,而Bax是具有促进细胞凋亡作用的基因,两者可通过形成二聚体而发挥调控细胞凋亡的作用[22-23]。Bax与Bcl-2两基因表达量的比值体现了细胞生理情况,比值升高说明细胞趋向于凋亡,而比值降低表明细胞趋向于健康状态[24-25]。P53同样作为促进细胞调亡的关键基因,是Bax与Bcl-2的上游调控基因,正常情况下P53可以上调Bax和下调Bcl-2的表达来促进细胞发生凋亡[26-28]。在褪黑素对睾丸间质细胞凋亡影响的研究中发现,细胞内Bcl-2表达水平上升, Bax表达水平下降[29]。但目前尚无GnIH与睾丸间质细胞关系的研究。本研究也证实了GnIH过表达组细胞凋亡率显著增加,Bax/Bcl-2比值过表达组显著高于空质粒转染组,过表达组P53 mRNA表达量也显著上调。这些结果说明GnIH对睾丸无论是精子形成还是间质细胞发育均有抑制作用。
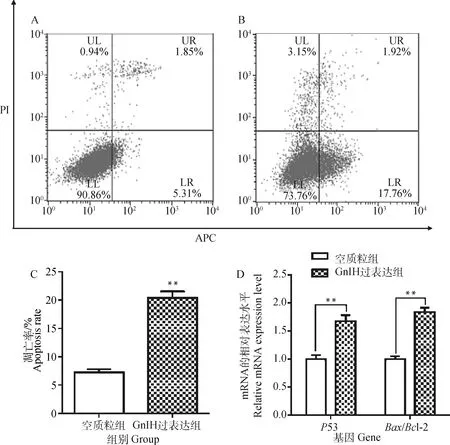
A.空质粒组;B. GnIH过表达组;C. 细胞凋亡率统计图;D. 凋亡相关基因表达水平A.Empty plasmid group; B. GnIH overexpression group; C. Apoptosis rate statistics chart; D. Apoptosis-related gene expression level图3 过表达GnIH对TM3细胞凋亡的影响Fig.3 Effect of overexpression of GnIH on the apoptosis in TM3 cells
机体内的睾酮主要由睾丸间质细胞合成[1-3]。本研究构建了GnIH过表达重组质粒,转染至TM3细胞72 h后发现,GnIH能抑制睾丸间质细胞睾酮的合成。这一结果与Anjum等[20]和Zheng等[30]研究报道一致。目前,GnIH抑制睾丸间质细胞睾酮合成的机理研究较少,本研究检测了间质细胞中类固醇合成相关酶基因水平,结果表明,过表达组睾酮合成酶基因StAR、P450scc、3β-HSD和P450c17 mRNA表达量与空质粒转染组相比显著降低,这一结果更进一步证明GnIH能抑制睾酮合成。
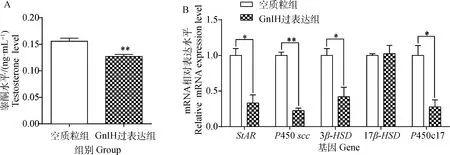
A.GnIH过表达对TM3细胞睾酮分泌的影响;B. GnIH过表达对TM3细胞睾酮合成相关酶基因表达的影响A.Effect of GnIH overexpression on the secretion of testosterone in TM3 cellsl; B. Effect of GnIH overexpression on gene expression of testosterone synthesis-related enzymes in TM3 cells图4 GnIH过表达对TM3细胞睾酮合成与分泌的影响Fig.4 Effect of GnIH overexpression on the synthesis and secretion of testosterone in TM3 cells
4 结 论
本研究成功构建了GnIH过表达载体,GnIH过表达可诱导TM3细胞凋亡,抑制睾酮合成相关酶的表达,进而抑制睾酮分泌。
