牛羊水间充质干细胞对小鼠酒精性肝病的影响
2021-11-04纪洪兵宋哈楠赵诗宇关伟军
纪洪兵,宋哈楠,赵诗宇,张 涛,关伟军*
(1.佳木斯大学基础医学院,佳木斯 154007; 2.中国农业科学院北京畜牧兽医研究所,北京 100193)
羊水间充质干细胞(AF-MSCs)在20世纪初首次被分离和研究,其具有体外扩增和紧密合成支架能力,是作为选择胎儿组织构建体工程的可靠且实用的细胞来源[1-2]。AF-MSCs广泛应用的原因主要是:1)AF-MSCs 可以在羊膜穿刺术期间收集,从原本会被丢弃的材料中分离出来,不会受到伦理争论的影响;2)与其他胎儿来源的干细胞一样,AF-MSCs便于储存且成本较低;3)羊水是多能干细胞的来源,细胞群体易扩大且能够长期保存而不会产生不良影响,可以用于器官再生。与胚胎干细胞(ES)不同的是,羊水来源的干细胞在注射到裸鼠皮下时不会形成畸胎瘤[3]。AF-MSCs已经应用于抗肿瘤、神经元再生、坏死性结肠炎、皮肤损伤及缺血性心脏病等研究中,能够分泌多种细胞毒性细胞因子靶向作用癌细胞,使癌细胞凋亡;还可以分泌保护性、营养性因子促进局部组织再生,显示出其多能分化性、非致瘤性、低免疫原性、抗纤维化反应[4-8]。经过20多年的探索,我国国家家养动物种质资源库成功建立,能够保存各类遗传物资,目前,已保存体细胞和干细胞约9万余份。本研究中的牛AF-MSCs分离培养并纯化后,代次小、活力好的优质细胞将入储存库用于资源保存,另一部分将入应用库用于后续生命科学研究。
酒精性肝病(ALD)是一种由过量饮酒引起的广谱疾病,从早期的单纯性脂肪变性、酒精性肝炎、肝硬化,到晚期的肝细胞癌。尽管有许多改善ALD预后的尝试,但晚期ALD的治疗仍然基于禁酒、短暂皮质类固醇支持或肝移植等办法。治疗ALD的几种方法主要是针对肝再生能力的恢复,如细胞因子诱导、干细胞移植和建立3D人工肝[9-12]。HIF-1α作为调节肝氧化应激、脂质代谢的关键因子,参与低氧应激基因的表达与氧稳态平衡。VEGF是其最重要的下游调控基因之一,HIF-1α/VEGF信号通路对细胞迁移及门静脉高压以及侧支循环的建立均有一定影响,亦成为众多疾病的致病机制及治疗的靶标。而TLR4与配体结合后,激活NF-κB,同时触发宿主炎症反应中促炎性基因的表达、活化及炎症因子释放从而引起促炎作用。在自体骨相关髓间充质干细胞(MSCs)治疗慢性肝病中,大多都涉及粒细胞集落刺激因子(G-CSF)动员MSCs或直接采集并移入外周或肝血管系统,但临床受试者样本量少,病因亦不同,导致慢性肝病未来研究的方向仍不确定。有研究报道,自体AF-MSCs移植能改善四氯化碳(CCl4)导致的肝纤维化,并成功示踪移植细胞在体内的分布状态[13]。而牛AF-MSCs用于小鼠ALD模型在国内外鲜见报道。水飞蓟宾胶囊(水飞蓟素类)作为早期ALD、急慢性肝炎肝功能异常恢复的推荐药物[14],选取其作为本研究的阳性药物,与牛AF-MSCs对比探讨ALD小鼠的治疗效果与其可能的作用机制,为临床兽医和临床治疗在细胞种属与来源方面提供参考。
1 材料与方法
1.1 材料
1.1.1 试验动物 4~5月龄雌性胎牛来自北京畜牧兽医研究所昌平实验基地。48只SPF级ICR雄性小鼠, 6~8周龄,体重32~36 g,购自北京维通利华实验动物技术有限公司,实验单位使用许可证编号SYXK(京)2019-0046。饲养于中国农业科学院北京畜牧兽医研究所实验动物中心SPF级饲养室,实验动物使用许可证号SCXK(京)2016-0006。
1.1.2 药品 水飞蓟宾胶囊,购自天津天士力圣特制药,国药准字H20040299。
1.1.3 主要仪器及试剂 恒温CO2培养箱购自德国贺利氏公司;离心机购自艾本德中国有限公司;TE-2000-E共聚焦显微镜购自日本尼康公司;多功能扫描成像分析系统和实时荧光定量PCR仪均购自伯乐公司。L-DMEM、胎牛血清(FBS)、山羊血清均购自Gibco公司;胰蛋白酶(Trypsin1:250)、EDTA、DMSO、Triton-X100均购自Sigma公司;抗CD44、CD73、CD71、SSEA4、OCT4兔源抗体及山羊抗兔-FITC均购自北京博奥森生物技术有限公司;Dil碘化物购自北京富百科生物技术有限公司;ALT、AST、TG测定试剂盒购自长春汇力生物技术有限公司;反转录试剂盒和荧光定量试剂盒均购自TaKaRa公司;动物组织总RNA提取试剂盒购自天根生化科技(上海)有限公司。
1.1.4 试剂配制 试剂配制参考Gao等[15]的研究。水飞蓟宾胶囊内容物溶剂:成年人210~420 mg · d-1,按体表面积剂量折算小鼠1.2~2.4 mg · d-1,将水飞蓟宾胶囊内容物1.2 mg溶于0.1 mL 56度红星二锅头(现用现配)。
1.1.5 引物设计及合成 参照GenBank中牛、小鼠基因mRNA 序列设计同源引物,应用Primer Premier 5.0 软件设计扩增各基因CDS区,引物信息见表1、2。引物均由生工生物工程(上海)股份有限公司合成。

表1 PCR引物序列
1.2 方法
1.2.1 AF-MSCs分离培养 无菌条件下剖宫产后的胎牛(4~5月),用冷藏箱在4~8 h内运送到实验室,在无菌条件下用50 mL注射器穿刺羊膜层,收集羊水,3 000 r · min-1离心9 min。用100 mL无菌离心管连续向同一离心管内注入羊水收集细胞,将细胞以1×103个 · mL-1接种到12孔板中,在37 ℃,5%CO2培养箱中孵育。接种后48 h,用PBS冲洗细胞2次,去除未贴壁细胞。当细胞达到70%~80%融合时,用0.25%胰蛋白酶消化细胞,进行传代培养。
1.2.2 AF-MSCs的RT-PCR鉴定 选取P5代细胞当融合至80%~90%时,TRIzol 1 ml裂解5 min; 转移至无RNase EP管,200 μL氯仿剧烈震荡,室温静置5 min;4 ℃,12 000 r · min-1离心15 min;取上层水相加入等体积异丙醇,震荡后静置15 min;4 ℃,12 000 r · min-1离心15 min;75%乙醇清洗管底沉淀,离心同上;晾干加入dH2O 30 μL,得到总RNA溶液。利用反转录试剂盒合成cDNA。 反转录条件:37 ℃ 15 min,85 ℃ 15 s,4 ℃保存。PCR反应体系 20 μL:2 ×TaqPCR StarMix with Loading Dye 10 μL,RNase Free dH2O 7 μL,上、下游引物及cDNA模板各1 μL。扩增条件:94 ℃ 5 min; 94 ℃ 1 min,60 ℃ 40 s,72 ℃ 50 s,共30个循环;72 ℃ 7 min。
1.2.3 AF-MSCs的免疫荧光鉴定 用37 ℃温预4%多聚甲醛固定30 min,0.1% Triton X-100室温通透15 min,PBS洗3次;1∶10山羊血清室温封闭30 min;兔源CD29、CD73、SSEA4和OCT4一抗1∶100稀释,4 ℃孵育过夜;FITC标记二抗1∶100稀释,室温避光孵育1 h,PBS洗3次,每次5 min。DAPI核染,室温15 min,PBS洗3次,激光共聚焦显微镜下拍照并观察。
1.2.4 AF-MSCs成脂诱导 L-DMEM+1 μmol · L-1地塞米松、5 μg · mL-1胰岛素、0.5 mmol · L-1异丁基甲基黄嘌呤(IBMX)和60 μmol · L-1吲哚美辛的培养基中培养2周,每2 d更换一次诱导培养基。
1.3 动物模型制备与检测
1.3.1 造模 48只ICR小鼠随机分为4组:空白对照组(BC组)、模型对照组(MC组)、AF-MSCs组(MC+AF-MSCs组)、水飞蓟宾胶囊(SC)组(MC+SC组),每组12只。适应性饲养7 d,第8天除BC组以外,其余试验组均以56度红星二锅头灌胃,5 g · kg-1,2次 · d-1连续4周。第5周试验前12 h MC+AF-MSCs组小鼠禁食不禁水,麻醉后左肋下缘处纵开口0.5 cm,暴露肝左叶,将Dil标记细胞悬液用微量注射器注射50 μL。同时MC+SC组行水飞蓟宾胶囊内容物溶剂灌胃,2次 · d-1共2.4 mg,共1 d。
1.3.2 小鼠血清检测 2%戊巴比妥钠麻醉小鼠后,眼球取血,室温静置30 min,3 000 r · min-1离心20 min分离血清。根据ALT、AST和TG测定试剂盒说明书,检测特定波长OD值,根据公式换算活性。
1.3.3 肝组织HE及免疫组化染色 麻醉后取肝左叶组织固定液固定过夜后,常规脱水、石蜡和OCT包埋、切片,油红O染色,光镜下选取相同的病变区域准确观察肝小叶脂肪病变情况。
1.3.4 Dil标记AF-MSCs Dil碘化物储存液:Dil粉末10 mg,溶于10 mL DMSO溶解配置终浓度1 mmol·L-1于-20 ℃,避免反复冻融。稀释储存液至终浓度为5 μmol·L-1的工作液,P5代悬浮细胞(1×108个·mL-1)加入工作液中37 ℃孵育25 min, 1 000 r · min- 1离心5 min,弃上清,加入37 ℃基础培养基1 mL。
1.3.5 实时荧光定量PCR 小鼠麻醉后取肝尾状叶迅速放置冻存管中液氮保存,利用动物组织总RNA提取试剂盒提取小鼠肝总RNA,并及时反转录合成cDNA第一链,以cDNA为模板进行实时荧光定量PCR。PCR反应体系25 μL:cDNA 2 μL,上、下游引物各1 μL,TB Green Premix ExTaqⅡ 12.5 μL,ddH2O 8.5 μL。PCR反应条件:95 ℃ 30 s; 95 ℃ 5 s,60 ℃ 30 s,共40个循环。每个样品最少进行3个重复。

表2 实时荧光定量 PCR引物序列
1.3.6 数据处理 数据使用SPSS25.0软件进行单因素方差分析及邓肯氏多重比较,用“平均值±标准差”表示,实时荧光定量PCR数据使用BC组归一后进行分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 AF-MSCs的形态
倒置相差显微镜观察发现,AF-MSCs接种72 h后贴壁至孔板的80%~90%;初次传代48 h后,AF-MSCs与多种类型细胞混合生长;继续传至3~4代,其他类型细胞从群体中分离并消失,AF-MSCs呈现出独特的漩涡状,不同代次细胞之间形态无明显差异,连续传代后细胞形态保持稳定(图1)。
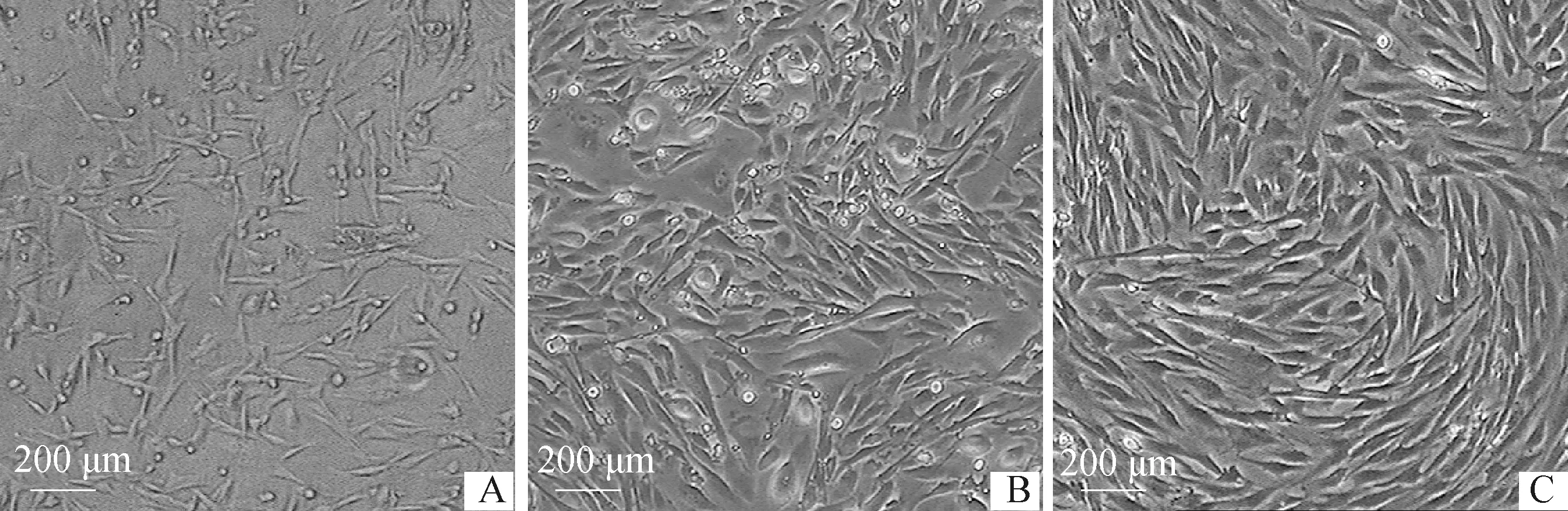
A. 原代培养72 h;B. P1代AF-MSCs与多种类型细胞混合生长;C. P3代呈现独特漩涡状A. Primary culture for 72 h; B. Passage 1, many type cells type were mixed with the AF-MSCs; C. Passage 3, which displayed a unique vortex shape图1 牛AF-MSCs形态Fig.1 Morphology of bovine AF-MSCs
2.2 AF-MSCs鉴定
2.2.1 RT-PCR扩增及免疫荧光 RT-PCR结果显示,CD44、CD73、SSEA、OCT4呈阳性表达,CD34和CD45呈阴性表达(图2);在AF-MSCs细胞中检测CD29、CD73、SSEA4、OCT4表面标记物,在共聚焦显微镜下扫描,结果表明,上述抗体均呈阳性细胞质表达(图3),说明分离培养细胞为羊水间充质干细胞。
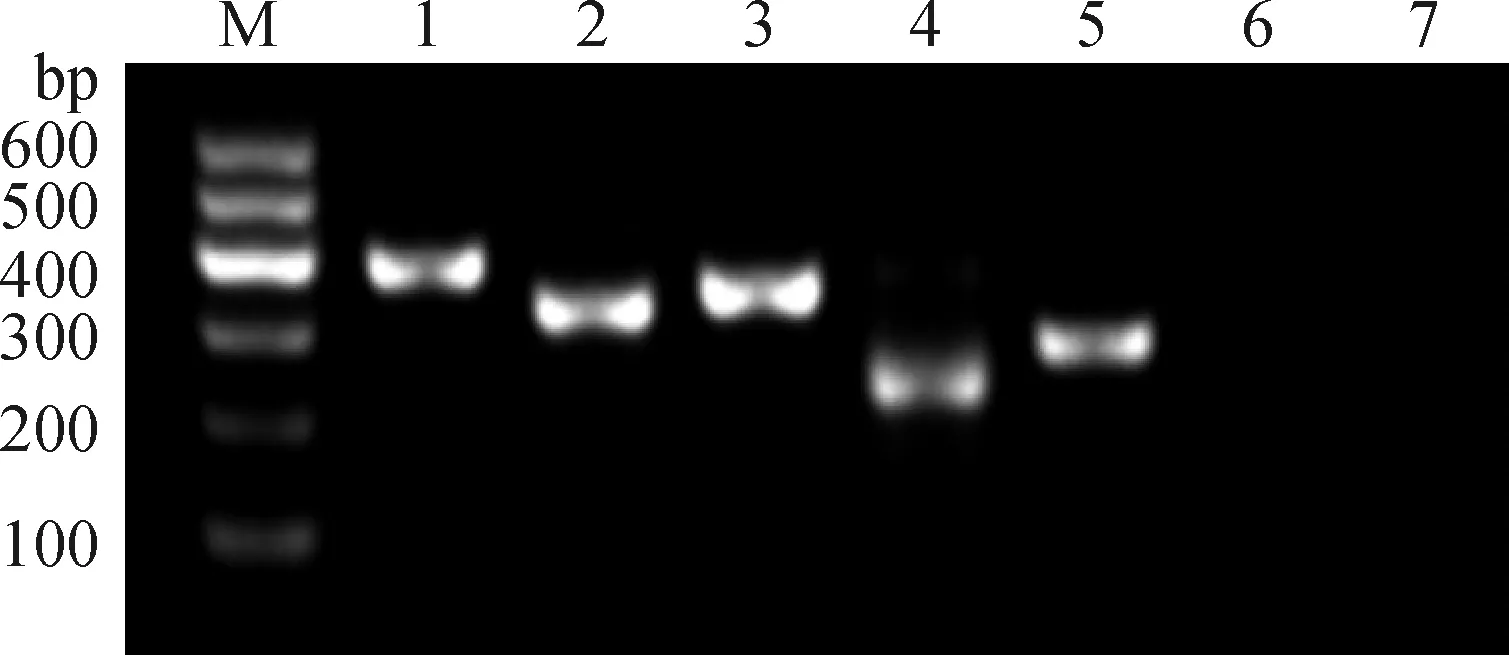
M. DNA相对分子质量标准;1. GAPDH;2. CD44;3. CD73;4. SSEA;5. OCT4;6. CD34;7. CD45M. DL 600 DNA Marker; 1. GAPDH; 2. CD44; 3. CD73; 4. SSEA; 5. OCT4; 6. CD34; 7. CD45图2 AF-MSCs表面标记物RT-PCR检测Fig.2 RT-PCR identification of AF-MSCs surface markers

图3 AF-MSCs表面标记荧光表达Fig.3 Immunofluorescence expression of AF-MSCs surface markers
2.2.2 诱导分化 在完全培养基中培养的阴性对照细胞,油红O染色呈阴性;在诱导14 d后,细胞内可见脂滴出现。随着成脂培养基培养时间的延长,液滴的数量增加,小液滴聚集形成更大的液滴。油红O染色阳性证明AF-MSCs脂肪细胞分化;RT-PCR检测发现,AF-MSCs诱导前PPAR-γ和LPL呈阴性表达,诱导后PPAR-γ和LPL呈阳性表达(图4)。
2.3 AF-MSCs和SC对ALD小鼠血清ALT、AST和TG活性的影响
由图5可知,与BC组相比,MC组ALT、AST和TG活性极显著升高(P<0.01);与MC组相比,MC+AF-MSCs组和MC+SC组ALT、AST和TG极显著降低(P<0.01);与MC+SC组相比,MC+AF-MSCs组ALT极显著的降低(P<0.01),AST显著降低(P<0.05),而TG活性无显著差异(P>0.05)。该结果说明牛AF-MSCs移植与常规用药均能改善肝功能,但牛AF-MSCs降低ALT、AST活性较SC显著。
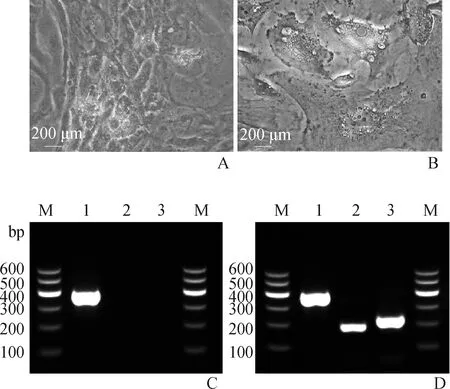
A. 对照组油红O呈阴性;B. 成脂培养基诱导14 d,成纤维样细胞变扁平并形成大脂滴;C. 对照组PPAR-γ、LPL均为阴性;D. 诱导组PPAR-γ、LPL均为阳性,GADPH作为内参。1. GAPDH;2. LPL;3. PPAR-γ;M. DNA相对分子质量标准A. Control group were negative for oil red O dye; B. After induction for 14 d, AF-MSCs became fibroblast-like to oblate and formed large lipid droplets; C. PPAR-γ and LPL were negative in the control group; D. PPAR-γ and LPL were positive in the inducted group, GAPDH served as the internal control. 1. GAPDH;2. LPL;3. PPAR-γ;M. DL600DNA marker图4 AF-MSCs成脂诱导形态学及脂肪细胞特异性基因RT-PCR检测Fig.4 Lipid induction of AF-MSCs and detection of adipocyte-specific genes by RT-PCR
2.4 AF-MSCs和SC干预后ALD小鼠肝组织HE和油红O染色情况
BC组肝组织无明显病理改变,肝小叶结构清晰,肝索排列整齐,肝血窦正常(图6A、E)。经4周酒精灌胃,MC组肝细胞边界模糊出现脂肪滴及肝血窦充血等病理改变(图6B),且油红O染色证实,肝细胞存在大量脂质沉积(脂质呈红色,图6F);SC治疗后炎症细胞浸润,但脂肪性变稍有轻微(图6C、H);AF-MSCs干预后脂肪滴及脂质沉积范围较MC+SC组明显缩小(图6D、G)。
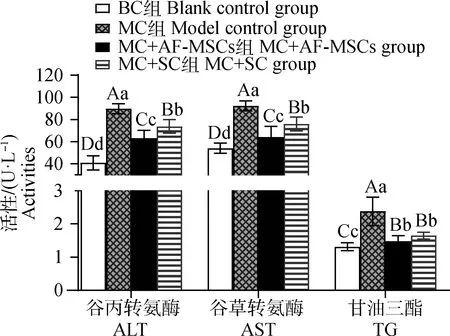
肩标不同小字母表示差异显著(P<0.05);肩标不同大字母表示差异极显著(P<0.01);肩标相同字母或无字母标注表示差异不显著(P>0.05)。下同Values with different small letter superscripts mean significant difference (P<0.05); With different capital letter superscripts mean extremely significant difference (P<0.01);While with the same letter superscripts mean no significant difference (P>0.05). The same as below图5 小鼠血清ALT、AST和TG活性检测Fig.5 Detection of ALT, AST and TG activities in serum of mice
2.5 Dil细胞示踪移植AF-MSCs
荧光显微镜下观察肝组织冰冻切片发现,未进行细胞移植的冰冻切片在549 nm波长下Dil呈阴性(图7A~C)。而 Dil标记AF-MSCs移植后48 h,可见AF-MSCs分布在小鼠肝组织中,产生归巢效应并定植在受损组织周围(图7D~F)。
2.6 AF-MSCs和SC对ALD小鼠 HIF-1α、TLR4、VEGF基因表达量的影响
各组小鼠肝组织HIF-1α、TLR4、VEGF相对表达量见图8。可知与BC组相比,MC组HIF-1α、TLR4、VEGF表达量均极显著高(P<0.01);与MC组相比,MC+AF-MSCs组及SC组表达三种基因均极显著降低(P<0.01)。与MC+SC组相比,MC+AF-MSCs组极显著低下调上述基因,其中经AF-MSCs干预后的HIF-1α表达量趋于BC组。
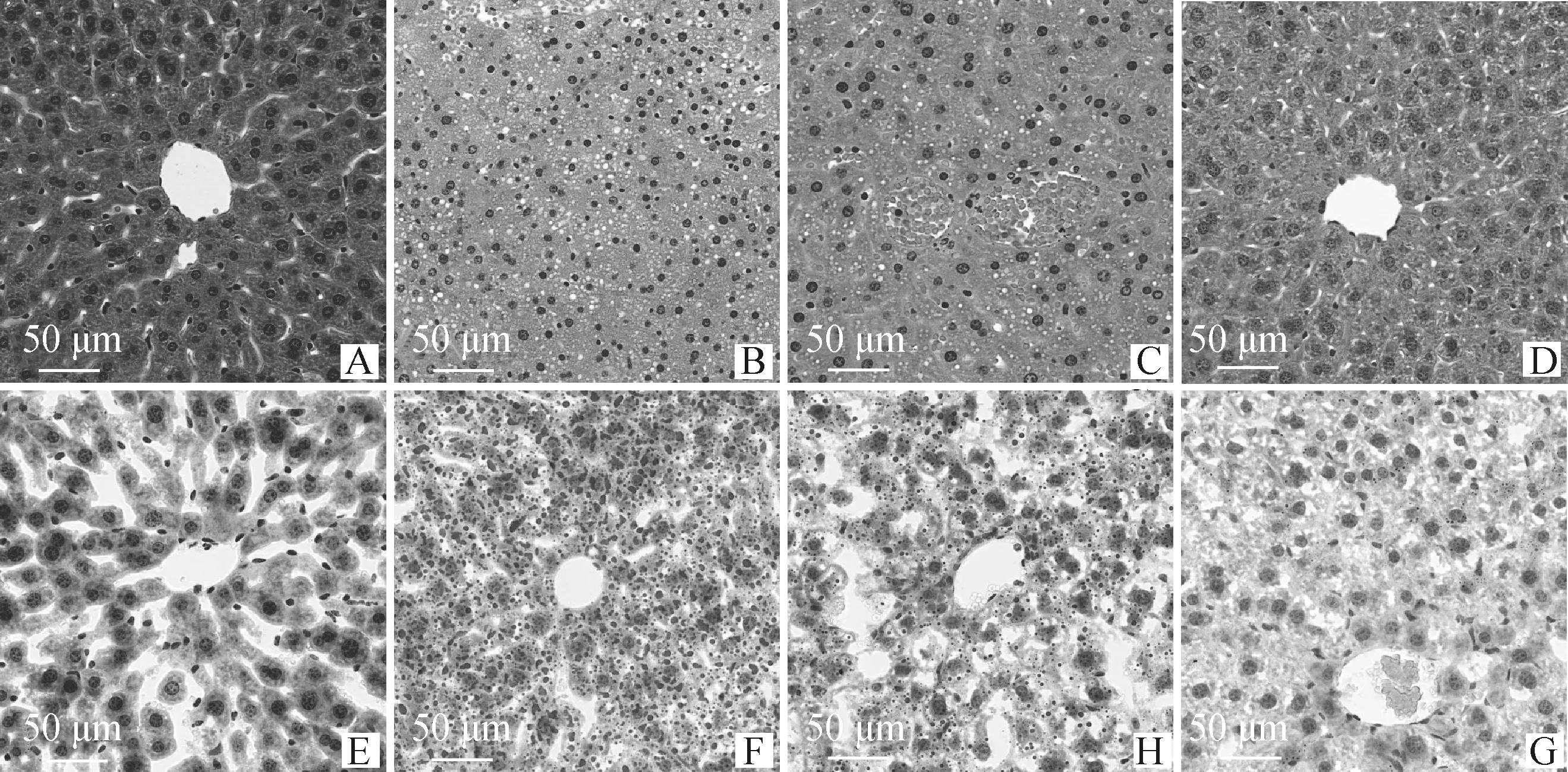
A、E. BC组;B、F. MC组;C、H. MC+SC组;D、G. MC+AF-MSCs组A, E. Group BC; B, F. Group MC; C, H. Group MC+SC; D, G. Group MC+AF-MSCs图6 小鼠肝组织HE染色(上排)及油红O染色(下排)Fig.6 The HE staining (upper row) and oil red O staining (lower row) of mouse liver

A、D. Dil标记荧光;B、E. DAPI核染;C、F. 叠加A, D. Luorescence labelled by Dil; B, E. DAPI nuclear dyeing; C, F. Merged图7 Dil细胞示踪剂标记移植AF-MSCs冰冻切片Fig.7 Tissue freezing section of AF-MSCs labelled by Dil
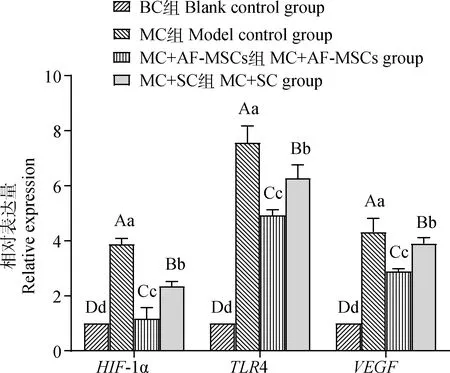
图8 HIF-1α、TLR4、VEGF基因mRNA表达量比较分析Fig.8 Comparative analysis of mRNA expression levels of HIF-1α、TLR4、VEGF genes
3 讨 论
3.1 羊水间充质干细胞
羊水来源MSCs因其在体外群体易扩大、免疫原性低且及不涉及伦理纠纷等优势,比其他来源干细胞更适合用于再生医学及基础兽医领域的研究。有研究将来自不同种实验动物的睾丸间充质干细胞移植到免疫缺陷小鼠后,供体细胞可在受体组织基底形成克隆,但向目的细胞分化不完整[16-17]。油红O染色及RT-PCR结果显示,AF-MSCs中出现橘红色脂肪滴、PPAR-γ和LPLmRNA呈阳性表达,说明AF-MSCs可诱导向脂肪细胞进行分化。据报道,AF-MSCs分离初期,与其混合生长的上皮样细胞和纤维样细胞分别来源于胎儿皮肤、尿液和纤维结缔组织、真皮成纤维细胞[18],本研究研究分离的AF-MSCs传至3、4代后,细胞得以纯化,这与Prusa等[19]的研究结果相似。Dario[20]报道的人羊水来源的干细胞表达CD29、CD44、CD73和OCT4等特异性标志,但不表达CD45和CD34,这与本研究结果相一致,说明AF-MSCs与胚胎干细胞(ES细胞)共表达OCT4,且有研究表明[21],OCT4在牛卵母细胞和早期胚胎发育过程中均有表达,也说明AF-MSCs可能具有与ES细胞相似的特征。本试验结果标明,试验成功分离到牛AF-MSCs并有诱导成脂分化的能力。
3.2 AF-MSCs对ALD小鼠的影响
至今ALD的发病机制尚不明确,但研究表明,主要机制涉及氧化应激、炎症作用、肠道菌群易位、细胞死亡和再生障碍等[22-25]。长期饮酒会增加肝的耗氧量,导致肝中枢及周围缺氧,HIF-1α作为在低氧状态下发挥活性的转录因子,在常氧情况下α亚基在特定的脯氨酸残基处被羟基化,从而使肿瘤抑制因子泛素化,泛素化将其靶向于蛋白酶体降解;在低氧情况下α亚基稳定并易位至细胞核,在其中与HIF-1β二聚化并调节靶基因的表达。Nath等[26]报道,当HIF-1α缺失时,小鼠肝脂肪性变减轻及血清TG活性降低。而本研究通过qRT-PCR检测各组小鼠肝HIF-1α相对表达量,发现长期饮酒会导致肝中HIF-1α水平升高和活化,在HIF-1α表达降低时,肝脂肪沉积及血清TG活性均显著减轻,与其结果相一致。本研究细胞示踪结果显示,经肝外移植的牛AF-MSCs成功定植并向受损肝组织部位归巢,完成了干细胞有效治疗的必要条件。且MSCs具有趋化性,在静脉注射后,能响应炎症条件并附着于内皮,并在内皮细胞之间向受损组织迁移。本研究中qRT-PCR结果显示,经AF-MSCs干预的肝组织中VEGFmRNA水平降低,说明植入的细胞可抑制VEGF表达,使血管通透性恢复,进而改善肝血窦充血,Zhang等[27]利用斑马鱼模型证明,急性酒精暴露经治疗后,通过对血管内皮生长因子受体(VEGFR)活性的阻断,不能与其配体结合发挥分子作用从而改善肝脂肪变性、血管生成来增强肝修复,与本试验结果相符。本研究中,牛AF-MSCs下调ALD小鼠肝组织中TLR4,其主要来源可能位于肝细胞而非髓系细胞,原因在于Jia等[28]曾报道,敲除小鼠肝细胞和髓系细胞中TLR4,在急性酗酒模型中肝细胞TLR4缺陷小鼠的血清ALT、TG含量降低。相反,髓系细胞中缺失TLR4则不影响酒精脂肪肝的发展。本试验对比了牛AF-MSCs与SC对酒精导致的小鼠肝损伤在血清学、病理学及基因表达的影响,研究初步结果显示,牛AF-MSCs干预后小鼠存活率达到100%且治疗的效果优于SC。这对今后基础兽医研究异种干细胞移植治疗慢性肝病及临床治疗ALD方面提供了有效参考,同时也可考虑将干细胞移植的来源目标转移至家养动物身上,在再生医学中生产并推广应用。
4 结 论
本研究成功分离、培养并鉴定了牛AF-MSCs,移植入ALD小鼠后,证实对降低血清ALT、AST及TG在体内的活性以及减轻肝脂肪性变是有效的。牛AF-MSCs在一定程度上能抑制HIF-1α/VEGF信号通路,下调TLR4的表达,其综合效果优于SC。提示牛AF-MSCs对小鼠ALD病程中的肝功能具有改善作用。
