BCG感染巨噬细胞后内质网应激对细胞焦亡的调控作用
2021-11-04聂雪伊郑雪迪徐金瑞王玉炯
聂雪伊,刘 蕾,郑雪迪, 杨 易,徐金瑞*,王玉炯*
(1. 西部特色资源保护与利用教育部重点实验室,银川 750021; 2. 宁夏大学生命科学学院,银川 750021)
结核病(tuberculosis,TB)是由结核分枝杆菌(Mycobacteriumtuberculosis,Mtb)引起的慢性致死性人兽共患传染病[1]。牛结核病是由牛结核分枝杆菌(Mycobacteriumbovis)引起的传染性疾病,也能够威胁人类的健康。据报道,大约有10%的人结核病是由牛结核分枝杆菌感染引起的[2]。近年来,随着新型耐药菌株的出现和HIV双重感染及BCG免疫效果降低,TB的发病率及死亡率居高不下,严重威胁着人类的健康。据WHO 2019年报告显示,在全球范围内估计有1 000万人患结核病,大多数发展为结核病患者(约90%)的是成年人,其中男性多于女性[3]。
巨噬细胞是 Mtb 感染早期免疫应答的重要物质基础,在宿主抗Mtb感染免疫中起到关键作用,而Mtb也可通过阻止吞噬溶酶体的形成以逃避巨噬细胞的“追杀”[4]。内质网是真核细胞中重要的细胞器,对维持细胞稳态起重要作用。多种刺激因素可以引起ERS,为缓解ERS,内质网通过启动未折叠蛋白反应(unfolded protein response,UPR)维持细胞稳态[5]。葡萄糖调节蛋白78(glucose-regulated protein-78,GRP78),是UPR的关键调控因子[6]。有研究表明,Mtb感染巨噬细胞后会诱发ERS[7-8],如果UPR无法恢复内质网稳态,可能会诱发程序性细胞死亡[9]。
在Mtb感染巨噬细胞的过程中除了可以诱发ERS,还可以通过细胞焦亡等方式,抑制病原菌在宿主体内的扩散[10]。细胞焦亡(pyroptosis)是一种重要的先天免疫反应,是介于坏死和凋亡之间的程序性细胞死亡模式,其主要的特征为细胞膜破裂,释放诸多细胞因子和危险信号分子,激活免疫系统,导致炎症反应[11]。细胞焦亡与阿尔茨海默病[12]、多发性硬化症[13]、中风[14]等多种人类疾病的发生发展息息相关。
然而,在Mtb感染巨噬细胞后,其诱发的ERS与细胞焦亡间的关系尚不明确。为此,本研究在BCG感染THP-1细胞后,通过抑制ERS,采用qRT-PCR、Western blot、ELISA、CCK-8等方法,对ERS和细胞焦亡的相关指标进行检测,旨在揭示BCG感染THP-1细胞后ERS对细胞焦亡的调控作用。
1 材料与方法
1.1 主要试剂和仪器
细胞计数仪(BioRAD公司,美国),实时荧光定量PCR仪Quantity Studio 5、NanoDrop-8000(赛默飞,美国),GE Amersham Imager600自动化学发光成像仪(General Electric Company,美国),Enspire荧光酶标仪(PerkinElmer公司,美国),光学显微镜(Motic公司,中国)。
1.2 BCG培养
BCG购于成都生物制品研究所,培养步骤:配制含0.2% Tween-80的7H9培养液,高压灭菌后,加入10% ADC Enrichment增菌液混匀。将BCG接种于已配制好的7H9培养液中,于37 ℃,5% CO2细胞培养箱中静置培养,通过测定OD600 nm值确定BCG浓度。
1.3 细胞培养
人单核巨噬细胞THP-1细胞购于中国科学院细胞库,培养步骤:THP-1细胞培养于含有10%胎牛血清和0.05 mmol·L-1β-巯基乙醇的RPMI Medium 1640培养基中,当细胞密度达到80%~90%时,采用半换液法进行传代,传代后静置于37 ℃,5% CO2细胞培养箱中培养。将含有50 ng·mL-1佛波酯的THP-1细胞按2×106个·孔-1接种在6孔板中,于37 ℃,5% CO2细胞培养箱中培养48 h后,将其诱导分化成巨噬细胞,更换新鲜的培养液,继续培养24 h,用于后续试验。
1.4 BCG感染
BCG感染复数为10∶1,感染时间为0、2、6、12、24、48 h。在此基础上,采用5 mmol·L-1TUDCA预处理细胞2 h,BCG感染24 h,分以下4个 组:对照组(C)、BCG感染组(BCG)、ERS抑制剂组(TUDCA)和BCG +ERS抑制剂组(BCG+TUDCA)。
1.5 qRT-PCR
按照试验设计组处理细胞后,Trizol法提取总RNA,将RNA反转录成cDNA(反应体系:20 μL;反应条件:42 ℃ 2 min,37 ℃ 15 min,85 ℃ 5 s),采用qRT-PCR方法(反应体系:20 μL;反应条件:采用“两步法进行反应”,第一步为94 ℃ 30 s;第二步为94 ℃ 5 s,60 ℃ 30 s,44个循环)检测GRP78、GSDMD、Caspase1、NLRP3、IL-1β和IL-18等基因mRNA水平的表达(引物资料见表1)。
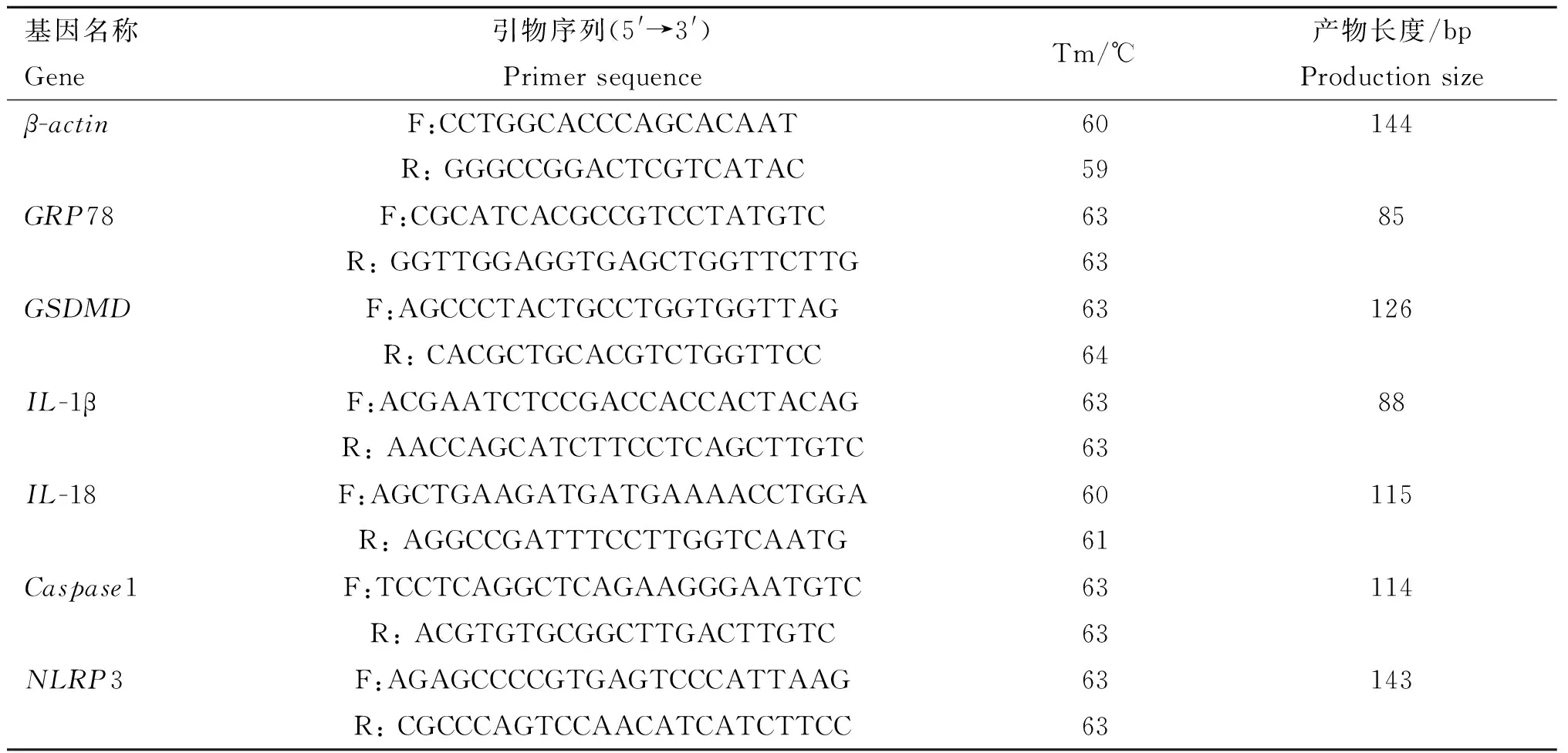
表1 qRT -PCR引物设计表格
1.6 Western bolt检测
按照“1.3”和“1.4”中的方法处理细胞后,提取各组蛋白,用BCA蛋白含量检测试剂盒测定蛋白浓度后。进行SDS-PAGE凝胶电泳,随后湿转至已用甲醇激活的PVDF膜上,用含5%脱脂奶粉的TBS室温封闭1 h,封闭后分别过夜孵育β-actin(1∶3 000 稀释)、GRP78(1∶4 000稀释)、Caspase12(1∶1 000 稀释)、GSDMD(1∶1 000稀释)、Caspase1(1∶1 000 稀释)、NLRP3(1∶1 000稀释)蛋白抗体,TBST洗涤6次,每次5 min,加荧光素偶联的羊抗兔IgG抗体(1∶3 000稀释)室温孵育1 h,TBST洗涤3次,每次5 min,TBS洗涤3次,每次5 min,上机对蛋白表达量进行检测[15]。
1.7 ELISA
收集各处理组细胞培养上清,根据相关因子细胞试剂盒说明书,按照操作步骤进行处理,用荧光酶标仪在450 nm测定吸光值,记录结果。
总体来看,五圩地区构造是由一群NNW走向呈弧形展布的压扭性构造形迹组合而成,这些构造形迹走向上向南东在三只羊附近收敛,向NNW逐渐撒开,展示了五圩帚状构造的形态,砥柱就在鸡峒小型隆起。从展布形式可以推断五圩地区构造是受顺时针的一对SN向力偶作用而产生的。由于各地处的边界条件不同,而产生不同方向的局部扭力,如五圩背斜西翼水落、三排洞一带扭力方向是逆时针的,而东翼拉简、九垒一带为顺时针的扭力。它们之间的关系就象齿轮衔接转动一样,一个反时针方向的扭动就带动相邻区的顺时针方向扭动。在两个不同方向扭动的交接部位,就产生一组扭裂带。箭猪坡矿床就刚好在扭裂带产生的部位,形成了箭猪坡矿床的构造形态。
1.8 CCK-8
按1×104个·孔-1密度接种于96孔板中,每组设6个复孔,于37 ℃,5% CO2细胞培养箱中培养,按照“1.4”试验设计组处理细胞后,每孔加入10 μL CCK-8溶液,于3 h后使用荧光酶标仪在450 nm测定吸光值,并记录其数据。
1.9 统计学分析
所有试验数据均经过3次独立试验的验证,试验数据采用GraphPad Priam 9.0软件中的T-test或One Way ANOVA进行统计学分析,数据用Tukey:Compare all pairs of columns柱状图表示。图中*代表显著差异(P<0.05),**代表差异极显著(P<0.01),***代表差异极显著(P<0.001)。
2 结 果
2.1 BCG感染巨噬细胞后ERS水平的检测
BCG感染THP-1细胞不同时间后,采用qRT-PCR和Western blot检测GRP78在mRNA水平和蛋白水平的表达,结果如图1所示。由图1可见,与未感染对照组相比,BCG感染组GRP78 mRNA水平的表达在2 h时差异不显著,在6 h之后随感染时间的延长显著上调(图1a,P<0.01);GRP78蛋白的表达随感染时间增加逐渐升高,48 h达到最高(图1b、c,P<0.01)。上述结果表明,BCG感染巨噬细胞后引起ERS的发生。
a. qRT-PCR检测GRP78 mRNA表达水平;b. Western blot检测GRP78蛋白表达水平;c. GRP78灰度值分析。*. P<0.05,**. P<0.01,***. P<0.001a. The mRNA expression of GRP78 detected by qRT-PCR; b. The protein expression of GRP78 detected by Western blot; c. Semi-quantification of GRP78. *. P<0.05,**. P<0.01,***. P<0.001图1 BCG感染THP-1细胞不同时间后GRP78表达水平Fig.1 The expression levels of GRP78 in THP-1 cells infected with BCG at different time
2.2 BCG感染后巨噬细胞焦亡的检测
为探究BCG感染巨噬细胞后对细胞焦亡的影响,采用Western blot检测GSDMD在蛋白水平的表达量,结果如图2所示。由图2可见,BCG感染THP-1细胞后,随着感染时间的延长GSDMD的表达量逐渐增加,24 h达到最高,48 h表达量有所下降(P<0.001),表明在BCG感染巨噬细胞24 h时细胞焦亡水平达到最高。
细胞发生焦亡现象后会在细胞膜上形成细胞膜孔洞,促进IL-1β和IL-18的成熟和释放。为此,采用qRT-PCR和ELISA分别检测了IL-1β和IL-18在mRNA表达水平及在细胞培养上清中的浓度,结果如图3所示。由图3可见,IL-1β和IL-18在mRNA水平的表达和在细胞培养上清中的浓度均随感染时间的增加而升高,12 h后均达到极显著水平(P<0.01或P<0.001)。
2.3 BCG感染巨噬细胞后ERS对细胞焦亡的调控作用
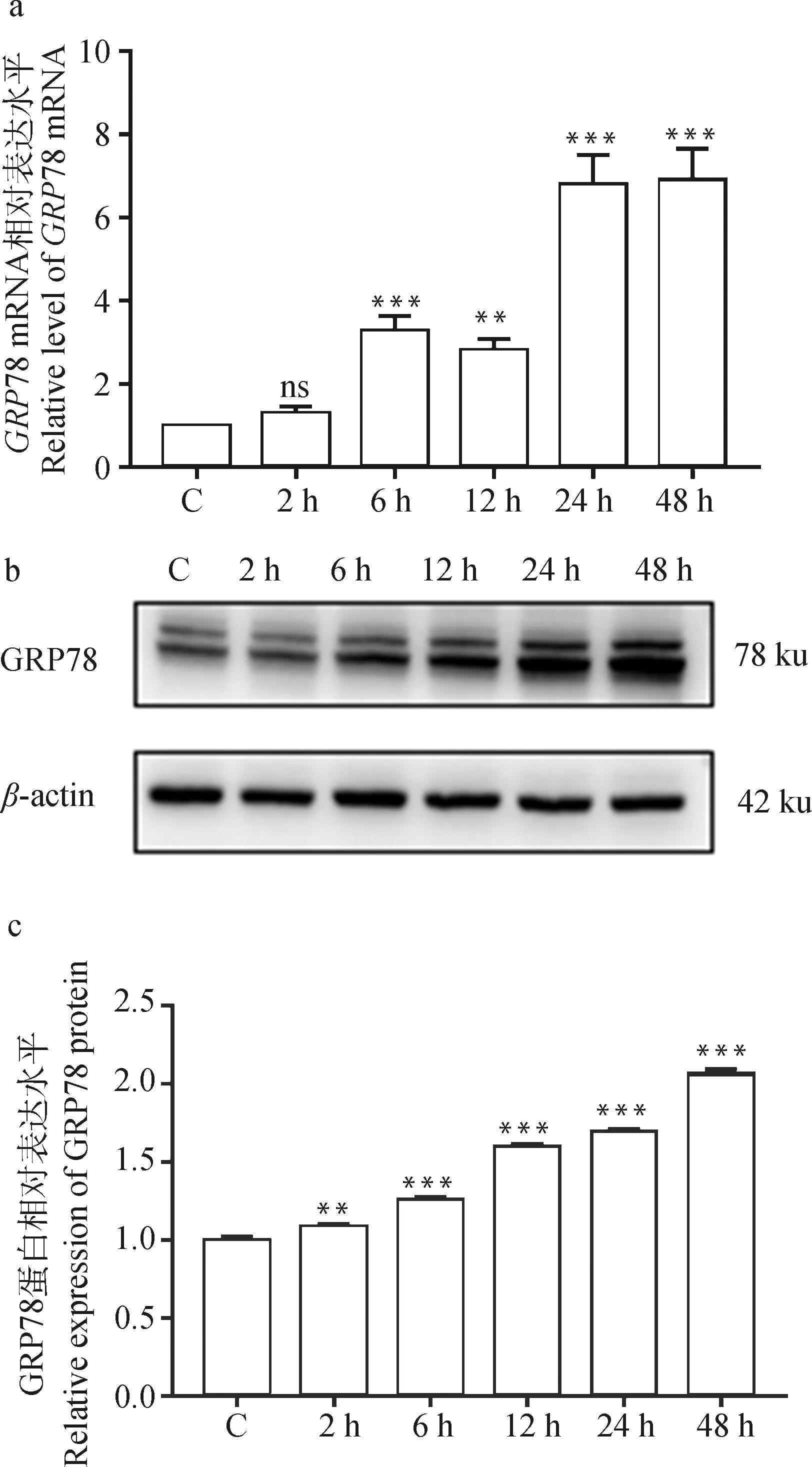
在BCG单独处理或与TUDCA共处理细胞24 h后,采用qRT-PCR和Western blot检测ERS标志性分子GRP78和Caspase12的表达量,结果如图4所示。由图4a可见,与未感染对照组相比,BCG感染组GRP78在mRNA水平表达上调(P<0.001),BCG和TUDCA共处理组与BCG感染组相比GRP78表达下调(P<0.01)。由图4b~d可见,与未感染对照组相比,BCG感染组GRP78和Caspase12在蛋白水平表达上调(P<0.001);与BCG单独感染组相比,BCG和TUDCA共处理组GRP78和Caspase12蛋白表达下调(P<0.001)。以上结果说明TUDCA能有效抑制BCG感染THP-1细胞后ERS的产生。

a. Western blot检测GSDMD蛋白表达水平;b. GSDMD灰度值分析。*. P<0.05,**. P<0.01,***. P<0.001a. The protein expression of GSDMD detected by Western blot; b. Semi-quantification of GSDMD. *. P<0.05,**. P<0.01,***. P<0.001图2 BCG感染THP-1细胞不同时间后GSDMD表达水平Fig.2 The expression levels of GSDMD in THP-1 cells infected with BCG at different time
为探究BCG感染巨噬细胞后ERS对细胞焦亡的影响。采用qRT-PCR和Western blot检测NLRP3、GSDMD、Caspase1在mRNA水平和蛋白水平的表达量,结果如图5所示。由图5可见,与未感染对照组相比,BCG感染组NLRP3、GSDMD、Caspase1在mRNA水平(图5a~c)和蛋白水平(图5d~g) 的表达均升高(P<0.05),而与BCG单独感染组相比BCG和TUDCA共处理组上述指标均显著下降(P<0.01)。
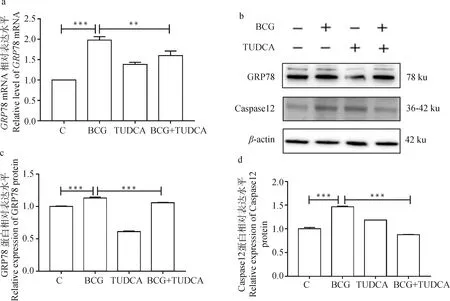
采用qRT-PCR和ELISA检测IL-1β和IL-18在mRNA水平的表达及在细胞培养上清中的浓度,结果如图6所示。由图6可见,与对照组相比,BCG感染组IL-1β和IL-18在mRNA水平的表达(图6a、b)及在细胞培养上清中的浓度(图6c、d)显著上调(P<0.01),而与BCG感染组相比,BCG和TUDCA共处理组IL-1β和IL-18的表达显著下调(P<0.01)。

a、b. qRT-PCR检测IL-1β和IL-18 mRNA表达水平; c、d. ELISA检测IL-1β和IL-18 浓度*. P<0.05,**. P<0.01,***. P<0.001a,b. The mRNA expression of IL-1β and IL-18 detected by qRT-PCR; c,d. The concentration of IL-1β and IL-18 detected by ELISA assay kit. *. P<0.05,**. P<0.01,***. P<0.001图3 BCG感染巨噬细胞不同时间炎性因子的检测Fig.3 Detection of inflammatory cytokines in THP-1 cells infected with BCG at different time
采用CCK-8检测细胞活性,结果如图7所示。由图7可见,与对照组相比,BCG感染THP-1细胞后,细胞存活率降低(P<0.001),而与BCG感染组相比,BCG和TUDCA共处理组细胞存活率上升(P<0.001)。
以上结果表明,BCG感染巨噬细胞引起ERS的产生,进而激活NLRP3炎性小体,介导巨噬细胞的焦亡。
a. qRT-PCR检测GRP78 mRNA表达水平;b. Western blot检测GRP78和Caspase12蛋白表达水平;c、d. GRP78和Caspase12灰度值分析。*. P<0.05,**. P<0.01,***. P<0.001a. The mRNA expression of GRP78 detected by qRT-PCR; b. The protein expression of GRP78 and Caspase12 detected by Western blot; c,d. Semi-quantification of GRP78 and Caspase12. *. P<0.05,**. P<0.01,***. P<0.001图4 BCG感染THP-1细胞后TUDCA对ERS的影响Fig.4 The effect of TUDCA on ERS in THP-1 cells infected with BCG
3 讨 论
迄今为止,结核病已成为世界重大公共卫生问题之一,其主要的致病菌是Mtb。Mtb感染开始于远端气道,最终传播到肺间质。巨噬细胞是Mtb主要的宿主细胞与靶细胞,当Mtb入侵时,巨噬细胞会通过吞噬溶酶体的形成主动吞噬病原菌并与其发生复杂的相互作用[16]。此外,牛结核分枝杆菌也是引起人类结核病的病原之一。因此,深入研究Mtb的致病机制,将有助于进一步控制结核病的发病。
在真核细胞中,内质网是细胞内蛋白质、脂类和糖类合成的基地,细胞内未折叠或错误折叠蛋白的积累以及细胞内Ca2+的失衡等多种因素均可诱发ERS。ERS与多种疾病的发生发展有关,如动脉粥样硬化[17]、糖尿病肾病[18]、帕金森病[19]、阿尔兹海默病[20]。已有研究表明,Mtb感染巨噬细胞会损害内质网进而诱发ERS[7]。本研究结果显示,在BCG感染巨噬细胞后ERS标志性分子的表达呈现出上调趋势,表明ERS与结核病的发生存在着内在的联系。
细胞焦亡的概念于2001年被提出,是一种炎症性的细胞死亡方式[21],涉及Caspase1介导的经典途径和Caspase4/5/11介导的非经典途径两条途径,活化的Caspase1/4/5 /11不仅可切割GSDMD为GSDMD-N,使其在质膜上寡聚化形成细胞膜孔洞,还促进IL-1β和IL-18的成熟与释放[11]。研究表明,有多种刺激因素可以促使细胞焦亡。对于胞内菌感染导致的细胞焦亡而言,其主要的表现为促进机体发生炎症反应,将更多的免疫细胞募集至感染病灶,这一过程有助于巨噬细胞清除胞内菌抵抗感染[22]。有研究表明,Mtb作为一种典型的胞内寄生菌,在感染巨噬细胞后会使细胞发生焦亡[23-24]。本研究结果显示,BCG感染巨噬细胞后,细胞焦亡标志性分子GSDMD的表达上调,表明BCG感染巨噬细胞后,能够引起细胞焦亡。
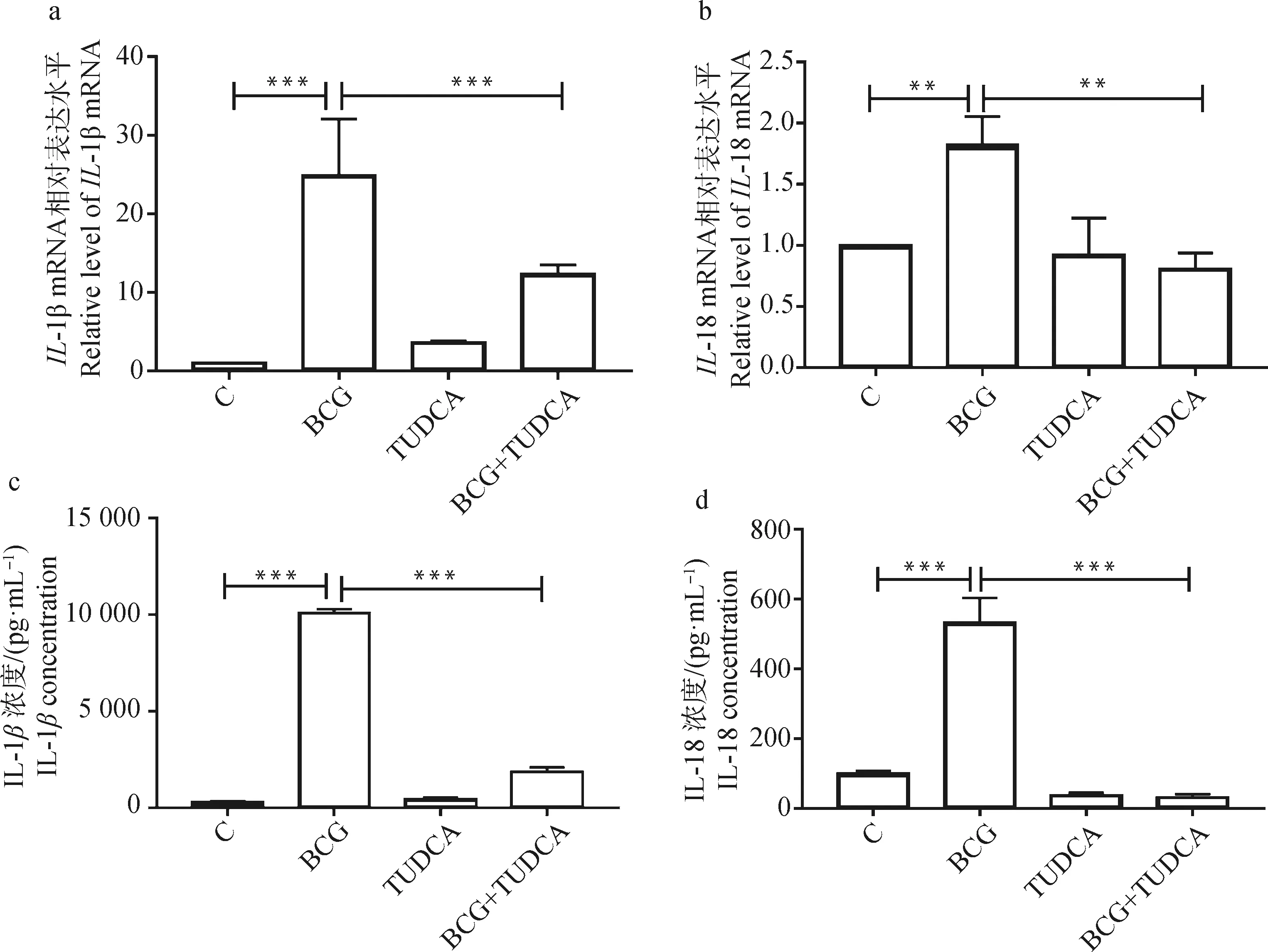
a、b. qRT-PCR检测IL-1β和IL-18 mRNA表达水平; c、d. ELISA检测IL-1β和IL-18 浓度。*. P<0.05,**. P<0.01,***. P<0.001a, b. The mRNA expression of IL-1β and IL-18 detected by qRT-PCR; c, d. The concentration of IL-1β and IL-18 detected by ELISA assay kit. *. P<0.05,**.P<0.01,***. P<0.001图6 BCG感染THP-1细胞后ERS对炎性因子的影响Fig.6 The effect of ERS on inflammatory cytokines in THP-1 cells infected with BCG
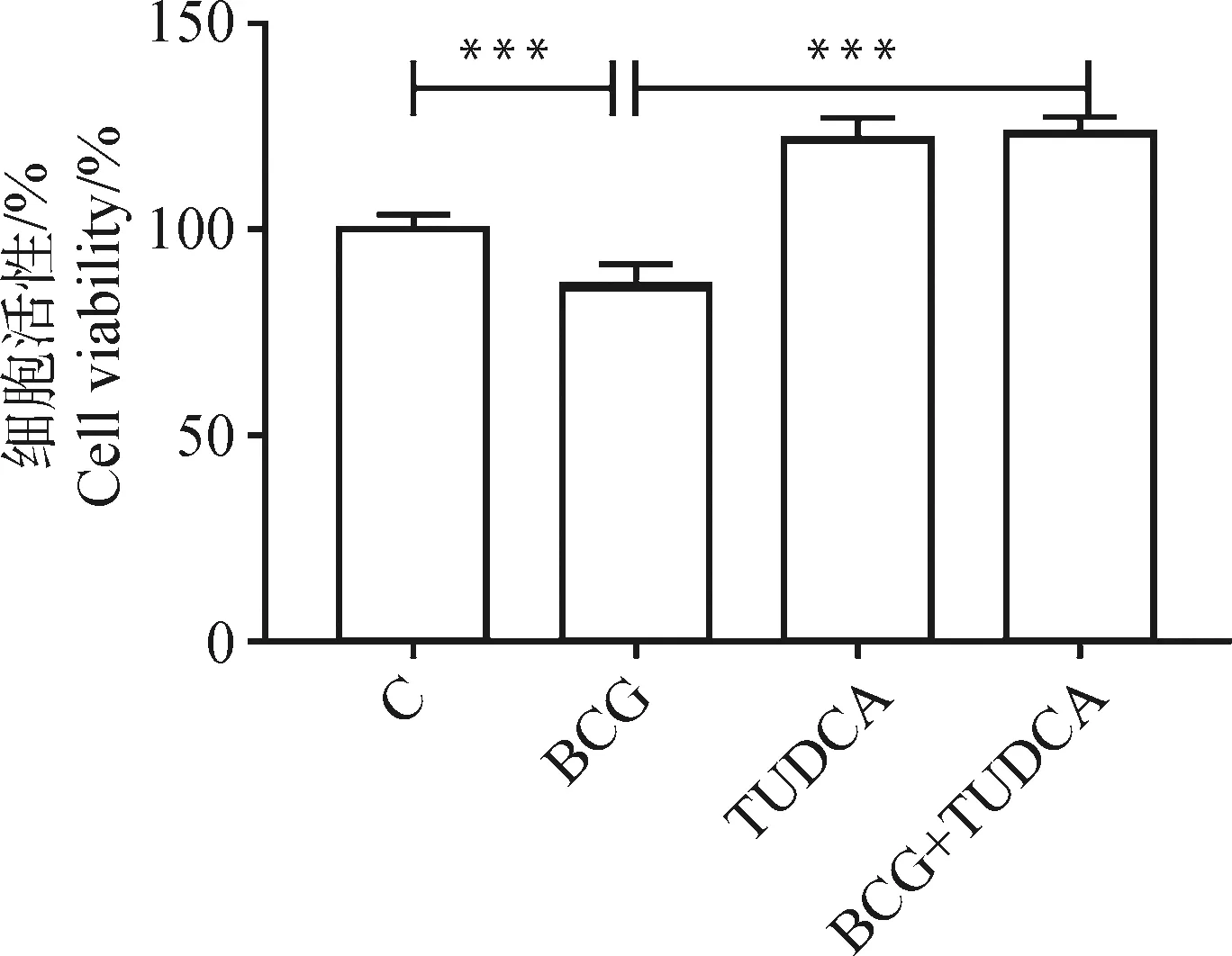
*. P<0.05,**. P<0.01,***. P<0.001图7 BCG感染THP-1细胞后ERS对细胞增殖的影响Fig.7 The effect of ERS on cell proliferation in THP-1 cells infected with BCG
近年来研究发现,ERS与细胞焦亡之间存在复杂的相互作用联系,NLRP3作为重要的先天免疫模式识别受体,在此过程中发挥重要作用[25]。已有研究证明,ERS参与了NLRP3炎性小体的活化[26-27],而炎性小体活化又可引起细胞焦亡[23, 28]。NLRP3炎性小体是目前研究最多的炎性小体,能被多种类型的外源物质或自身危险信号激活,其激活需要两个信号:第一个信号,由损伤相关分子模式(DAMPs)或病原菌相关分子模式(PAMPs)的识别所诱导启动Pro-IL-1β和Pro-IL-18的表达;第二个信号由活化的NOD样受体触发PAMPs,促进炎症小体的组装,招募并激活Caspase1[29-30]。活化的Caspase1剪切GSDMD,使GSDMD的N末端结构域释放,促进IL-1β和IL-18的成熟与释放,引发细胞焦亡[31]。本研究为了揭示BCG感染巨噬细胞后ERS对细胞焦亡的影响,在用TUDCA处理巨噬细胞后,检测了ERS相关分子、细胞焦亡相关分子、NLRP3、IL-1β和IL-18的表达差异。研究结果显示,BCG感染巨噬细胞后上述分子表达上调,而TUDCA对上述反应具有明显抑制作用,表明在BCG感染巨噬细胞后诱发的ERS对细胞焦亡具有一定的调控作用。
综合以上研究结果,表明在BCG感染巨噬细胞后,诱发了ERS的产生,进而引起巨噬细胞的焦亡(图8),本研究结果将为结核病的发病机制提供新的视角。
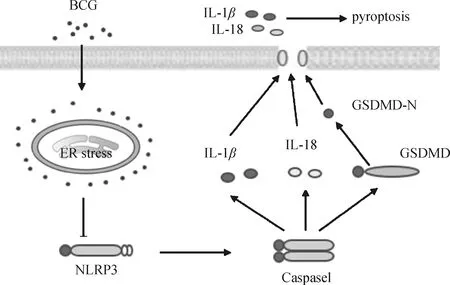
图8 BCG感染巨噬细胞后ERS对细胞焦亡调控的可能机制Fig.8 Proposed model for funcational mechanism of ERS in regulating of pyrotosis after BCG infected macrophages
4 结 论
BCG感染巨噬细胞后引起了ERS的产生和NLRP3炎性小体的活化,并进一步介导了巨噬细胞的焦亡。
