动物源产气荚膜梭菌耐药性研究进展
2021-11-04张仕泓王少林
张仕泓,王少林
(中国农业大学动物医学院,北京 100193)
产气荚膜梭菌(Clostridiumperfringens)是革兰阳性厌氧芽胞杆菌,美国病理学家William H. Welch首次在尸体中分离到该细菌[1],因此该菌被称为魏氏梭菌。因其能分解肌肉和结缔组织中的糖并产生气体,能在动物组织中产生荚膜[2],故又被命名为产气荚膜梭菌。产气荚膜梭菌广泛存在于土壤、人和动物的肠道以及粪便中。最近的一项研究利用宏基因组测序技术对5 000年前新石器时代木乃伊化的“提洛尔人”进行胃肠道菌群分析,结果证明了产气荚膜梭菌的存在[3]。
产气荚膜梭菌是导致英国食源性疾病暴发的第三大原因[4]。美国疾控中心数据显示,产气荚膜梭菌已经成为继诺如病毒和沙门菌之后的又一大能够引起食物中毒的原因[5]。我国北京[6]、浙江[7]等地出现了多起产气荚膜梭菌引起的食源性疾病报道。同时,在英国[8]、希腊[9]、法国[10]、美国[11]、缅甸[12]也出现了相似的报道。
随着抗菌药物的广泛应用,产气荚膜梭菌的耐药性日益严重,尤其是临床强毒株逐渐出现了多重耐药的特点,强毒株的进化与快速适应势必会对食品安全和人类健康造成威胁[13]。本文在过去研究的基础上,对产气荚膜梭菌近十年的耐药性流行情况、耐药机制及耐药基因传播机制两个方面进行归纳总结,旨在为产气荚膜梭菌的防控提供理论依据。
1 产气荚膜梭菌耐药性流行情况
动物源产气荚膜梭菌作为梭菌属和厌氧菌的一种,其受关注度远低于常见动物源致病性大肠埃希菌、金黄色葡萄球菌、沙门菌等常见人兽共患致病菌。目前,世界上最主要的两个细菌耐药性监测系统,美国全国肠道细菌耐药性监测系统(The National Antimicrobial Resistance Monitoring System for Enteric Bacteria,NARMS),欧洲食品安全局(European Food Safety Authority, EFSA),在2019年监测报告中[14-15]均未报道产气荚膜梭菌的相关耐药数据,同时也包括芬兰[16]、挪威[17]、瑞典[18]、丹麦[19]。因此,产气荚膜梭菌的耐药性流行情况尚未引起足够的关注。

亚洲其他地区,伊朗(2019)的一篇文献报道了产气荚膜梭菌已经对杆菌肽产生了严重的耐药性,耐药率达到了89.1%[28],相同的情况也出现在中国[25]。杆菌肽作为一种促生长抗菌药物,在2018年中国兽用抗菌药物使用情况报告中,以销量1 259.125 t在所有促生长药物销量中排名第三[29],因此菌株出现严重的抗菌肽耐药情况可能与饲养端大量使用该药物有着不可分割的关系。韩国在2011年颁布了AGPs (Antimicrobial growth promoters)禁令后,研究发现,该举措并没有导致产气荚膜梭菌耐药性的全面下降,9种抗菌药物(青霉素、四环素、泰乐霉素、红霉素、氟苯尼考、恩诺沙星、莫诺霉素、盐霉素和马杜霉素)的MIC50和MIC90值均高于颁布AGPs禁令之前的数值,分析可能是因为在没有AGPs使用的情况下,其他抗菌药物使用增加的结果。因此,终止在动物饲料中的AGPs,可能不会对抗菌药物耐药性产生重大的影响[30]。中国于2020年在饲料端全面禁抗,国内产气荚膜梭菌在禁抗之后的耐药性是否有所变化,还需要等待后续文献报告。
作者课题组在2019年和2020年分别对中国山西省、河北省、陕西省、北京市、内蒙古自治区进行了产气荚膜梭菌耐药性监测,分离得到367株菌株,其中2019年共分离188株,牛源分离率5.6%,鸡源分离率23.8%,总分离率20.4%。2020年共分离179株,牛源分离率66.7%,鸡源分离率12.1%,猪源分离率60.0%。通过对分离菌株的药物敏感性试验,发现大部分菌株对叶酸代谢途径抑制剂类药物和大环内酯类药物耐药率较高,对β-内酰胺类/β-内酰胺酶抑制剂复合物最敏感。
综合以上分析,除了中国部分地区[20,31-33],在一些亚洲国家,如印度[34]、韩国[35]、约旦[36]、泰国[37],大多数分离菌株均对β-内酰胺类/β-内酰胺酶抑制剂复合物维持在较高的敏感水平。同时,除了常见的四环素类高耐药表型之外,各地菌株对氨基糖苷类药物、氟喹诺酮类药物、磺胺类药物、林可胺类药物、杆菌肽等也呈现高耐药表型。
欧洲地区,如意大利[38]、瑞士[39],除了报道了产气荚膜梭菌常见的四环素耐药表型,同时还发现和上述亚洲地区菌株同样的耐药情况。此外,在法国和德国,还报道了克林霉素[40]、大观霉素、新霉素和黏杆菌素[41-42]的耐药表型。常用于厌氧菌感染治疗的甲硝唑也出现敏感性下降的趋势[39]。在一项西班牙马德里动物园水源分离菌株的研究中,发现多数分离菌株对甲硝唑中度敏感(57.1%,MIC≥16 μg·mL-1),有5.7%的菌株耐药(MIC≥32 μg·mL-1)。 未发现其他抗生素耐药,但是部分菌株对红霉素和利奈唑胺MIC升高[43]。
美洲地区,大环内酯类、氨基糖苷类和林可酰胺类耐药性相对而言较为严重,一项在美国(2019)的针对肉鸡源产气荚膜梭菌的耐药性研究发现,链霉素和庆大霉素的耐药率达到98%和73%,红霉素的耐药率也达到了67%[44]。两篇分别在巴西[45]、加拿大[46]的文献报告了林可霉素和克林霉素的高耐药率,相似的报告还出现在哥斯达黎加[47],此外,多数报告[44,48-49]表明大部分菌株依旧对β-内酰胺类/β-内酰胺酶抑制剂复合物敏感。
综合欧美各地药物敏感性报告,我们发现分离菌株对氨基糖苷类药物(如链霉素和庆大霉素)、大环内酯类药物(如红霉素)耐药情况较为严重。此外,常用厌氧菌感染药物甲硝唑也出现了敏感性下降的趋势。大部分菌株虽对β-内酰胺类药物/β-内酰胺酶抑制剂复合物有部分耐药,但总体而言维持在较好的敏感水平,这和亚洲地区的报道是一致的。
2 产气荚膜梭菌耐药机制及耐药基因传播机制
2.1 常见耐药机制
2.1.1 四环素耐药 四环素类抗生素是广谱抗生素,具有广泛的活性,其能够通过与30S核糖体亚基可逆结合,阻止氨酰tRNA与核糖体受体(α)位点结合,从而阻止细菌蛋白质的合成[50]。
四环素耐药是产气荚膜梭菌耐药中较为常见的耐药表型[51]。1968年,Johnstone和Cockcroft[52]第一次在102株产气荚膜梭菌中发现了11株菌对四环素具有某种程度上的耐药。在3株从猪粪分离菌株中,首次确定四环素耐药性是由质粒携带[53]。产气荚膜梭菌对四环素的抗性,较为常见的是从鸡身上分离的菌株,其次是从临床样本、土壤和食物中分离的菌株[51]。产气荚膜梭菌四环素主要耐药基因包括tetA(P)、tetB(P)、tet(M)、tet(L)、tet(K)、tet(Q)等,tetA(P)、tetB(P)、tet(M)3种基因决定簇较为常见。其中,根据相关研究报道,tetA(P)又是3种基因之中较为常见的[54]。大多数耐药分离菌株除了携带tetA(P)之外,还携带着第二种耐药基因,即tetB(P)或者tet(M)[55]。tetA(P)编码一个四环素外排蛋白,tetB(P)编码一个与核糖体保护有关的类tet(M)四环素耐药胞质蛋白[56]。tet(M)能编码一种保护核糖体免受四环素作用的细胞质蛋白,并且其在四环素耐药基因中宿主范围广[57]。tet(K)、tet(L)编码的蛋白与tetA(P)功能基本相似,均为四环素外排泵蛋白[13]。
四环素耐药基因可以通过质粒进行接合转移。Rood等(1985)[53]发现,猪源产气荚膜梭菌四环素耐药基因位于可接合R-质粒上,且发现在产气荚膜梭菌上检测到的接合型R质粒均源自pCW3-like质粒。Lyras和Rood(1996)[55]发现猪源产气荚膜梭菌的接合型质粒携带tetA(P)、tetB(P)基因。随后,Park等(2010)[51]发现tetB(P)基因可在鸡源产气荚膜梭菌中发生转移。
2.1.2 杆菌肽耐药 介导产气荚膜梭菌杆菌肽的耐药基因为bcrRABD,该基因由来自接合型质粒中的一个类Tn916的元件ICECp1携带[58]。bcrD能编码一种十二葵烯醇激酶[59],这种激酶能够将十二葵烯醇转化为UP,后者能阻止杆菌肽结合到UPP上,从而实现对杆菌肽的耐药[60];bcrA与bcrB由于与粪肠球菌中bcrA与bcrB具有高度的相似性,因此被推测和粪肠球菌一致,编码一种ABC(ATP-binding cassette)转运体,能够把杆菌肽高效排到细胞膜外,从而实现耐药[61]。bcrR序列被怀疑和粪肠球菌bcrR一致,能够翻译一种杆菌肽利用度的传感器,实现细菌内杆菌肽的含量传感和监测[59]。
董卫超等(2011)[13]在鉴定杆菌肽锌耐药A型产气荚膜梭菌bcrABDR基因的基础上,进一步通过接合试验、质粒杂交试验和全基因组测序,证实了该基因位于约26 kb的接合型转座子上,并暂时命名为Tn4455。该转座子可携带杆菌肽锌耐药基因发生一定频率的接合转移(1.2×10-6~2.8×10-1)。
2.1.3 大环内酯类耐药 产气荚膜梭菌对大环内酯类药物的耐药早有报道[62],其耐药机制主要是由erm基因和mef基因介导,其中erm基因不仅局限于大环内酯类抗生素,同时对大环内酯类-林可胺类-链阳霉素类(macrolide-lincosamide-streptogramin B, MLSB)三类药物同时耐药。产气荚膜梭菌中的红霉素抗性常常被erm(Q)基因所介导,但也能够被erm(B)基因介导,且它们也被发现与可移动元件相关,能在种属间进行传播[54]。1994、1995年,在猪和人源梭菌中检测到产气荚膜梭菌ermBP和erm(Q)基因[13]。1977年,在猪源产气荚膜梭菌中发现,ermBP基因位于可诱动的非接合质粒上。2008年,Soge等[54]首次在产气荚膜梭菌中发现携带着的mef(A)基因,且该基因与移动元件相关,因此可在种属间进行传播。
以上现象均提示大环内酯类耐药基因已经在动物、环境和人源中广泛存在[13]。
2.1.4 林可胺类耐药 产气荚膜梭菌对林可胺类药物的耐药性,主要由lnu基因家族编码的林可霉素核苷酸转移酶介导[13]。Martel等(2004)[63]首次在产气荚膜梭菌中发现了能编码核转移酶的lnu(A)与lnu(B)基因(之前被称之为lin基因),能够编码通过腺苷酸化使林可酰胺类药物失活的O-核苷酸转移酶[64-65]。此外,一项澳大利亚的研究表明,对林可霉素耐药但对红霉素敏感的产气荚膜梭菌,其耐药决定簇是由pJIR2774质粒携带的,并且可以通过接合转移到其他产气荚膜梭菌菌株上,后来发现是lnu(P)基因编码该抗性,这是首个被鉴定为不具有四环素耐药性的接合型产气荚膜梭菌耐药质粒。lnu(P)基因编码一个假定的林可胺类药物核苷酸转移酶,位于功能性转座遗传元件tISCpe8上,后者是第一个在产气荚膜梭菌中表现出转位的类插入元件的抗性元件。tISCpe8在抗性基因中携带一个功能性的转移起点,能够使抗性基因转移到其他基因上[66]。
2.1.5 氯霉素类耐药 氯霉素抗性是由cat(P)和cat(Q)编码的氯霉素乙酰转移酶介导的[67]。产气荚膜梭菌对氯霉素的抗性位于产气荚膜梭菌的可动员转座子上,包括相互关系密切的Tn4451和Tn4452,其具有编码动员功能,但是本身不是接合型的转座遗传元件,为了接合,它们依靠共居接合元件来促进它们向受体细胞转移[68]。1989年,证实了猪源产气荚膜梭菌catP位于接合型质粒pIP401上。1998年报道catD基因的扩散与Tn4451和Tn4453密切关联[13]。Tn4451以一种不寻常的转位编码了对氯霉素的抗性,这种不寻常的转位依赖于一个大的分解蛋白,而不是传统意义上的转座酶或者整合酶。同时,Tn4451编码动员蛋白TnpZ,能作用于RS(A)或者oriT位点,并在共居接合元件的存在下,促进非复制环形中间体和转座子所在质粒的运动[68]。
2.2 近年来新出现的耐药机制及相关研究
2.2.1 噁唑烷酮类耐药 噁唑烷酮类药物作为一种新型化学合成的抗菌药物,用于治疗人医临床上革兰阳性细菌感染的疾病,如临床上重要的耐药革兰阳性菌MRSA(methicillin-resistantStaphylococcusaureus,耐甲氧西林金黄色葡萄球菌)、VRE(vancomycin-resistantEnterococcus,耐万古霉素肠球菌)等。该类化合物能够和50S亚基的A位点结合,使其不能和fMet-tRNA结合形成70S功能性复合物,进一步阻止细菌蛋白质的合成,从而产生抗菌作用[69]。
利奈唑胺是噁唑烷酮类药物中第1个有药理活性,且第1个用于临床的人工合成噁唑烷酮类药物。目前,已经有3个主要的可转移的噁唑烷酮耐药基因,分别为cfr、optrA和poxtA。其中,optrA基因能够编码一种ATP结合盒蛋白,并且能通过保护细菌核糖体使细菌产生抗药性[70]。Hölzel等(2010)[71]在其研究的产气荚膜菌株中发现了一个新的突变,导致了核糖体蛋白质L4的高度保守区域63KPWRQKGTGRAR74中的氨基酸交换(71G→71D), 而该区域的突变,已经被证明与肺炎链球菌对噁唑烷酮、氟苯尼考的耐药性相关[72],因此该区域的变化很可能与产气荚膜梭菌对利奈唑胺耐药机制有关。周宇晴等[73]在2020年首次在一株鸡源产气荚膜梭菌上检测到一个携带optrA基因的质粒p2C45,其能介导该株产气荚膜梭菌对利奈唑胺耐药(16 mg·L-1),同时介导对氟苯尼考耐药(128 mg·L-1)。 噁唑烷酮类药物尚未被批准于兽用,因此产气荚膜梭菌很可能是噁唑烷酮类耐药基因的贮存者,不能排除optrA从产气荚膜梭菌中传播到其他革兰阳性厌氧菌中的可能性[73]。
作者在2019年分离到的牛源产气荚膜梭菌中也发现了optrA基因,并与fexA基因同时存在,说明optrA基因已经在国内的产气荚膜梭菌中开始传播。产气荚膜梭菌主要耐药表型、基因以及机制见表1。
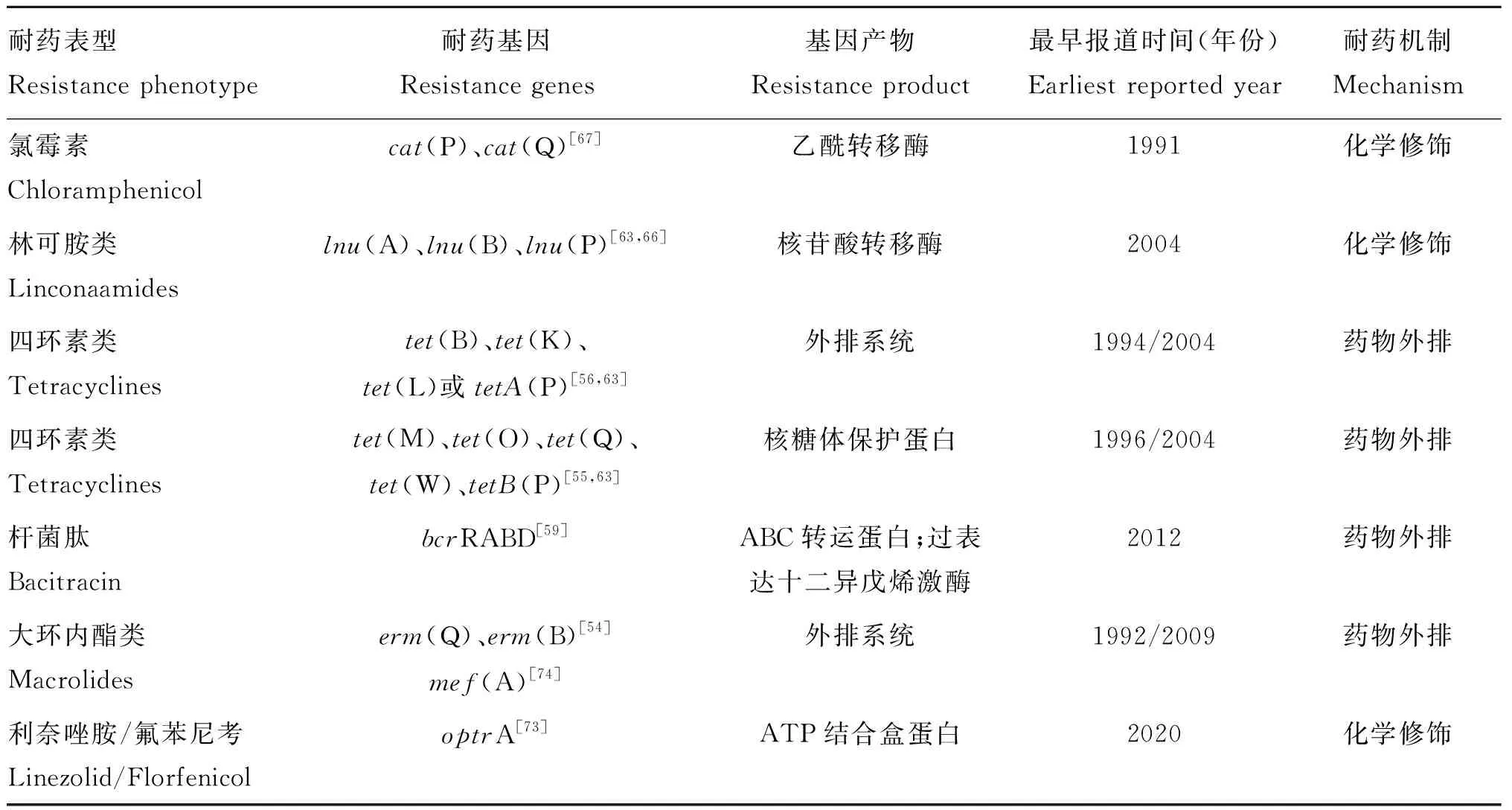
表1 产气荚膜梭菌主要耐药表型、基因以及机制
2.2.2 生物被膜 生物被膜是一种结构化的细菌细胞群落,包裹在自产的胞外多糖基质中,提供了对环境压力的抵抗力,和浮游细胞相比,具有生物被膜的细菌对抗生素更具有抵抗性[75]。同时,细菌吸附在多糖蛋白复合物上产生的水解酶和过氧化氢酶能够水解抗生素;另外,细菌形成生物膜后,胞内细菌受到营养物质和代谢产物的运输和排泄阻碍,多处于休眠状态,对抗生素不敏感[76]。
产气荚膜梭菌生物被膜在其耐药性中扮演着重要角色。将有生物膜的产气荚膜梭菌和浮游菌暴露在高浓度的青霉素溶液中(20 g·mL-1),其存活率比浮游菌高出了5~15倍[77]。少数产气荚膜梭菌在暴露于低剂量的泰乐菌素、杆菌肽、维吉尼亚霉素和莫能菌素时,生物被膜增加,具有生物被膜的菌株存活率是浮游菌的0.6~9.0倍,24 h后达到0.8~36.0倍[76,78]。在另外一项研究还发现,产气荚膜梭菌生物膜可以保护细菌细胞免受常用消毒剂,比如硫酸氢钾、氯化铵、过氧化氢和戊二醛的作用[79]。
2.2.3 适应性 细菌的适应性是指细菌为了适应不同的环境而调整自身代谢的能力。耐药性的维持和传播通常会导致细菌适应性的降低,表现为细菌生长速率、毒性和传播的减弱。影响抗生素耐药性进化速度和传播轨迹的一个关键参数是耐药性的适应性代价[80]。
已有研究报道,对氟喹诺酮类药物的耐药性已经影响到了艰难梭菌的代谢,包括毒素的产生[81],但关于产气荚膜梭菌耐药性影响适应性报告却很有限。Park等(2013)[82]第一次研究了产气荚膜梭菌耐药性对其本身适应性的影响。利用3株野生株和9株突变株,进行3种不同氟喹诺酮类抗药性对细菌适应度的影响。作者发现,在一系列没有药物的纯培养基中,每一个突变体的生长都与相应的野生株相当,然而,在突变体和同基因野生型的竞争试验中,有些突变株在竞争试验中的生长速率被发现较差;3株耐环丙沙星突变体的生长速率基本相同,但是两株耐加替沙星的生长速率明显低于相应的野生型。因此,作者得出结论,诱导产生的耐药性也可能会降低耐药菌株本身的适应性。关于耐药性是否会影响到产气荚膜梭菌本身的代谢以及不同毒力型下毒素的强弱,还需要后续文献报道。

2017年,在一株产气荚膜梭菌上发现了多重耐药基因mepA[86],其作用底物非常广泛,包括染料、杀虫剂、氟喹诺酮类等抗菌药物[87]。Ma等(2018)[88]利用转录组测序技术(RNA-Seq)从一株产气荚膜梭菌多重耐药分离株中筛选出1 128个差异表达基因(DEGs),其中上调227个,下调901个。生物信息学分析确定了可能参与了涉及多重耐药性的基因类型:如药物转运、药物反应、跨膜转运蛋白、ATP结合盒转运蛋白家族和β-内酰胺耐药基因等生物学途径。此外,双向电泳(2-DE)和质谱法(MS)鉴定出27个差异表达蛋白(DEPs),包括核糖体、抗菌肽抗性和 ABC转运蛋白等蛋白类型。作者推测,这些蛋白类型可能与分离株的多药耐药性有关。
3 结 语
综上所述,产气荚膜梭菌对常用抗菌药物耐药机制具有多样性(表1),尤其是近年来发现的噁唑烷酮类抗生素optrA耐药基因,严重威胁到公共卫生和健康。总结亚洲地区和欧美地区产气荚膜梭菌耐药性流行性情况发现,部分地区已经出现了部分菌株对β-内酰胺类药物和甲硝唑耐药。β-内酰胺类药物作为对产气荚膜梭菌强敏感性药物,甲硝唑作为常用厌氧菌感染用药,在动物产气荚膜梭菌病的治疗中发挥着重要的作用。这两种药物出现耐药的现象警示人们,在动物临床治疗上,应该遵循用药方案,合理用药,避免耐药性的过快增长,从而更好地预防潜在的动物卫生和食物安全问题,保护人类自身的健康。
