APN/CD13抑制剂乌苯美司:一个抗肿瘤化疗药物分子伴侣
2021-11-04马玉倩邢晓燕葛彬彬李玉天姜文妍贾海永徐文方王学健
马玉倩,邢晓燕,葛彬彬,李玉天,姜文妍,贾海永,徐文方,王学健
(1. 潍坊医学院,山东 潍坊 261053;2. 青岛海洋生物医学研究所,山东 青岛 266100)
近年来肿瘤发病率逐步上升,已成为一种常见疾病,严重损害人类健康。据中国国家癌症中心数据显示,我国每天有一万多人确诊癌症,相当于平均每分钟就有7个人患上癌症。肺癌的发病率和死亡率均居首位,发病人数每年约有78.1万,胃癌、结直肠癌等癌症的发病率也居高不下[1]。目前,针对肿瘤的治疗手段已取得了巨大进步,包括手术、全身放疗及药物治疗等。虽然细胞毒类药物毒性大,耐受性较差,但杀死肿瘤细胞作用明显,因此依然是抗肿瘤治疗中的“主力军”。然而,如何增强该类药物的疗效、降低毒副作用,是目前面临的重要问题。
氨肽酶N(aminopeptidase N,APN,又称CD13),是Ⅱ型Zn2+依赖性的跨膜-金属蛋白酶,广泛分布在哺乳动物的肾脏、小肠、肝脏及中枢神经系统中,并且在多种肿瘤细胞中高表达,进而促进肿瘤细胞增殖、转移和血管生成[2]。CD13是半静息态肝癌干细胞(liver cancer stem cells,LCSC)的生物标记物,作为抑制LCSC的靶点可抑制肝癌引起的耐药、复发、侵袭和转移。因此,CD13+细胞有望在肿瘤干细胞靶向治疗中发挥巨大作用[3]。与此同时,来自大阪大学的科学家们发现,与CD13低表达组相比,CD13高表达组患者复发率更早,存活时间更短,得出CD13富集与肝癌患者的早期复发和不良预后相关。因此,找到CD13抑制剂尤为重要。目前上市的唯一APN抑制剂—乌苯美司(Ubneimex),也称Bestatin,化学名为N-[(2S,3R)-3-氨基-2-羟基-4-苯丁酰]-L-亮氨酸,1987年在日本率先上市,常作为免疫增强剂治疗白血病或其他抗癌药的辅助用药[4]。近几年研究发现,乌苯美司对实体瘤的治疗也有较好的应用前景,可以在一定程度上抑制胃癌、非小细胞肺癌和非转移性膀胱癌,并能够延长病人的生存期。
在临床实践中,联合用药通过发挥药物的协同抗肿瘤作用能够达到提高药物疗效或减轻药物毒副作用的目的,逐渐成为肿瘤治疗的研究热点。有研究表明,乌苯美司可与细胞毒类药物联合用药,有效抑制肿瘤细胞生长,增强抗肿瘤的免疫功能,显著提高患者长期生存率。Hu等[5]通过检索相关数据库,将乌苯美司对恶性肿瘤患者生存率影响的随机试验纳入Meta分析,采用两组间生存率比值(OR)和95%置信区间(95% CI)评价乌苯美司的疗效。发现在乌苯美司组和对照组之间,1年OR为1.40 (95% CI =1.06-1.85),2年OR为1.43 (95% CI =1.08-1.89),3年OR为1.39 (95% CI =1.07-1.81)。结果表明,规范化联合乌苯美司治疗方案能提高恶性肿瘤患者的生存率。因此,细胞毒类药物联合乌苯美司的疗法有望成为恶性肿瘤治疗的新方案。
1 乌苯美司增强细胞毒类药物抗肿瘤作用
乌苯美司是最早发现的APN抑制剂,有较好的抗肿瘤活性。细胞毒类药物毒性大,耐受性较差,但杀死肿瘤细胞作用明显。因此将乌苯美司与细胞毒类药物联合使用有着安全性高、耐受性好、毒副作用低、增强抗肿瘤作用的优势(Tab 1)。

1.1 对肝癌的研究肝细胞性肝癌(hepatocellular carcinoma,HCC)是常见的肝原发恶性肿瘤,由于其治疗易复发、易转移,目前还未有特效药物可治愈。黄小鹰[6]等医师采用华蟾素+乌苯美司的临床方案治疗中、晚期原发性肝癌患者,发现治疗缓解率明显提高,天冬氨酸转氨酶(AST)、总胆红素(TBIL)、谷氨酸转氨酶(ALT)水平急剧下降,药物不良反应发生率低。乌苯美司具有诱导肿瘤细胞凋亡的效果,华蟾素本身具有抑制细小血管生长及供血的作用,两者联合后,可持续诱导肿瘤细胞发生凋亡,阻止肿瘤出现血管异生,抑制肿瘤持续生长。并且联合之后可缓解患者治疗过程中多种不适,增强治疗依从性。有研究者进一步研究乌苯美司联合化疗药物治疗肝癌的作用机制,Yamashita等[7]研究了乌苯美司与常规化疗药物氟尿嘧啶(5-FU)、顺铂(CDDP)、阿霉素(DXR)和索拉非尼(SOR)联合应用的抗肿瘤作用,研究发现普通肝癌细胞单用化疗药处理后,CD13表达上调,合用CD13抑制剂Ubenimex后,G0/G1期的细胞比例降低,细胞凋亡和细胞内活性氧(ROS)水平上调,进而增加细胞对化疗药的敏感性。
1.2 对肺癌的作用研究肺癌是常见的恶性肿瘤之一,其发病率和死亡率明显上升,对人类的健康和生命构成较大威胁。乌苯美司具有明显的抗肿瘤作用和增强免疫作用,乌苯美司联合用药可明显改善患者的免疫功能,用做患者的辅助用药。麻青等[8]基于紫杉醇与顺铂的常规化疗方案上联合使用乌苯美司,CD4+、CD4+/CD8+和自然杀伤(NK)细胞在治疗后显著高于对照组,但CD8+水平明显低于对照组,且联合用药组的肺癌患者Ⅲ-Ⅳ级白细胞减少,部分毒副反应发生率明显低于对照组,因此可得出联合用药组能明显提高化疗效果,改善患者免疫功能,并减少部分毒副作用发生的结论。
1.3 对胃癌的研究胃癌单一药物化疗的缓解率低,而联合化疗后可提高缓解率、延长生存期。乌苯美司作为一种新型的抗肿瘤药物,近年来在晚期治疗和术后胃癌方面取得了一定的疗效,使得胃癌的化疗有明显的改善。赵伟峰等[9]分析96例符合入组标准的胃癌晚期患者的临床资料,依据用药方案的不同分为两组:对照组SOX(奥沙利铂+替吉奥)和观察组(奥沙利铂+替吉奥+乌苯美司)。比较两组疗效及不良反应发生情况,发现治疗后两组有效率分别为68.75%和47.92%;对于治疗后6个月、12个月观察组生存率分别为93.75%、81.25%,高于对照组77.08%、56.25%。除此之外,两组就白细胞下降、血小板下降、肝功能异常、恶心呕吐发生率进行比较,观察组显著低于对照组;因此证明,乌苯美司联合奥沙利铂+替吉奥方案证实在晚期胃癌的治疗是极好的,提高了患者远期生存率,降低不良反应的发生。朱斌等[10]将60例胃癌患者,随机分为对照组(XELOX方案:奥沙利铂+卡培他滨)和观察组(乌苯美司联合XELOX方案)进行临床后评价及不良反应检测。发现观察组治疗后CD4+/CD8+及NK细胞比例高于治疗前及对照组;但两组治疗后CD4+和CD8+细胞比例比较差异无统计学意义。观察组治疗后不良反应发生率为30.00%显著低于对照组的53.33%。因此,与单用XELOX方案辅助化疗比较,乌苯美司联合XELOX方案治疗胃癌更能改善机体免疫功能,减轻化疗不良反应。
1.4 对多发性骨髓瘤的作用研究多发性骨髓瘤是一种浆细胞恶性增殖性疾病,约占血液系统恶性肿瘤的10%,由于单克隆浆细胞恶性增生、广泛浸润并分泌大量单克隆抗体从而引起骨质破坏、贫血、高钙血症、高粘滞综合症及肾功能不全等一系列临床表现。黄鹏程等[11]随机将多发性骨髓瘤患者分成观察组(乌苯美司+沙利度胺)和对照组(沙利度胺)治疗。发现观察组有效率(93.75%)明显高于对照组(70.97%);观察组的血清IgG、IgA、骨髓瘤细胞水平在治疗后均低于治疗后对照组水平,而血红蛋白水平高于对照组。张家友等[12]随机将多发性骨髓瘤患者分成A组[沙利度胺+马法兰+强的松(TMP)方案]和B组(乌苯美司联合TMP方案),结果表明治疗后B组IgG、IgA、骨髓瘤细胞及骨髓抑制发生率均明显低于A组;B组治疗效果(86.67%)和生存期(16.45±0.71月)明显好高于A组治疗效果(63.33%)和生存期(14.35±0.47月)。因此,在TMP化疗治疗多发性骨髓瘤过程中联合使用乌苯美司,可以提高患者的缓解程度和生存率,减少骨髓抑制的发生。
1.5 增敏放疗放疗是肿瘤治疗中不可或缺的手段之一,据统计有超过60%的肿瘤患者需要进行放疗。因此,如何实现放疗的最大效能,放射增敏剂的加入是尤为重要的。放疗增敏剂是一种化学物质或药物,当与放射治疗同时使用时能提高射线的生物效应。并且可以杀死较多的的肿瘤细胞,但对正常细胞损伤较少。乌苯美司可作为增敏剂用于放疗,提高治疗效果。Tsukamoto等[13]用乌苯美司处理Hela细胞观察到集落形成率明显减少,说明细胞增殖能力有所下降,并且在小鼠荷瘤的体内实验中发现接受放疗和乌苯美司联合治疗的小鼠的肿瘤体积明显比单独放疗组小,提示乌苯美司可增强宫颈癌细胞对放射的敏感性。
2 乌苯美司联合用药逆转耐药机制
化学疗法是治疗恶性肿瘤的重要方法,常用于肿瘤化疗的药物包括烷化剂类、金属铂类、抗代谢类药物等。但是,肿瘤细胞对多种化学药物产生交叉耐药性-多药耐药(MDR)是造成肿瘤化疗失败的主要原因。因此逆转肿瘤细胞多药耐药已成为提高肿瘤耐药的关键方向,乌苯美司可通过以下机制达到逆转耐药的目的。
2.1 靶向肿瘤干细胞肿瘤干细胞(CSCs)具有干细胞自我更新、多向分化潜能、化疗耐药及无限增殖等特性,是肿瘤发展和复发的的根源所在。Sun等[14]在HCC中发现了CD13特异性表达的肿瘤干细胞群体。研究人员用流式细胞术检测化疗后的肝癌细胞中CD13+CSCs的百分比增多,经验证CD13+CSCs依赖于酪氨酸的代谢,而酪氨酸代谢还产生核乙酰辅酶A用来乙酰化和稳定关键转录因子Foxd3,进而使得CD13+CSCs细胞增多并对化疗药物产生抗性。因此,若想要防止肝癌复发,可靶向消除CD13+细胞。Haraguchi等[15]发现CD13抑制剂乌苯美司可抑制休眠的CSCs的自我更新和致瘤能力,并且在异种移植的小鼠中发现乌苯美司与传统化疗药物5-FU的联合使用比5-FU单独用药的肿瘤体积显著缩小,并认为乌苯美司可靶向作用于肿瘤干细胞进而提高肝癌的治疗效果。Sun等[16]在小鼠体内移植模型中,发现5-FU单独用药后CD13+细胞存活,CD13表达上调,但与CD13抑制剂联合处理有助于CD13+细胞和肝CSCs彻底清除。可见氨肽酶抑制剂乌苯美司靶向作用于肿瘤干细胞,提高治疗效果。
2.2 抑制肿瘤细胞自噬自噬是一种通过溶酶体在细胞内部降解功能失调的细胞组分的过程,通过介导胞内蛋白降解和胞浆成分再循环利用而维持细胞稳态。据推测,自噬是长期细胞毒素治疗后癌细胞存活和最终复发的最重要机制之一,尤其是在获得耐药性的过程中,治疗药物可以杀死大部分细胞,但是保护性自噬能够使肿瘤细胞耐受恶劣的生存环境,促进肿瘤细胞存活。一旦生长条件有利,这些细胞可以恢复活性使癌症复发。由于自噬使细胞产生对抗癌药物的抗性并使细胞在毒性应激的情况下残留下来,故在有抗性的癌细胞中抑制自噬可能是根除癌症的有效办法。
Liu等[17]在对索拉非尼耐药的肾癌细胞中发现自噬与索拉菲尼耐药有关,乌苯美司通过抑制自噬的Akt信号通路,恢复耐药细胞株对索拉非尼的敏感性。使用自噬抑制剂后可逆转肿瘤细胞中由自噬引起的耐药,增强化疗药对肿瘤的细胞毒性,恢复细胞对化疗药物的敏感性。Zhao Y[18]等人进一步证明了的过表达CD13能够激活P38/Hsp27/CREB信号通路,增强CREB介导的ATG7转录,促进肝癌细胞发生自噬,诱导肝癌细胞耐药。Guo等[19]研究者发现CD13在胃癌(GC)细胞中的表达与CDDP耐药呈正相关。与此同时,上皮膜蛋白3 (EMP3)是CD13下游的一个公认靶点,是CD13在磷酸肌醇3-激酶/蛋白激酶B (PI3K/AKT)通路中发挥作用的修饰因子。CD13抑制剂乌苯美司通过抑制GC细胞自噬和上皮-间充质转化(EMT)从而抑制CD13/EMP3/PI3K/AKT/NF-κB通路来克服GC细胞对CDDP的耐药。可得出乌苯美司可以逆转CDDP的耐药性,并增强GC细胞对CDDP的敏感性。因此,乌苯美司和化疗药物的联合应用通过抑制肿瘤细胞自噬已成为克服肿瘤耐药的一种潜在策略。
2.3 诱导肿瘤细胞凋亡细胞凋亡是指基因为维持内环境稳定而控制的细胞主动死亡。当机体处于稳态时,人体细胞正常繁殖、自然死亡,但当出现异常时,会导致发育异常或肿瘤的发生。凋亡是多基因控制的过程,由BCL-2家族、癌基因c-myc、抑癌基因p53等参与。一些抗肿瘤药物如乌苯美司可通过诱导细胞凋亡发挥出抑制肿瘤的作用。
Guo等[20]证明乌苯美司抑制原癌基因Pim-3的表达,同时使得 BCL-2和BCL-XL蛋白表达下降,增强肿瘤细胞凋亡。此外,乌苯美司还降低MDR相关蛋白 P-gp、MRP3和MRP2的表达,增强顺铂在细胞内的积累,这表明乌苯美司通过对Pim-3的作用从而逆转MDR进而提高肝癌细胞对化疗药物的敏感。此外,Guo等[21]还发现乌苯美司也可通过下调CD13、Bcl-XL、BCL-2和Survivin的表达,增加Bax的表达,激活Caspase-3介导的凋亡级联,进而逆转胃癌细胞的多药耐药。并且,乌苯美司可通过抑制PI3K/AKT/mTOR通路的磷酸化来增加5-FU和奥沙利铂在细胞内的积累,从而下调P-gp和MRP1等膜转运蛋白的表达。因此,乌苯美司通过激活Caspase-3介导的细胞凋亡并抑制膜转运有关蛋白的表达来逆转胃癌细胞的MDR(Fig 1)。Azimi等[22]发现CD13在对BRAF抑制剂耐药的黑色素瘤细胞中表达增加,酪氨酸激酶-肾上腺素受体A2(EphA2)和肝细胞生长因子受体(MET)的水平也增加,并可导致EphA2去磷酸化,进而诱导黑色素瘤细胞的生长停滞和凋亡。Wan等[23]研究发现联合应用乌苯美司和5FU可通过下调P-gp的mRNA和蛋白表达,抑制多药耐药A549(人非小细胞肺癌)细胞株在裸鼠体内的生长,并且5FU和乌苯美司联合作用后可明显促进A549/ADR细胞的凋亡,增加5-FU和乌苯美司在细胞内的蓄积,增强抗肿瘤活性。除此之外,有研究发现乌苯美司可作为一种有效的垂体辅助治疗药物,诱导脑垂体瘤细胞凋亡和自噬细胞死亡,使得肿瘤细胞存活率低。
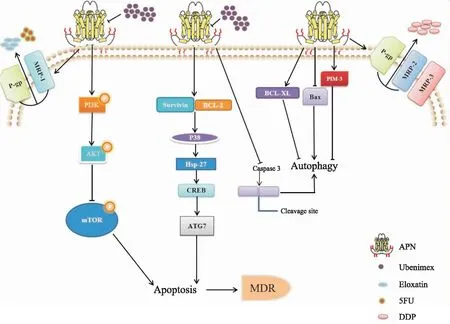
Fig 1 Ubenimide inhibited the expression of PIM-3 protein, thus reducing the expression of Bcl-2 and Bcl-XL and increasing the apoptosis of tumor cells
2.4 促进宿主免疫调节乌苯美司作为一种免疫调节剂,通过增强T和B淋巴细胞的功能使DNA合成增加,增强自然杀伤细胞(NK)的杀伤活力。同时,还增加集落刺激因子的合成,刺激骨髓细胞的再生及分化,起到调节、增强、兴奋和恢复机体免疫功能的作用。例如杨春霞等[24]将接受化疗的恶性肿瘤患者随机分为对照组和乌苯美司联合组,两组分别治疗3个月,比较各免疫指标和血清炎症因子的变化。结果发现联合组IL-10水平显著高于对照组,人肿瘤坏死因子α(TNF-α)和C反应蛋白(CRP)水平显著低于对照组。CRP是一种由肝细胞分泌的急性时相反应蛋白,其水平越高表示炎症反应和病情越严重,说明乌苯美司联合组可有效降低炎症的发生几率,改善身体状况。另外,联合组KPS(体质功能状态)评分和体质量改善率、稳定率显著优于对照组,因此乌苯美司可有效改善患者体能状态,从而改善患者的生活质量。采用乌苯美司治疗肿瘤患者,不仅可以增强患者机体免疫力、改善机体炎症状态,还可提高患者生活质量,可用于辅助治疗,有效保证化疗进程。刘耿淳等[25]探究乌苯美司与替吉奥联合放疗治疗中晚期直肠癌的临床疗效,将患者随机分为两组,两组患者均给予替吉奥胶囊及放疗治疗,研究组在上述治疗基础上给予乌苯美司辅助治疗。治疗后,研究组的生活质量评分与Kamofsky评分高于参照组;研究组的肾功能损伤、肝功能损伤、胃肠道反应、周围神经毒性及骨髓抑制发生率低于参照组。综上所述,乌苯美司与替吉奥联合治疗中晚期直肠癌可提高近期疗效,改善免疫功能和生活质量,且安全性较高。
2.5 临床试验进展NGR-hTNF是将天冬酰胺-甘氨酸-精氨酸(NGR)的多肽与TNF-α的N末端共轭结合的偶联分子。NGR会与氨肽酶N(CD13)特异性亚型相互作用进而与肿瘤新生血管相结合,该药物可使肿瘤的间质压力降低,增加化疗药物的穿透力。NGR-hTNF与顺铂联合治疗实体瘤,已进入临床试验阶段(编号:NCT00483093),但实验结果还未公布。除此之外,NGR-hTNF联合阿霉素治疗软组织肉瘤和对铂类药物耐药的卵巢癌均已进入Ⅱ期临床研究(编号:NCT00484341)。现有靶向治疗氨肽酶的临床应用药物如:马法兰(Melphalan)是一种口服的化疗药物,常用于治疗多发性骨髓瘤、乳腺癌、真性红细胞增多症等疾病。Oncopeptides医药公司将马法兰与靶向氨肽酶的多肽偶联合成制得肽-药物偶联物 Melflufen。该药物有极强的亲脂性能迅速被肿瘤细胞摄入,由于氨肽酶在众多肿瘤细胞中过表达,Melflufen一旦进入胞内,Melflufen的偶联肽会立即被氨肽酶裂解,释放出马法兰,并被截留在细胞内,引起Melflufen的进一步流入和裂解,进而靶向治疗,增强治疗效果。在体外实验中,研究人员发现Melflufen能显著提高马法兰的胞内的浓度,杀伤骨髓瘤细胞的能力是马法兰单独用药的50倍。
3 结论与展望
氨肽酶抑制剂乌苯美司竞争性抑制肿瘤细胞表面氨基肽酶APN及P-gp和MRP1等膜转运蛋白的表达,可诱导肿瘤细胞凋亡,增加细胞内药物的积累。还通过抑制自噬的Akt信号通路,使对抗癌药物产生抗性的癌细胞重获敏感性,增强化疗药对肿瘤的细胞毒性作用。除此之外还可靶向作用于肿瘤干细胞,促进宿主免疫调节,增强机体的免疫功能。还有不少靶向治疗氨肽酶的偶联药物也在临床试验中,并取得较好的疗效评价。因此,乌苯美司有着多重抗癌作用。细胞毒类药物毒性大,耐受性较差,但杀死肿瘤细胞作用明显。由于毒副作用较强,其应用受到了一定的限制。将乌苯美司与多种细胞毒类药物联合用药发现可增强抗肿瘤作用,减少不良反应的发生。因此,在未来的临床治疗中,乌苯美司在联合用药方面有着巨大的潜力。
