一株菲降解细菌产生生物表面活性剂特性的研究
2021-11-04阎洁余雪巍李鉴博顾海萍郭二辉
阎洁,余雪巍,李鉴博,顾海萍,郭二辉
河南农业大学林学院,河南 郑州 450002
近年来,由于工业化的快速发展,多环芳烃(polycyclic aromatic hydrocarbons,PAHs)成为水体、土壤等环境中最主要的持久性有机污染物之一(Seo et al.,2009)。PAHs是由两个或两个以上苯环以线状、角状、簇状排列在一起的稠环形化合物,具有致癌、致畸、致突变效应和难降解性,主要来源于化石燃料的不完全燃烧、采油等工业过程(顾海萍,2016)。由于PAHs本身具有高度亲脂的特性,环境中低浓度的PAHs可通过食物链的生物放大作用威胁人体健康(Abd-Elsalam et al.,2009),PAHs污染的修复迫在眉睫。目前PAHs污染修复技术主要包括物理法、化学法和生物法3种,其中物理法有蒸汽抽提、热脱附、超声波、隔离法和换土法等,化学法有光催化法、湿式氧化法、电化学氧化法和化学淋洗法等,这些物理化学修复方法不仅成本高昂、修复不彻底还可能造成二次污染(钱翌等,2013)。生物修复是利用微生物自身的生长代谢来降解有机污染物的一种经济有效的方法,它具有可持续性和环境友好性(Masakorala et al.,2013)。然而,PAHs在环境中难溶、生物可利用性低是限制微生物修复有机污染物的关键问题(Xia et al.,2014)。生物表面活性剂是微生物生长代谢产生的一类同时含有亲水基团和疏水基团的大分子化合物(Sun et al.,2019),因其能够提高PAHs的生物可利用性而受到广泛关注(Pacwa-Plociniczak et al.,2016)。但是生物表面活性剂产量低、纯化难、生产成本高,使其在PAHs污染修复中推广困难,促使直接筛选产生生物表面活性剂的PAHs降解菌株成为新的研究思路(Xu et al.,2020)。
由3个稠合苯环组成的菲已被美国环境保护署(USEPA)列为优先污染物,它具有PAHs的典型结构——k区和湾区,常被作为PAHs降解研究的模式化合物(Seo et al.,2009)。张俊叶等(2017)的研究显示,与其他国家相比,我国表层土壤中USEPA优先控制的16种PAHs以菲的含量最高,这严重威胁到我国的粮食安全和国民健康。因此,本研究选取菲作为目标污染物,从河南省信阳市一处多年垃圾焚烧场地中筛选分离出一株既能降解菲又能产生生物表面活性剂的细菌 GHP1,评价了该菌株的菲降解能力,鉴定了菌株所产生的生物表面活性剂类型,探讨了菌株产生生物表面活性剂的最佳生长条件,为PAHs污染微生物修复提供理论基础和技术支撑。
1 材料与方法
1.1 供试土壤
本实验筛选菌株的土壤采自河南省信阳市一处有 50年历史的垃圾焚烧场地(32.241°N,114.499°E),采样深度为0—15 cm的表层土壤,土样自然风干后过2 mm筛,并于4 ℃下保存。根据中国农业化学委员会(1983)的方法分析该土壤的基本理化性质如下:pH、有机物和阳离子交换容量分别为 6.5、14.1 g·kg−1和 26.4 cmol·kg−1,机械组成为49.1%的沙粒、14.2%的粉粒和36.7%的粘粒。
1.2 主要试剂与培养基
菲(纯度>99%,Sigma-Aldrich,上海),4000 mg·L−1的菲母液(丙酮溶),实验中其他有机试剂均为色谱纯,无机化学试剂均为分析纯。
LB培养基:10 g胰蛋白胨,5 g酵母提取物,10 g NaCl,1000 mL蒸馏水,pH 7.2,固体LB需添加 1.5%琼脂。无机矿质培养基(MSM):1 g KH2PO4,0.5 g NaNO3,0.2 g MgSO4,0.5 g(NH4)2SO4,0.02 g CaCl2,1 g NaH2PO4·H2O,1000 mL蒸馏水,pH 6.5,固体MSM需添加1.5%琼脂。所有培养基用前均经过 121 ℃高压蒸汽灭菌处理15 min。
1.3 菲降解和产生生物表面活性剂菌株的筛选
吸取2.5 mL菲母液于250 mL的锥形瓶内并使丙酮挥发形成菲膜,再加入 100 mL灭菌的液体MSM,使菲的初始浓度为100 mg·L−1。称取10 g土壤样品于锥形瓶中,在 28 ℃、130 r·min−1的条件下震荡培养一周,该过程为第一次驯化。然后,将10 mL瓶内溶液转移到新的含菲膜的锥形瓶中,添加90 mL灭菌的液体MSM,继续培养一周,相同的操作再循环一次。3次驯化完成后,移取第3次驯化培养的溶液于无菌管中,梯度稀释至 10−3、10−4、10−5、10−6后分别吸取 500 μL 涂布到覆有菲膜的MSM琼脂平板上,在28 ℃条件下避光培养。每日观察,挑出菌落周围有透明降解圈的单菌落在含菲膜的MSM琼脂平板上多次划线纯化,得到的纯菌即为菲降解菌(Wang et al.,2016)。采用试管斜面保藏菌种,置于4 ℃下留用。
检测菌株产生生物表面活性剂的方式多样,如血平板法、液滴坍塌法、表面张力法和排油圈法等(Kumar et al.,2016;Xu et al.,2020)。其中,一些菌株本身就含有溶血活性的毒力因子或者产生的生物表面活性剂扩散性差、产量不高从而导致血平板法、液滴坍塌法判断不准确(Pacwa-Plociniczak et al.,2016)。而排油圈法直观的反映菌株产生生物表面活性剂的能力(毕思宁等,2009),培养液表面张力的降低则能进一步验证菌株产生生物表面活性剂(Mouafo et al.,2018)。因此,本研究采取排油圈法和表面张力测定法筛选能够产生生物表面活性剂的菌株。排油圈法:将50 mL去离子水加入到直径为9 cm的培养皿中,并滴加1 mL已被苏丹红Ⅲ染色的液体石蜡,将20 μL已离心去除菌体的培养液滴加在油膜中心,油膜被向外挤压从而形成一个圆圈即为排油圈,以不接种菌株的液体培养基为对照(毕思宁等,2009)。表面张力测定法:接种菌株于液体LB培养基中,在28 ℃,130 r·min−1条件下培养 72 h,然后 10000 r·min−1离心 20 min 去除菌体,用表面张力仪测定去除菌体后培养液的表面张力(Xu et al.,2020)。
1.4 菌株鉴定
1.4.1 菌株的形态特征
本研究将筛选出来的目标菌株命名为 GHP1,将该菌株单菌落接种于固体 LB平板上培养 72 h(28 ℃),观察菌落生长形态特征;与此同时,挑取单菌落接种于液体LB中,并在28 ℃、130 r·min−1条件下培养48 h,观察菌液生长情况。菌体革兰氏属性采用革兰氏染色法并在普通光学显微镜下观察,细胞形态使用透射电子显微镜观察。
1.4.2 菌株的生理生化特征
甲基红反应、过氧化氢酶活性、纤维素水解、淀粉水解等生理生化指标参考相关文献(东秀珠等,2001)进行测定,运动性采用标准检测方法验证(Rashid et al.,2000),菌体表面的疏水性用菌体与水之间的接触角(θw)来表征(顾海萍,2016),V-P反应、吲哚产生、H2S产生、明胶水解、柠檬酸利用、β-半乳糖苷酶、脲酶、精氨酸双水解酶、色氨酸脱氨酶活性通过API20E分析,由北京麦克罗科技有限公司完成。
1.4.3 16S rDNA序列鉴定
用DNA抽提试剂盒提取GHP1菌株的DNA,选用16S rDNA通用引物27F(5′-AGAGTTTGATCC TGGCTCAG-3′)和 1492R(5′-GGTTACCTTGTTACGACTT-3′)进行 PCR 扩增(石金礼等,2016),PCR产物进行 1.5%琼脂糖凝胶电泳验证后交由派森诺基因生物技术有限公司进行测序。将获得的序列结果在 NCBI数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)中进行 BLAST比对,采用MEGA 7.0软件进行系统发育分析,通过Neighborjioning方法构建系统发育树,Bootstrap进行1000次重复检验(Deng et al.,2020)。
1.5 菌株对菲的降解
接种GHP1菌株于LB液体培养基中,在28 ℃、130 r·min−1条件下培养 24 h,离心(8000 r·min−1,4 ℃)5 min后倒掉上清液,收集的菌体用液体MSM洗涤两次并重新悬浮,然后采用紫外分光光度计调节菌悬液的OD600nm值为1.0,待用。
在灭菌棕色玻璃管中加入适量的菲母液,待丙酮挥发完全,加入9 mL灭菌的液体MSM和1 mL已制备好的菌悬液,使体系中菲的理论初始浓度为100 mg·L−1。将棕色玻璃瓶在 28 ℃、130 r·min−1下培养,每48 h在超净工作台中曝气1 min。分别在0、12、24、48、72 h取样,根据Wang et al.(2016)研究中的方法提取、测定体系中菲的残余量。以未接菌的含菲液体MSM为对照,每个时间点设置3个重复。
采用一级动力学方程 C=C0×e−kt拟合菲的降解数据。其中,t1/2为菲的半衰期,即菲浓度降到50%所耗费的时间t1/2=ln(2)/k,C0是菲的初始质量浓度,C是溶液中菲在培养t时间时的残留质量浓度,k是一级动力学常数(Gu et al.,2021)。
1.6 生物表面活性剂的提取及鉴定
1.6.1 生物表面活性剂的提取及纯化
接种菌株GHP1于液体LB培养基中,在28 ℃、130 r·min−1条件下培养 72 h,离心(4 ℃,10000 r·min−1,20 min)获得无细胞的上清液,然后用 6 mol·L−1盐酸将上清液酸化至 pH 2.0,并在 4 ℃下储存过夜。再次在相同条件下离心收集沉淀物,该沉淀物即为生物表面活性剂的粗产物(Xia et al.,2014)。基于 Batool et al.(2017)和 He et al.(2017)的方法提纯生物表面活性剂,将粗品溶于氯仿/甲醇(V∶V=2∶1)溶剂中,使得粗品与溶剂的比为 1∶30,超声30 min后搅拌并过滤,弃掉过滤的残渣,溶液经氮吹后再冷冻干燥,即得纯品。
1.6.2 薄层层析
将0.01 g提取的生物表面活性剂溶解在1 mL的氯仿/甲醇(V∶V=8∶2)中,超声10 min至完全溶解,点样于硅胶60板(GF254)上进行薄层层析,用氯仿/甲醇/水(V∶V∶V=4∶3∶2)作为流动相展层(马斌斌等,2017),展层完成后进行显色反应。本研究使用的显色剂为茚三酮试剂,由溶解在100 mL正丁醇中的1.5 g茚三酮和3.0 mL乙酸组成(Xu et al.,2020)。
1.6.3 傅里叶变换红外光谱
取约 1.0 mg研磨过的冷冻干燥后的生物表面活性剂粉末与100 mg干燥的KBr粉末研磨均匀,用压片机压成几乎呈透明状原片后于 4000—500 cm−1光区进行红外光谱扫描(Habib et al.,2020)。
1.7 不同培养条件对菌株产生生物表面活性剂能力的影响
测定在不同培养时间、温度、pH、碳源条件下菌株培养液乳化指数(E24)的大小,以探究不同培养条件对菌株产生表面活性剂能力的影响。所有实验均在50 mL的锥形瓶中进行,液体培养基为20 mL,各处理设置3组重复。E24参照Sun et al.(2019)的方法进行测定,即取已去除菌体的菌株培养液和液体石蜡各5 mL分别加入尖头离心管中,漩涡震荡2 min混合均匀,室温静置24 h后测量其乳化层高度,并按照下式计算E24:

式中:
he——乳化层高度(cm);
h——液体总高度(cm)。
1.7.1 培养时间
将制备好的菌悬液按 1∶9(V∶V)接种以蔗糖(质量分数为1%)为唯一碳源的液体MSM,pH为6.5,在28 ℃、130 r·min−1条件下振荡培养,分别在培养的24、72、120、168 h取样,测定菌株培养液的E24。
1.7.2 温度
将制备好的菌悬液按 1∶9(V∶V)接种以蔗糖(质量分数为1%)为唯一碳源的液体MSM,pH为6.5,分别设置培养温度为 20、28、37 ℃,在 130 r·min−1条件下培养72 h,取样测定菌株培养液的E24。
1.7.3 pH
将制备好的菌悬液按1∶9(V∶V)接种以蔗糖(质量分数为1%)为唯一碳源的液体MSM,分别设置培养基的初始pH为5.0、6.5、8.0、9.0、10.0,在28 ℃、130 r·min−1条件下培养 72 h,取样测定菌株培养液的E24。
1.7.4 碳源
在pH为6.5的液体MSM培养基中加入8种碳源,其中蔗糖、玉米淀粉、柴油、菜籽油、润滑油、石蜡、甘油按照质量分数为1%添加;菲的添加量为100 mg·L−1(预实验表明GHP1菌株在此浓度下生长最佳)。然后按1∶9(V∶V)接种制备好的菌悬液,在 28 ℃、130 r·min−1条件下培养 72 h,取样测定菌株培养液的E24。
2 结果与讨论
2.1 降解菲和产生生物表面活性剂菌株的筛选
在涂满菲的MSM平板上,如果菌落周围的菲膜消失不见并出现肉眼清晰可见的透明圈,说明污染物菲被菌株降解,此透明圈即为透明降解圈(罗小艳,2015)。透明降解圈反映了菌株具有利用菲的能力,常作为初步筛选菲降解菌的快速方法(Wang et al.,2016)。微生物对于污染物的降解需要一定的适应期,产生透明降解圈的速度越快,说明菌株对污染物的适应能力越强,降解速度越快(罗小艳,2015)。在初步筛选阶段,涂布到覆着菲膜的MSM平板上的菌悬液培养一周后出现清晰可见且形态不一的单菌落,挑取周围有透明降解圈的单菌落转接到新的覆有菲膜的MSM平板上,多次进行分离纯化,最后纯化出8株细菌。其中,GHP1菌株产生透明降解圈(图1)的速度最快,培养72 h即可将平板上的菲(0.4 mg)利用完全,这说明GHP1菌株能降解污染物菲,且降解能力突出。

图1 GHP1菌落在覆有菲的MSM平板上产生的透明降解圈
产生排油圈说明菌株产生生物表面活性剂,排油圈的直径与表面活性剂含量成正比(Hentati et al.,2021)。为确定GHP1菌株是否产生生物表面活性剂,本实验对去除GHP1菌体后的培养液进行排油圈实验,并以灭菌的液体LB培养基作为空白对照。结果显示,相对于液体LB,去除GHP1菌体后的培养液排油圈清晰可见(图2),这说明GHP1菌株能产生生物表面活性剂。

图2 液体LB培养基(A)、菌株GHP1培养液(B)的排油圈Fig. 2 Oil displacement circle of liquid LB medium (A) and strain GHP1 culture solution (B)
表面活性剂是一种能降低表面张力的物质(Mouafo et al.,2018)。据此,通过检测菌株培养液的表面张力能筛选产生生物表面活性剂的菌株。在表面张力实验中,GHP1菌株在液体LB中培养72 h的培养液表面张力为53 mN·m−1,比对照液体LB的表面张力(74 mN·m−1)降低了28.38%,该结果进一步验证了GHP1菌株能产生生物表面活性剂这一结论。
综上所述,GHP1菌株能够降解菲且能产生生物表面活性剂,因此选取该菌株作为供试菌株进一步研究。
2.2 菌株鉴定
2.2.1 菌株的形态特征
GHP1菌株在液体 LB培养基中 28 ℃、130 r·min−1条件下振荡培养逐渐变浑浊,30 h后呈现菌团聚物(图3A)。菌株在固体LB上生长迅速,长势良好,48 h便可形成清晰可见的菌落,菌落呈黄色,不透明,表面状态光滑有光泽,菌落隆起,边缘结构整齐,质地粘稠(图 3B)。GHP1菌株革兰氏染色显示为红色,表明其为革兰氏阴性菌(图3C)。透射电子显微镜观察结果显示,GHP1菌体为杆状,无芽孢,有单端鞭毛(图3D),可能为运动型细菌(Bruzaud et al.,2015)。污染物的降解取决于降解微生物与污染物之间的有效接触(Semple et al.,2003),鞭毛则可增加菌株对高疏水性物质表面的粘附(Bruzaud et al.,2015)。Gu et al.(2017)的研究表明,有单端鞭毛的运动型PAHs降解细菌能够增加其与PAHs的接触机会,提高PAHs的生物可利用性,从而增强PAHs的降解能力。本实验中,GHP1菌株具有单端鞭毛的特性有利于其对 PAHs的降解。
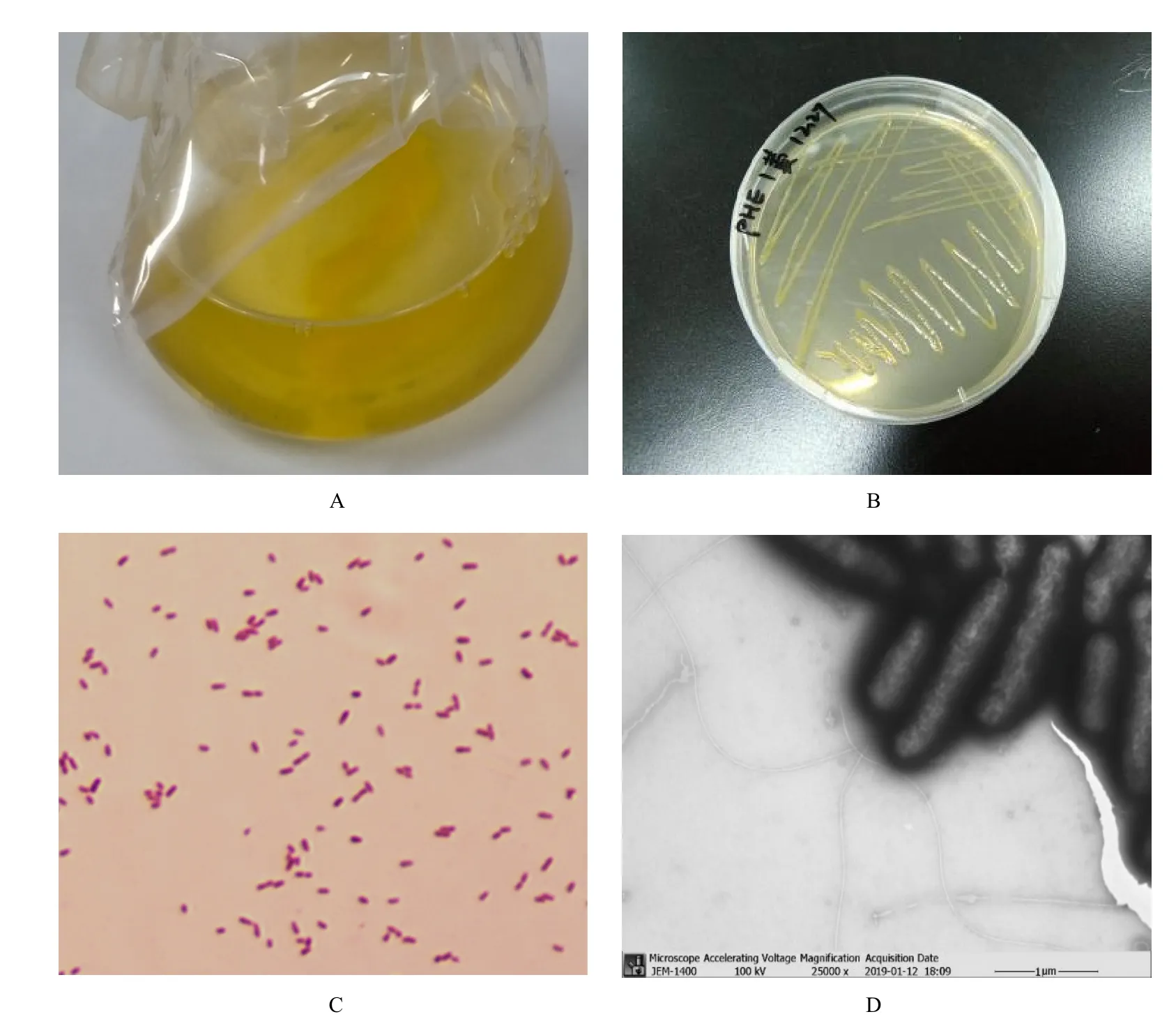
图3 GHP1在液体(A)、固体(B)LB培养基中的菌体形态和光学显微镜下的革兰氏染色(C)以及透射电子显微镜下的细胞形态(D)Fig. 3 Morphology of strain GHP1 in liquid (A), solid (B) LB medium, gram staining under light microscope (C)and cell morphology under transmission electron microscope (D)
2.2.2 菌株的生理生化特征
GHP1菌株的生理生化特征测定结果如表1所示。结果表明,GHP1是一株运动型细菌,这也与之前透射电镜下该菌株具有单端鞭毛的结果(图3D)相吻合。另外,过氧化氢酶实验反应为阳性,说明GHP1菌株含有过氧化氢酶,许多研究指出能产生过氧化氢酶是微生物降解有机污染物的关键(李雪,2018)。此外,该菌株需氧,能水解淀粉;β-半乳糖苷酶实验反应为阳性;V.P.实验为弱阳性;其他反应则为阴性。

表1 GHP1菌株的生理生化特征Table 1 Physiological and biochemical characteristics of strain GHP1
根据GHP1菌株表面与水的接触角(θw),可判断该菌株表面呈中度亲水性。PAHs是脂溶性有机污染物,若菌体表面高度亲水,则不利于微生物对PAHs的摄取和降解(颜湘波等,2014)。本研究中,GHP1属于中度亲水性菌株,对PAHs的摄取和利用阻碍不大。
2.2.3 菌株的分子学鉴定
利用细菌16S rDNA的通用引物对菌株GHP1进行扩增,最终得到1366 bp的基因序列(GenBank登录号为 MW345956)。将 16S rDNA基因序列在GenBank上进行序列同源性比较,结果表明菌株GHP1的16S rDNA基因与Sphingobium abikonense MS64的16S rDNA基因相似度高达100%,与Sphingobium lactosutens DS20、Sphingobium abikonense NBRC 16140、Sphingobium soli THG-SQA7、Sphingobium abikonense IAM 12404、Sphingobium amiense NBRC 102518以及Sphingobium amiense Y的16S rDNA基因相似度均在97.81%以上。对其进行发育树的构建如图4所示,从结果可以看出菌株GHP1与菌株Sphingobium abikonense MS64聚于一类,亲缘关系最近。
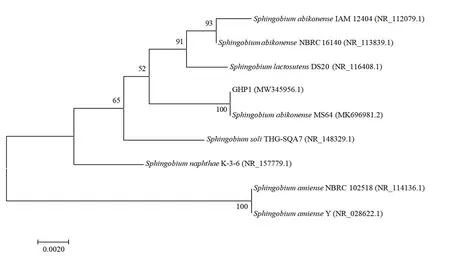
图4 基于菌株GHP1与相似菌株16S rDNA序列构建的系统发育树Fig. 4 Phylogenetic tree based on 16S rDNA sequences of strain GHP1 and related type strains
综合形态观察、生理生化特征和分子学鉴定结果,GHP1菌株为 Sphingobium abikonense (S.abikonense)。近些年来,从环境中分离出一些能降解 PAHs的 Sphingobium属菌株(Prakash et al.,2006;Dong et al.,2014)中并无 Sphingobium abikonense的相关研究。因此,进一步研究 Sphingobium abikonense GHP1对菲的降解以及产生生物表面活性剂的特性具有非常重要的参考价值。
2.3 菌株对菲的降解
菌株GHP1作用下菲残余率的动态变化如图5所示。菲的残余率随培养时间延长而迅速降低,其中,培养24 h菲的残余率为70.93%,培养结束时(72 h)菲的残余率为 13.92%,该变化符合一阶动力学模型(R2=0.859),t1/2约为27.12 h,说明菲降解50%所需要的时间是27.12 h(表2)。目前已被报道的菲降解菌株及其菲降解能力如表3所示,从该表可知,不同属的菌株对菲的降解能力有差异,其中Sphingobium属菌株的降解能力最强,本文的研究对象GHP1菌株隶属于该属。
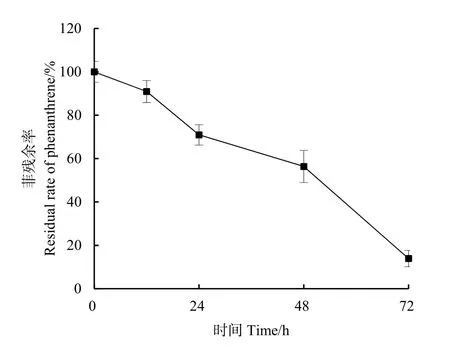
图5 GHP1菌株对菲的降解动态Fig. 5 Degradation dynamics of phenanthrene by strain GHP1

表2 GHP1菌株对菲降解的一级动力学方程及半衰期Table 2 First-order kinetics equations and the corresponding half-life times of phenanthrene biodegradation by strain GHP1
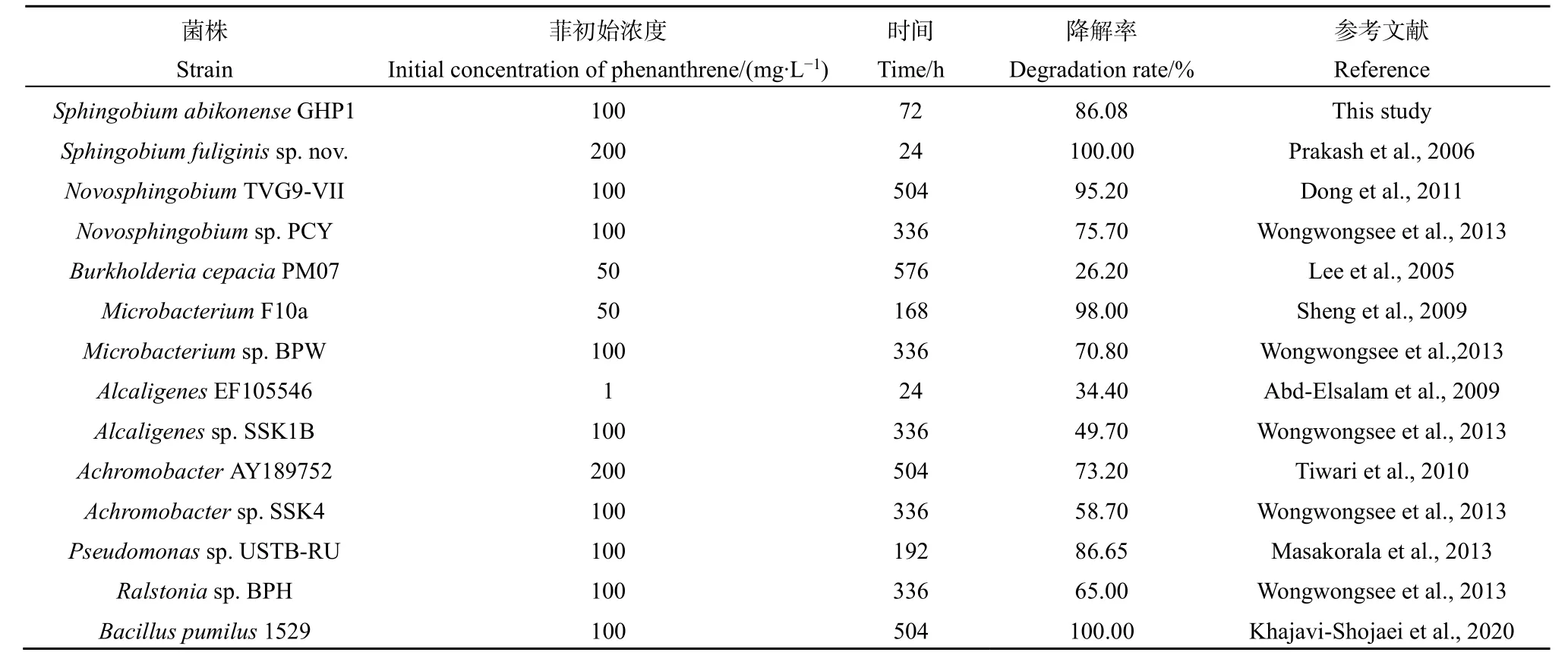
表3 菲降解菌株及其降解率统计表Table 3 Statistical table of phenanthrene degrading strains and their degradation rates
颜湘波等(2014)认为,疏水性是影响PAHs微生物降解效果的众多因素之一。环境中存在一些中度亲水的高效PAHs降解细菌,Wang et al.(2016)和本文的研究均证实了此观点。另外,GHP1菌株具有运动性,能够增强菲的生物可利用性,从而提高对菲的降解能力。综上可知,GHP1菌株具有高效的菲降解能力,在菲污染的微生物修复中具有较大的应用潜力。
2.4 生物表面活性剂的鉴定
2.4.1 薄层层析
薄层层析是鉴定生物表面活性剂种类的重要方法(马斌斌等,2017),GHP1菌株所产生的生物表面活性剂经过薄层层析展层,喷洒茚三酮试剂在比移值Rf=0.7处显示红色斑点(图6),这说明该生物表面活性剂是脂肽(Habib et al.,2020)。

图6 GHP1菌株产生的生物表面活性剂薄层层析Fig. 6 Thin layer chromatography of biosurfactants produced by strain GHP1
2.4.2 傅里叶变换红外光谱
傅里叶变换红外光谱能准确鉴定生物表面活性剂的种类(马斌斌等,2017),GHP1菌株产生的生物表面活性剂经冷冻干燥后进行傅里叶变换红外光谱分析,结果如图7所示。在3296.75 cm−1处有一较宽的峰,说明该物质具有 N-H的伸缩振动(马斌斌等,2017);在2925.39 cm−1处出现一个尖锐而狭窄的峰,表明该物质具有 C-H的伸缩振动(Huang et al.,2020);在 1657.62 cm−1处出现一个强有力的峰,属于C=O和C-N的伸缩振动,即酰胺I带,这证实了生物表面活性剂分子中存在肽基(Habib et al.,2020);1535.25 cm−1处的峰意味着酰胺II带的存在,是N-H弯曲和C-N伸缩振动的组合吸收(Kumar et al.,2016);1226.27 cm−1处的小峰为C-H的伸缩振动(曾超等,2020);1064.65 cm−1处的小峰为C-O-C的伸缩振动(Padmavathi et al.,2014)。该结果进一步验证了GHP1菌株产生的生物表面活性剂为脂肽类物质,亲水基为肽链。
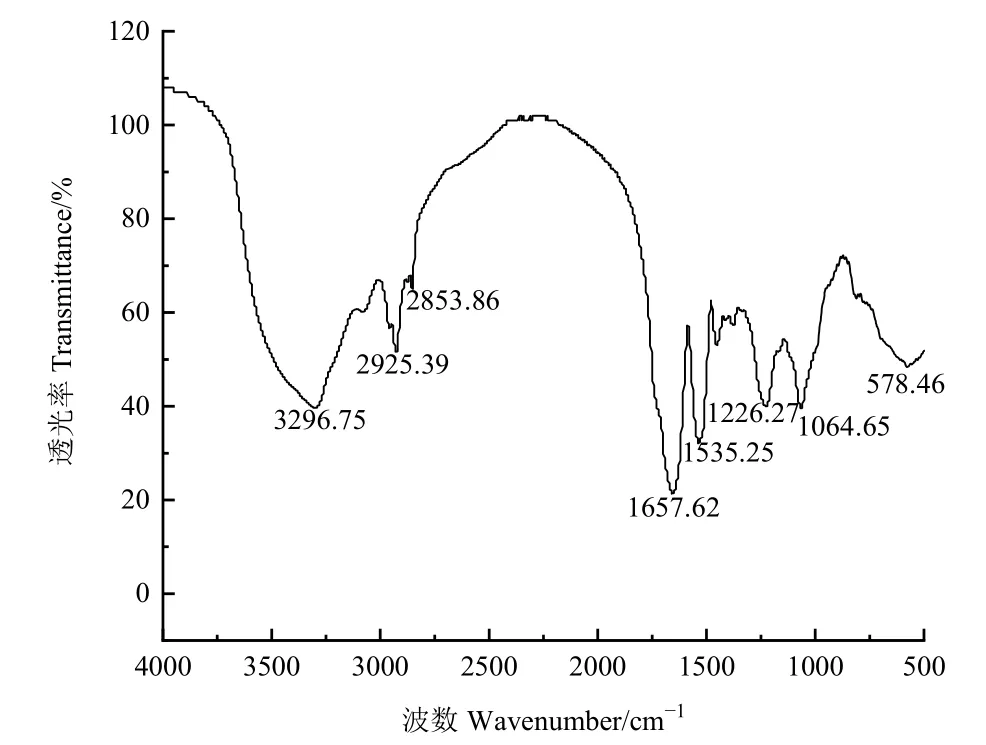
图7 GHP1菌株产生的表面活性剂红外吸收光谱Fig. 7 Infrared absorption spectra of biosurfactants produced by strain GHP1
目前,已报道的能产生生物表面活性剂的菌株以及产生的生物表面活性剂种类十分丰富。例如:Pseudomonas aeruginosa 147、Enterobacter sp. SF-4、Lactobacillus plantarum G88能产生糖脂类表面活性剂(Batool et al.,2017;Mouafo et al.,2018;石金礼等,2016);Serratia marcescens ZCF25、Bacillus siamensis ZCST-1、Staphylococcus sp. CO100能产生脂肽类表面活性剂(Huang et al.,2020;Hentati et al.,2021;曾超等,2020);Candida albicans 39A2、Bacillus cereus CECT 193、Bacillus licheniformis CECT 491能产生脂蛋白表面活性剂(Haba et al.,2000);Rhodococcus sp. 135、Pseudomonas sp. 25A3能产生脂肪酸类表面活性剂(Haba et al.,2000);Klebsiella pneumoniae H1、Bacillus sphaericus EN3、Bacillus azotoformans EN16能产生磷脂类表面活性剂(Adamu et al.,2015;黄杨等,2015);Candida antarctica T-34、Acinetobacter radioresistens KA53能产生聚合物表面活性剂(Kitamoto et al.,1990;Navon-Venezia et al.,1995)。但是尚未发现S. abikonense能够产生生物表面活性剂的研究,这是首次关于S. abikonense产生脂肽类表面活性剂的报道。
2.5 不同的培养条件对菌株产生生物表面活性剂的影响
生物表面活性剂作为细菌的一种次生代谢产物,其合成和分泌受环境条件影响较大(黄杨等,2015)。乳化指数(E24)与表面活性剂的浓度成正比,可采用 E24来表征菌株产生生物表面活性剂的能力(Habib et al.,2020)。因此,有必要探讨环境因子对GHP1菌株培养液E24的影响。
培养时间对菌株产生生物表面活性剂的影响如图8A所示,随着培养时间的延长菌株培养液E24分布在51.59%—59.11%之间,呈现出先增加后减小的趋势。其中,培养72 h菌株培养液的E24最高,与120 h的E24(P=0.065)无显著性差异,但显著高于168 h的E24(P=0.013)。这与已有的一些研究结果类似,Kumar et al.(2016)研究表明 Bacillus licheniformis在96 h的E24达到最大,继续培养至120 h菌株培养液的E24下降;Hentati et al.(2021)发现Staphylococcus sp. CO100菌株培养192 h后,生物表面活性剂的产量下降。这可能是因为培养基中碳源减少,微生物利用生物表面活性剂作为细胞存活的底物导致的(Patowary et al.,2017)。
温度影响细菌体内酶的分泌和活性进而影响微生物生长及其生物表面活性剂的合成(Habib et al.,2020)。根据图8B可知,不同温度培养下菌株培养液的E24在51.70%—59.11%之间,在28 ℃条件下菌株培养液的 E24(59.11%)显著高于 20 ℃(P=0.010)和 37 ℃(P=0.020)时的 E24,这说明28 ℃为 GHP1菌株的最佳生长温度,该菌在此温度下生长代谢速度最快,产生生物表面活性剂最多。同时也表明,GHP1菌株在20—37 ℃范围内均能生长良好并且产生生物表面活性剂。
pH与菌株产生生物表面活性剂密切相关(Parthipan et al.,2017)。根据图8C可知,不同pH条件下菌株培养液的E24在52.95%—59.11%之间,pH 6.5和pH 8.0条件下菌株培养液的E24(P=0.368)无显著性差异,pH 6.5条件下菌株培养液的 E24(59.11%)显著高于pH 5.0、9.0、10.0(P值分别为0.001、0.001、0.001)的E24,pH 8.0条件下菌株培养液的 E24(57.17%)显著高于 pH 5.0、9.0、10.0(P值分别为0.013、0.016、0.009)的E24。由此可见,菌株产生生物表面活性剂受 pH影响较大,GHP1菌株在pH为6.5—8.0条件下产生生物表面活性剂的能力最强,可能与该pH范围更有利于生物表面活性剂的合成有关(石金礼等,2016)。其他菌株也有类似的结果,Achromobacter sp. A-8和Bacillus subtilis A1菌株产生生物表面活性剂的最适pH 都为 7.0(Parthipan et al.,2017;Deng et al.,2020)。
碳源提供细菌细胞生长、代谢所需要的能量,是维持细菌生长和产生生物表面活性剂的基础。碳源及其溶解度影响生物表面活性剂的产生(Khajavi-Shojaei et al.,2020)。从图 8D 可知,GHP1菌株可以分别利用蔗糖、菲、玉米淀粉、柴油、菜籽油、润滑油、石蜡、甘油8种碳源生长并产生生物表面活性剂,其中,蔗糖和玉米淀粉属于糖类;柴油、菜籽油、润滑油、石蜡和甘油属于油烃类;菲是PAHs的一种。GHP1菌株在不同的底物体系中培养液的E24不同,这是由菌体内的酶系决定的(Mouafo et al.,2018)。以蔗糖为唯一碳源时,菌株培养液的E24最大(59.11%),显著高于其他碳源培养液的E24(P=0.000);以菲为唯一碳源时,E24最低(48.10%);其他6种碳源分别添加的情况下,菌株培养液的E24均在52.00%左右。由上述结果可知,在糖、油烃、PAH三类碳源中,GHP1菌株在以糖为碳源时更易产生表面活性剂。已有研究表明,一部分菌以疏水性底物为碳源更易分泌表面活性剂,如Deng et al.(2020)研究的Bacteria Achromobacter sp. A-8在以食用油和石蜡为碳源时产生表面活性剂的能力最强;另一部分菌以水溶性底物为碳源更易分泌表面活性剂,如Parthipan et al.(2017)研究的 Bacillus subtilis A1在以蔗糖为碳源时产生表面活性剂的能力最强。GHP1菌株在以蔗糖为碳源时培养液的E24最高,可能是因为该菌株体内分解蔗糖的酶占主导地位。
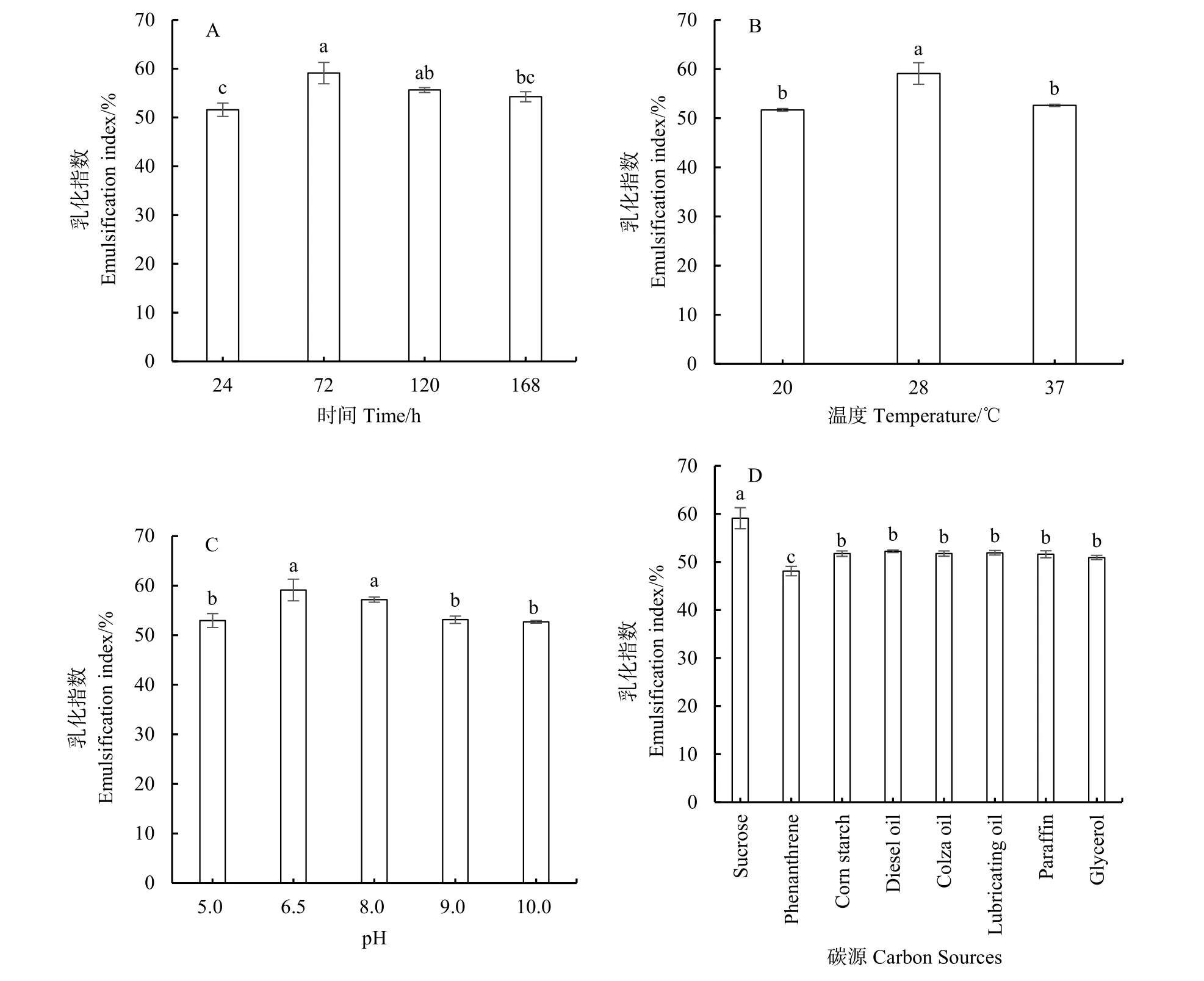
图8 不同培养条件对培养液乳化性指数(E24)的影响Fig. 8 The effects of different culture conditions on emulsification index (E24) of culture medium
综上所述,72 h、28 ℃、pH 6.5、蔗糖为碳源是 GHP1菌株产生生物表面活性剂的最适生长条件,此时的E24为59.11%。GHP1菌株是从多年垃圾焚烧场地土壤中筛选出来的土著菌,在以各种类型的底物为碳源的培养基中都能生长良好且产生生物表面活性剂(图8),这说明该菌株对底物的接受范围宽广,菌株体内酶系丰富,能吸收利用各种碳源。Basta et al.(2005)曾报道,Sphingomonad科菌株能够利用多种类型的底物,适应贫营养环境。本实验的研究对象——S. abikonense GHP1隶属于该科,该菌株对环境的适应能力强,易存活,在实际应用中具有强大的竞争力和明显的优越性。
3 结论与展望
本文从多年垃圾焚烧场地的土壤中筛选出一株菲高效降解细菌Sphingobium abikonense GHP1,该菌株能产生脂肽类生物表面活性剂,且在以蔗糖为唯一碳源、28 ℃、pH 6.5、培养72 h时其培养液的乳化指数最高。这是首次关于 Sphingobium abikonense菌株兼有降解菲和产生生物表面活性剂特性的报道。研究结果为环境中PAHs的污染修复和生物表面活性剂的生产提供新的菌源。
本研究探讨了菌株GHP1在实验室环境下对菲的降解以及产生生物表面活性剂的情况。在自然环境条件下,影响PAHs污染微生物修复效果的因素非常复杂,菌株适应外界环境条件、成功定殖并成为优势菌种是PAHs降解的关键。采用包埋、制成菌剂、附着可降解载体等手段增强菌株GHP1的环境适应性及竞争力并将其应用于PAHs实际污染的修复还有待进一步探究。
