酶解处理对扁桃仁蛋白质起泡特性影响及其应用研究
2021-11-04杨晓钒王炜清李秀婷余雄伟付琴利李述刚
杨晓钒, 王炜清, 李秀婷, 余雄伟, 付琴利, 刘 伟, 李述刚,*
(1.湖北工业大学 发酵工程教育部重点实验室, 湖北 武汉 430068;2.北京工商大学 食品与健康学院, 北京 100048;3.武汉旭东食品有限公司, 湖北 武汉 430040; 4.湖北良品铺子食品工业有限公司, 湖北 武汉 430043)
扁桃(AmygdaluscommunisL.)树又名巴旦木,属于蔷薇科(Rosaceae)李亚科(Prunoideae)李属(Prunus)桃亚属(Amygdalus),是世界上著名的干果树种和木本油料树种。扁桃仁作为扁桃树的果实不仅具有良好的营养价值,而且拥有诸多生理功能,如降血糖、预防冠心病、改善肠道消化等[1]。扁桃仁蛋白质的氨基酸组成合理、含量丰富,为一种全价蛋白质[2],其中必需氨基酸组成比例符合国际粮食组织和世界卫生组织推荐的模式[3],是一种具有开发潜力的植物基蛋白质资源。
目前,国内外对扁桃仁的营养成分和功能特性进行了一系列研究[4-5],结果表明,扁桃仁蛋白质的起泡性及泡沫稳定性较差,限制了这类蛋白资源在食品加工中的应用,因此研究合适的改性方法,提高扁桃仁蛋白质的起泡特性具有重要意义。目前蛋白质起泡特性的改性方法主要有物理改性、化学改性和酶法改性[6]。与物理和化学改性方法相比,酶解改性条件温和、反应速度快、安全性高,酶解改性后蛋白质水解物还具有很多独特的理化特性、生物活性以及易消化吸收的特点[7]。林巍等[8]研究发现,经木瓜蛋白酶和碱性蛋白酶酶解后,紫花芸豆清蛋白的抗氧化活性、起泡性及起泡稳定性明显提高;Zeng等[9]研究了不同来源的蛋白酶对大豆分离蛋白起泡特性的影响,结果表明,酶解后大豆分离蛋白的起泡性和泡沫稳定性均提高。目前,已有关于酶解对豆类蛋白质起泡特性的研究,但酶解对扁桃仁蛋白质起泡特性的研究尚未见报道。
蛋糕等焙烤食品一直深受消费者喜爱,然而纯蛋清糕点无论是从营养和风味或产品种类等方面均难以满足人们日益增长的对优质产品的需求;且动植物蛋白质与植物蛋白质相比,由于氨基酸组成和蛋白质结构的内在差异,其消化和营养吸收也有所不同。扁桃仁蛋白质因其丰富的营养特性和优良的加工性能,有望为食品工业提供一类优质的新产品。本研究拟以扁桃仁分离蛋白质(almond protein isolate,API)为对象,以起泡能力和泡沫稳定性为观测指标,研究酶解处理对其起泡特性的影响。希望在此基础上,开发以扁桃仁分离蛋白水解物(almond protein isolate hydrolysates,APIH)为发泡剂的新型蛋糕产品,拓宽扁桃仁蛋白质的应用领域,为消费者提供一种相对高端的焙烤食品。
1 材料与方法
1.1 材料与试剂
扁桃仁,新疆喀什莎车县;胃蛋白酶(3 000 U/mg)、胰蛋白酶(250 U/mg),国药集团化学试剂有限公司;木瓜蛋白酶(800 U/mg)、碱性蛋白酶(200 U/mg)、中性蛋白酶(100 U/mg),上海源叶生物科技有限公司;8-苯胺-1-萘磺酸(ANS),高级纯,上海麦克林生化科技有限公司;邻苯二甲醛(OPA),高级纯,美国Sigma公司;其他试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 仪器与设备
F- 4600型荧光分光光度计,日本日立公司;DFA100型动态泡沫分析仪,德国Kruss公司;Leica TCS SP8型激光共聚焦扫描显微镜,德国徕卡公司;Tracker型界面流变仪,法国TECLIS界面技术有限公司;Haake Rheostress 6000型旋转流变仪,美国Thermo Fisher公司;Zetasizer Nano- ZS型纳米粒度及电位滴定仪,英国马尔文(Malvern)公司;SU- 8010型扫描电子显微镜,日本日立公司;ColorFlex EZ型色差仪,美国HunterLab颜色管理公司。
1.3 实验方法
1.3.1扁桃仁蛋白质的提取
参照Liu等[10]的方法,采用碱溶酸沉法制备API。将扁桃仁脱皮后进行磨粉、过筛、脱脂得到扁桃仁脱脂粉。将脱脂粉溶于超纯水中(1∶30,g/mL)并调节pH值至9.5,在35 ℃条件下搅拌3 h,以8 000 r/min离心20 min。将所得上清液的pH值调至4.5,静置15 min后,以8 000 r/min离心20 min得到沉淀物。将沉淀物分散于超纯水中,调节pH值至7.0,在4 ℃条件下透析3 d,冷冻干燥得到扁桃仁蛋白质。
1.3.2蛋白酶的选择
选用胃蛋白酶、胰蛋白酶、木瓜蛋白酶、中性蛋白酶和碱性蛋白酶5种常用蛋白酶,对API进行酶解处理,5种酶的酶活均为3 000 U/g。胃蛋白酶和胰蛋白酶酶解温度为37 ℃,碱性蛋白酶、中性蛋白酶、木瓜蛋白酶酶解温度为55 ℃,酶解时间选用15 min与60 min,酶解结束后放入90 ℃水浴锅灭酶15 min,待冷却至室温调节pH值至7.0,离心后收集上清液,进行真空冷冻干燥。配制酶解物溶液(1、5、10 mg/mL),用高速剪切机以10 000 r/min剪切2 min,记录0、30、60、120 min的泡沫高度并计算起泡性和泡沫稳定性。
1.3.3扁桃仁蛋白质酶解物的制备
配制10 mg/mL API溶液,调节pH值至2.0,在37 ℃水浴锅中预热10 min,加入胃蛋白酶3 000 U/g。酶解一段时间后取出,放入90 ℃水浴锅15 min,待冷却至室温调节pH值至7.0灭酶,然后在4 ℃下离心。收集上清液进行真空冷冻干燥,得到扁桃仁分离蛋白质水解物(almond protein isolate hydrolysates,APIH),根据不同酶解时间(15、30、60、180、300 min)将样品依次命名为APIH15、APIH30、APIH60、APIH180和APIH300。
1.3.4理化参数的测定
1.3.4.1 API水解度的测定
采用OPA试剂法[11]测定胃蛋白酶酶解扁桃蛋白质的水解度。
1.3.4.2 API及APIH分子质量的测定
参考Lasse 等[12]的方法,利用十二烷基硫酸钠- 聚丙烯酰胺凝胶电脉(SDS- PAGE)对API及APIH分子质量变化进行分析。SDS- PAGE所用浓缩胶与分离胶的质量分数分别为4%与12%,电压分别设置为70 V和110 V。
1.3.4.3 API及APIH水力学直径的测定
采用Zeta电位计纳米粒度仪测定样品溶液的水力学直径。配制API、APIH溶液,用超纯水稀释至0.1 mg/mL。取1.2 mL样品加入四通比色池进行测定,平衡时间1 min,测量温度25 ℃。
1.3.4.4 API及APIH表面电荷的测定
用纳米粒度及电位分析仪测定液滴表面电荷分布。为避免多重散射,将样品稀释适当倍数,置于电位槽中进行测定。测定参数中连续相选择水、分散相选择API。每个样品重复测定3次,结果取平均值。
1.3.4.5 API及APIH表面疏水性的测定
根据Arzeni等[13]的方法,用ANS荧光探针测定蛋白质的表面疏水性。在荧光光谱激发波长和发射波长分别为390 nm和470 nm,狭缝为2.5 nm处测定样品的荧光强度。
1.3.4.6 API及APIH在气- 水界面吸附行为的测定
利用Tracker界面流变仪,在25 ℃下测量API及APIH水溶液在气- 水界面上表面张力随时间的变化,测试时间为3 h。
1.3.4.7 API及APIH发泡特性的测定
参考Xu等[14]的方法,利用泡沫分析仪对API及APIH的发泡性能进行测定。配制3 mg/mL样品溶液,取50 mL加入测量容器中,空气流速为0.3 L/min,发泡程序设置为当总高度达到180 mm处停止发泡并开始测量,测量时间为2 h。起泡性(Fc)由发泡能力表示,计算方法见式(1)。
(1)
泡沫稳定性由泡沫的半衰期(t1/2)表示,即泡沫体积下降至初始时一半的时间。
1.3.4.8 API及APIH稳定的泡沫微观结构观察
参考Zou等[15]的方法,在激光共聚焦显微镜(CLSM)下观察泡沫的微观形态并进行分析,激发波长为633 nm。
1.3.4.9 API及APIH稳定的泡沫界面结构观察
利用扫描电子显微镜(SEM)对泡沫的界面结构进行观察。首先制备稳定的泡沫,然后快速放入-80 ℃冰箱内,冷冻干燥得到固体泡沫。通过导电胶将泡沫粘在载物台上,喷金后进行观察。
1.3.5以API为部分发泡剂的蛋糕的制作
1.3.5.1 工艺流程
将蛋黄、大豆油、牛奶、低筋面粉、白糖混匀(混和物1),发泡剂中加入白糖(3次加入)搅打(混合物2)。将两种混合物混匀,倒入模具,烤制,倒扣脱模,得到蛋糕成品。
考虑酶解物的起泡特性及得率,发泡剂选用APIH180部分和完全替代蛋清,以酶解物的添加量为变量,即0(全蛋)、20%、40%、60%、80%、100%。
1.3.5.2 发泡剂泡沫特性的表征
取100 g发泡剂加入1 L烧杯中,向其中加入60 g白糖后用搅蛋器快速搅打6 min30 s(抬起打蛋器,可以拉出短而尖锐的直角),记录产生泡沫的体积为V,通过V来比较发泡剂的起泡性大小。
1.3.5.3 发泡剂流变特性的测定
参照Engelhardt等[16]的方法,采用旋转流变仪对泡沫进行流变性能测定。应变扫描的测试范围为0.01%~10.00%,固定频率为1 Hz;频率扫描的测试范围为0.1~10.0 Hz,固定应变为1%。分别记录储能模量(G′)和损耗模量(G″)随应变和频率的变化图谱。
1.3.5.4 蛋糕比容的测定
蛋糕比容用小米置换法进行测量。在烧杯中倒入小米至预设刻度线,然后将小米倒出,放入蛋糕。倒入之前倒出的小米,直至预设刻度线,称量剩余小米的体积,即为蛋糕所占体积。蛋糕比容计算方法见式(2)。
蛋糕比容=V(蛋糕)/m(蛋糕) 。
(2)
式(2)中,V(蛋糕),mL;m(蛋糕),g。
1.3.5.5 蛋糕色度的测定
将蛋糕沿着横截面切开,用色度仪测定芯部的色度值L*、a*、b*,其中a*为红绿偏向,正值代表红色,负值代表绿色,而b*为黄蓝偏向,正值代表黄色,负值代表蓝色。
1.3.5.6 蛋糕质构的测定
将蛋糕切成长、宽、高均为2 cm,采用P/36R探头进行全质构分析。测定参数为:测定前速度5 mm/s,测定速度10 mm/s,测后速度10 mm/s,压缩比50%,引发力5 g,引发类型为自动。
1.4 数据处理
采用SPSS软件对实验数据进行处理,应用Duncan’s法进行显著性分析,以P<0.05表示差异显著。用Origin 8.5软件进行数据图像处理。所有实验均重复3次,结果以平均值±标准差表示。
2 结果与讨论
2.1 不同蛋白酶对API酶解效果的影响

图1 5种蛋白酶对API起泡性和泡沫稳定性的影响Fig.1 Effect of 5 kinds of enzymes on API foaming and foam stability
为探讨不同酶对API的酶解效果,本实验分别选用5种常用蛋白酶对API进行酶解处理,实验结果如图1。由图1(a)可知:用5种不同蛋白酶分别处理15 min和60 min,与对照组相比,样品起泡性均显著提高,其中胰蛋白酶处理后的样品起泡性最差,胃蛋白酶、木瓜蛋白酶、中性蛋白酶处理后的样品起泡性相对较好。由图1(b)可知:与对照组相比,酶解处理后的样品,起泡稳定性显著提高,其中胃蛋白酶处理后的样品起泡稳定性相对较好,因此,从起泡性和泡沫稳定性综合考虑,选择胃蛋白酶进一步研究。
2.2 不同酶解时间对API理化特性的影响
2.2.1对API水解度的影响
API的水解度随酶解时间变化情况如图2。由图2可知:API水解度随酶解时间增加而上升,即在最初的反应期间,API酶解反应速率较快且水解度增加速度较快;当反应时间到达180 min时,水解度的变化呈现平缓趋势,这与Zhang等[17]报道的花生蛋白的水解度变化规律类似,随着酶解时间延长,蛋白质的水解度趋于稳定。
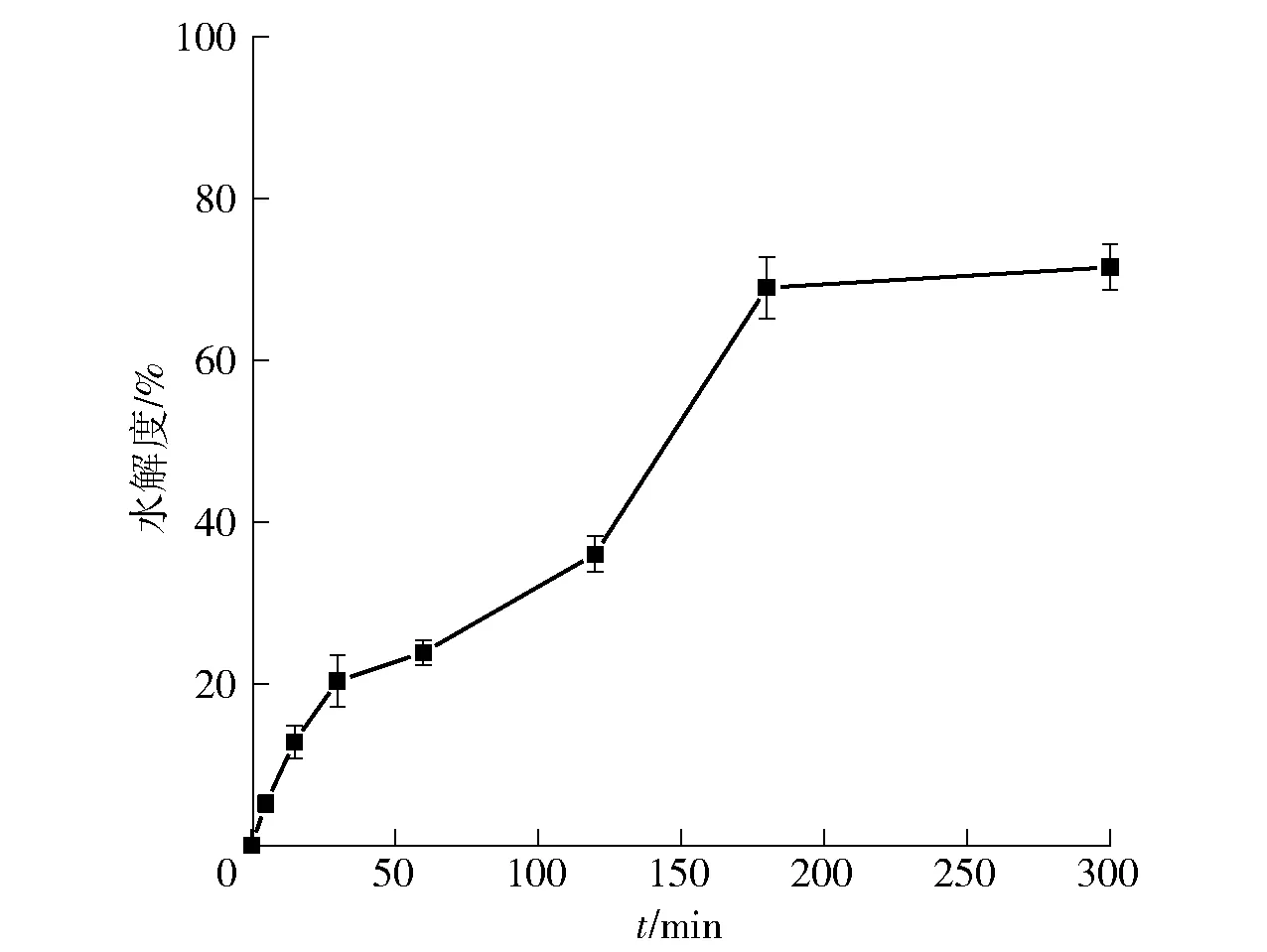
图2 API的水解度随时间的变化Fig.2 Change of hydrolysis degree of API in different times
2.2.2对API分子质量的影响
图3为胃蛋白酶酶解处理后APIH的非还原电泳图。由图3可看出,API酶解前后的分子质量分布差异显著。API的分子质量主要集中于35~70 kDa,APIH电泳图谱中大分子量的条带(>25 kDa)全部消失,生成了若干个小分子质量条带(10~25 kDa),其中分子质量10 kDa处的条带颜色随酶解时间增加而逐渐加深。这是由于酶解作用促使蛋白质聚集体的肽键断裂,产生小分子蛋白质亚基和多肽[18]。

图3 不同酶解时间API的SDS- PAGEFig.3 SDS- PAGE of API with different enzymolysis time
2.2.3对API粒径与电位的影响
酶解产物粒径大小可以反映水解对于蛋白质分子结构的影响,不同酶解时间对API粒径、ζ-电位的影响情况见图4。由图4可知,API酶解产物粒径随酶解时间延长呈先减小,后增大的趋势。当酶解时间在0~60 min时,粒径逐渐减少,这可能是因为大分子蛋白质变成小分子多肽,使得粒径减少;在酶解时间超过60 min时,粒径逐渐增大,这可能是因为长时间酶解,部分蛋白质间发生共价聚集,使得粒径有所增大。ζ-电位可反映蛋白质表面的电荷分布情况,由图4可知,随着酶解时间增加,ζ-电位的绝对值由39.82降低至20.06,这可能是因为,在胃蛋白酶酶解过程中发生脱氨基作用,会使蛋白质所携带的正电荷增加,中和了溶液中的部分负电荷[19],因此ζ电位的绝对值逐渐减小。

a~f代表不同组别间粒径存在显著差异(P<0.05);A~D代表不同组别间样品的电位存在显著差异(P<0.05)。图4 酶解时间对API粒径、ζ-电位的影响Fig.4 Effect of different enzymolysis time on particle size, zeta potential of API
2.2.4对API表面疏水性的影响
表面疏水性是衡量蛋白质溶液行为或表面相关特性的重要参数之一,影响着蛋白质的结构与功能特性,疏水基团的暴露有利于加速蛋白质在界面上的吸附及其随后的变性[20]。不同酶解时间对API表面疏水性的影响见图5。由图5可看到,API表面疏水性随酶解时间的增加呈先增加后下降的趋势,且酶解60 min时APIH的表面疏水性最高。表面疏水性主要是由蛋白质中分散的或聚集的颗粒决定的,酶解时间在0~60 min,表面疏水性下降,这可能是因为当进行适度水解时,蛋白质部分展开,掩埋在分子内部的疏水基团暴露出来,表面疏水性也会随之增加[21];但随着酶解反应的进行,水解度不断增大,蛋白质发生共价聚集,促进疏水基团掩埋而减少,因此当酶解时间大于60 min,表面疏水性逐渐下降。
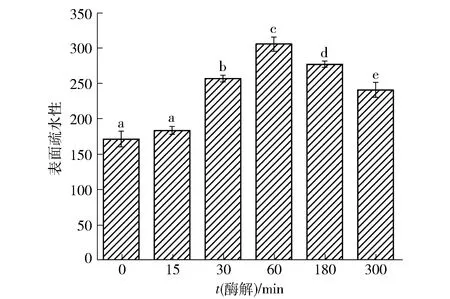
不同小写字母表示不同组别间存在显著差异(P<0.05)。图5 不同酶解时间对API表面疏水性的影响Fig.5 Effect of different enzymolysis time on surface hydrophobicity of API
2.2.5对API界面吸附行为的影响

图6 不同酶解时间对API溶液界面张力的影响Fig.6 Effect of different enzymolysis time on surface tension of API
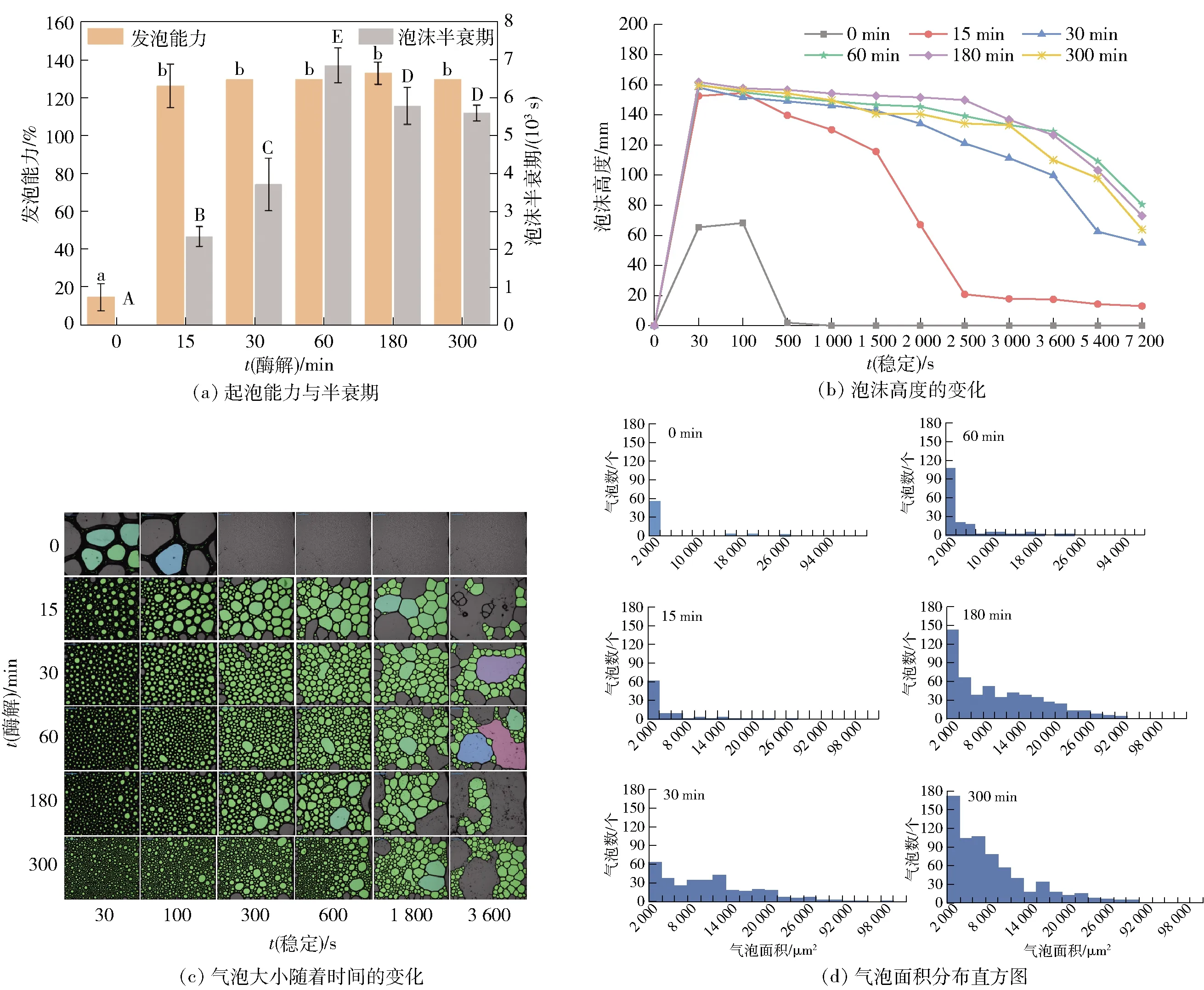
图(a)中a、b表示不同组别间发泡能力存在显著差异(P<0.05);A~D表示不同组别间泡沫半衰期存在显著差异(P<0.05)。图7 不同酶解时间对API泡沫特性的影响Fig.7 Effect of different enzymolysis time on foam characteristics of API
蛋白质的界面膜性质会影响泡沫的性质。API在气- 水界面的界面张力随酶解时间变化趋势如图6。由图6可知,样品的界面张力值均随吸附时间的增加而减小,与未酶解的相比,酶解反应得到的APIH界面张力衰减速率增加且界面张力降低,这是由于APIH具有更小的分子质量,可以快速地吸附到气水界面[22]。由此可知,适当的酶解可降低API的表面张力,提高其泡沫稳定性。
2.3 不同酶解时间对API泡沫特性的影响
2.3.1对起泡性的影响
图7对比了API、APIH的起泡性的差异。由图7(a)、图7(b)可知:APIH具有更好的起泡特性,这可能是由于API的分子质量较大,在气- 水界面达到吸附平衡的时间较长,在酶解作用下形成的APIH具有更小的分子质量,可以更快地吸附到气液界面上形成吸附层[23]。从图7(b)的泡沫高度衰减曲线可看出,随酶解时间延长,泡沫半衰期呈先增加后降低趋势,即APIH的泡沫半衰期明显高于API,在持续时间为7 200 s时APIH仍有泡沫存在,可见API经酶解处理其起泡性与泡沫稳定性均得到了显著性提高。
由图7(c)可知,随着酶解时间的延长,气泡的数量由于空气的扩散沥水、凝集及歧化等反应而减少,起泡的大小也随放置时间延长而增大。图7(d)进一步对起泡初始阶段的气泡面积分布进行分析,单独API的气泡数量小且气泡面积大小不一,泡沫稳定性差。APIH的气泡多且大小分布更为均匀,因此可以避免发生歧化反应,这在一定程度上有利于泡沫的稳定[24]。
2.3.2对泡沫微观结构的影响
图8为通过激光共聚焦显微镜观察酶解对API起泡性与泡沫稳定性的影响结果。由图8可见,蛋白质(标记为红色)吸附于气液界面上形成气泡,在0 min时,API的气泡数量小且面积较大,泡沫已出现相互挤压呈多边形态,而APIH的气泡数量增加,面积分布更为均匀。在泡沫放置过程中会发生排水、聚合、歧化现象[25],所以在放置30 min后,API与APIH单独稳定的泡沫数量均有不同程度的降低、泡沫直径变大。
2.3.3对泡沫界面结构的影响
图9为SEM观察到的API和APIH稳定气泡的界面结构。由图9可见,气泡表面被API和APIH包裹着,说明API与APIH均可吸附于气- 水界面上。图中API形成的气泡仍存在一定空隙,这可能是因为API的表面电荷量较大,分子间发生静电斥力,导致API未能完全包裹住气泡[26]。随水解度增加,带电量逐渐减小,静电斥力减弱,APIH在气液界面上形成致密的包裹层。

图8 API及APIH稳定的泡沫随酶解时间变化的CLSM图像Fig.8 CLSM images of bubbles stabilized by API and APIH over enzymolysis time

图9 API及APIH稳定的泡沫随酶解时间变化的SEM图Fig.9 SEM images of bubbles stabilized by API and APIH over enzymolysis time
2.4 APIH1800的添加对蛋糕发泡剂特性及蛋糕品质的影响
2.4.1对蛋糕发泡剂的流变特性与泡沫特性影响
泡沫流变特性与蛋糕的组织结构和口感有较大的关联性,同时发泡剂的发泡能力与蛋糕的质构、外观、内部组织结构、形态等均有影响。图10为蛋糕发泡剂的流变与泡沫特性分析结果。图10(a)显示了API酶解180 min产物(APIH180)的添加量对泡沫流变特性的影响。由图可知,随着振荡频率的增加,所有样品的储能模量(G′)与损耗模量(G″)均逐渐增加。APIH180添加量为0时,泡沫的G′与G″最大,说明泡沫具有最强的黏弹特性。对比蛋清发现,随着APIH180添加量的增加,G′与G″均出现逐渐下降的趋势,说明APIH180的添加导致了蛋清泡沫黏弹特性的降低。由图10(b)可看出,发泡剂的泡沫体积随APIH180添加量的增加呈下降趋势,当APIH添加量为20%时,泡沫体积与全蛋清无显著差异。
2.4.2对蛋糕比容与色度的影响
蛋糕的比容和宏观图见图11,蛋糕的色度见表1。由图11和表1可知,蛋糕的比容随APIH180的添加呈先增大再减小趋势,当替代度为20%时,蛋糕的比容最大;但当APIH180替代度增加到60%时,蛋糕的比容显著性降低,这可能是因为在APIH180添加量过多时,形成的泡沫网络结构比较脆弱,泡沫稳定性较差,在烤制过程中,泡沫的机械强度可能无法支撑蛋糕的膨胀速度,导致界面膜破损,比容减小[27]。从色度测定结果分析,蛋糕表面色度差异明显,其中替代度为20%时蛋糕表面色度与全蛋差异最小。

图(b)中不同小写字母表示不同组别间差异显著(P<0.05)。图10 APIH180不同添加量对蛋糕发泡剂流变与泡沫特性的影响Fig.10 Effect of APIH180 concentration on rheology and foam properties of foaming agent

图(a)中不同小写字母表示不同组别间差异显著(P<0.05)。图11 APIH180不同添加量对蛋糕比容的影响Fig.11 Effect of APIH180 concentration on specific volume of cake
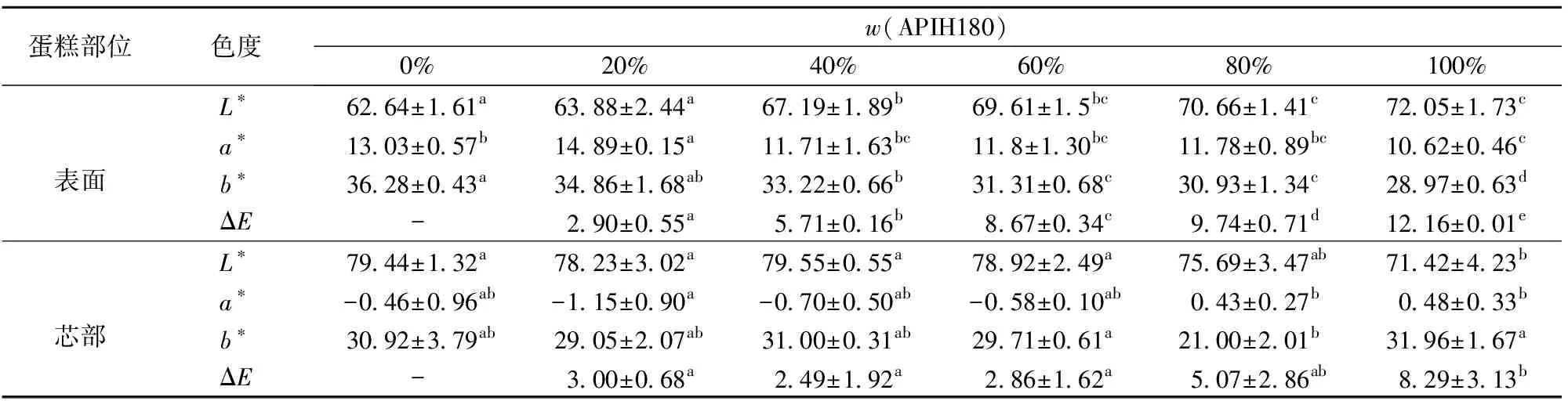
表1 APIH180不同添加量对蛋糕色度的影响

不同小写字母表示不同组别间差异显著(P<0.05)。图12 APIH180不同添加量对蛋糕质构特性的影响Fig.12 Effect of APIH180 concentration on texture properties of cakes
2.4.3对蛋糕质构特性的影响
TPA全质构分析仪可通过模拟人的咀嚼来评价蛋糕品质的好坏,图12显示了APIH180添加量对蛋糕硬度、弹性、咀嚼性与回复性的影响。从图12(a)可知,随着APIH180的增加,蛋糕弹性先增加后减少,在APIH180为20%时蛋糕的弹性达到最大。从图12(b)、图12(c)可以看出,起泡剂为蛋清时,蛋糕的硬度与咀嚼性均较大,随着APIH180的增加,蛋糕的硬度呈现先减小后增加的趋势,当APIH180添加量为20%时,其硬度最小。蛋糕咀嚼性在APIH180为20%时开始出现减小的趋势,APHI180为40%时咀嚼性显著降低。从图12(d)可知,随APIH180添加量增加,蛋糕的回复性呈现先增加后减小的趋势,当APIH180为100%时,其回复性最小。由以上结果分析可知:APIH180的添加量在20%时可以增加蛋糕的弹性,降低蛋糕的硬度;当APIH180替代蛋清为0~40%时,对蛋糕质构性能影响较小,但是当APIH180替代度大于60%时,弹性与咀嚼性显著变差,影响蛋糕的结构与口感。
3 结 论
本研究以酶解改性调控API的起泡特性为目标,系统研究了酶解时间对API理化及起泡特性的影响。结果表明:API经胃蛋白酶酶解处理后,其酶解产物的粒径、分子质量(10~25 kDa)与电位值(-20.06)均减小,表面疏水性增加,APIH的起泡性和泡沫稳定性显著增加。在此基础上,将酶解180 min后的API作为发泡剂部分替代到蛋糕生产中,当APIH添加量为20%~40%时,不仅蛋糕的质构和起泡性表现良好,且赋予蛋糕独特的外观、口感与风味。本研究旨在进一步开拓API作为发泡剂应用的可能性,并为其在食品等领域的开发和利用提供理论与技术参考。
