丝氨酸蛋白酶Omi/HtrA2表达增加促进心肌衰老的作用
2021-11-04吕坤译刘慧荣
隗 歆 刘 丹 武 烨,2 吕坤译 申 言 刘慧荣,2*
(1. 首都医科大学基础医学院生理学与病理生理学系,北京 100069; 2. 代谢紊乱相关心血管疾病北京市重点实验室,北京 100069; 3. 首都医科大学燕京医学院,北京 101300)
数据[1]显示,中国老年人口已超过1.5亿,老年人口即60岁以上人口比例超过10%即进入老龄化社会,因此研究衰老的机制尤为重要。衰老是多种疾病的严重危险因素,如心血管疾病、神经退行性疾病、癌症、慢性阻塞性肺疾病、代谢性疾病等[2]。衰老也可被独立定义为一种疾病[3],表现为衰老细胞永久性生长停滞、细胞形态结构及蛋白质表达谱的改变[4],但细胞衰老的生物学机制尚不十分清楚。
目前已知诱发衰老的机制包括线粒体损伤[5]、DNA损伤[6]、端粒功能障碍[7]等。越来越多的证据[8]表明,线粒体功能障碍是衰老的潜在调节机制。已知线粒体参与能量合成代谢、活性氧的产生、钙铁的细胞内稳态及细胞凋亡等多种细胞代谢[9-11],对于细胞存活至关重要。损伤线粒体在细胞内积聚,线粒体功能障碍使活性氧生成增加,从而加重氧化应激损伤是细胞衰老的重要机制之一[12]。损伤线粒体主要通过线粒体内蛋白酶修复线粒体蛋白的功能及线粒体自噬降解损伤线粒体,共同维持线粒体质量调控。线粒体质量控制是保证线粒体功能的基础,研究[13]显示,一种线粒体质量调控蛋白丝氨酸蛋白酶Omi/HtrA2定位于线粒体膜间隙,作为伴侣蛋白降解错误折叠的线粒体,修复线粒体功能。在神经组织中,Omi/HtrA2通过保障线粒体质量发挥神经保护作用,Omi/HtrA2的缺乏致线粒体功能障碍是神经退行性疾病的重要发病机制[14]。相反,在心肌组织中Omi/HtrA2表达的增加介导老年心肌损伤,加剧心肌细胞凋亡及缺血再灌注损伤的易感性[15],提示Omi/HtrA2对细胞的存活具有双重作用[16-17]。
文献[18]报道,Omi/HtrA2的活性丧失会引起线粒体功能障碍,促进小鼠早衰。同时,Omi/HtrA2表达过度增加也会引起线粒体功能障碍[19],但Omi/HtrA2对衰老是否也具有双重作用,表达增加的Omi/HtrA2是否影响细胞衰老仍不十分清楚。
本文探讨了在心肌中表达增加的Omi/HtrA2是否也参与细胞衰老的发生,为Omi/HtrA2对细胞衰老的影响提供病理生理学依据。
1 材料与方法
1.1 实验动物
心肌特异性过表达Omi/HtrA2转基因小鼠(4月龄,雄性)由赛业广州生物科技有限公司提供[实验动物许可证号:SCXK(粤)2008-0090]。 转基因小鼠分为野生型WT组与心肌特异性过表达Omi/HtrA2的Omi组,每组6只。实验动物的使用遵循中华人民共和国卫生部令(现国家卫生健康委员会)(第55号)—医学实验动物管理实施细则以及首都医科大学实验动物管理细则。所有实验动物通过首都医科大学动物保护伦理委员会批准(伦理编号: AEEI-2018-028)。
1.2 主要试剂与材料
H9c2细胞系(北京协和细胞库)、Omi/HtrA2稳转H9c2细胞系(赛业生物科技有限公司)、胎牛血清(Peak Serum公司,美国)、青链霉素混合液(北京索莱宝科技有限公司)、DMEM高糖培养基(Nalgene公司,美国)、胰蛋白酶(Sigma公司,美国)、PBS(Hyclone公司,美国)、BCA蛋白分析试剂盒及细胞衰老β-半乳糖苷酶染色试剂盒(碧云天生物技术有限公司)。UCF101(Merck公司,美国),p53抗体(ab26)、p21抗体(ab109199,ab188224)、p16抗体(ab51243,Abcam公司,英国),GAPDH抗体(E12-052)、β-tublin抗体(E12-043,南京恩晶生物科技有限公司),山羊抗兔IgG/生物素标记(ZB2301)、山羊抗小鼠IgG/生物素标记(ZB2305,北京中杉金桥公司) 。
1.3 主要仪器
多功能化学发光成像分析系统(BG-gdsAUTO710Pro,北京百晶生物技术有限公司),光学显微镜(Olympus公司,日本)。
1.4 细胞培养及药物刺激
含10%(体积分数)FBS DMEM高糖培养基培养细胞于CO2培养箱内至60%细胞密度,加入Omi/HtrA2特异性抑制剂UCF101刺激Omi/HtrA2稳转H9c2细胞48 h,检测后续指标。
1.5 Western blotting法检测衰老标志物表达水平
Western blotting心肌组织样品制备:取冻存心肌组织10 mg,加入100 μL RIPA裂解液,1 μL PMSF蛋白酶抑制剂,1 μL蛋白磷酸酶抑制剂。匀浆破碎心肌组织后,超声波细胞破碎仪破碎匀浆液20次,12 000 r/min 10 min离心吸取上清弃沉淀。BCA法测蛋白浓度,1∶20比例稀释心肌组织上清液(1 μL上清+19 μL蒸馏水),50倍体积BCA试剂A∶1倍体积BCA试剂B制备BCA工作液,每孔加入100 μL BCA工作液,37 ℃水浴30 min,酶标仪读取562 nm吸光度,按照BCA标准曲线计算各上清浓度,加入蒸馏水稀释各样品至最低浓度,加入1/4体积5×lodding buffer上样缓冲液,99 ℃金属浴10 min,-20 ℃保存样品。
Western blotting细胞样品制备:待细胞长到80%~90%密度,PBS洗3次,六孔板每小皿细胞加入80 μL RIPA裂解液,0.8 μL PMSF蛋白酶抑制剂,0.8 μL蛋白磷酸酶抑制剂。刮取细胞于Ep管内,超声波细胞破碎仪破碎细胞悬浊液20次,12 000 r/min 10 min离心吸取上清弃沉淀。BCA法测蛋白浓度,加入1/4体积5×lodding buffer上样缓冲液,99 ℃金属浴10 min,-20 ℃保存样品。
制备12%(质量分数)分离胶,上样量为30 μg蛋白,采用80 V恒压电泳至样品自浓缩胶进入分离胶,改为120 V待样品跑至最底层。400 mA 恒流湿转1 h,蛋白转移至PVDF膜后,5%(质量分数)封闭牛奶室温孵育1 h,TBST洗3次,10 min/次,在对应条带位置分别加入p53、p21、p16、GAPDH和β-tublin,4 ℃孵育过夜。TBST洗3次,二抗室温孵育1 h,TBST洗3次,按1∶1比例配制发光液,置于多功能化学成像发光仪检测条带并用Image J分析条带灰度值。
1.6 β-半乳糖苷酶染色检测细胞衰老
PBS洗细胞3次,加入β-半乳糖苷酶染色固定液,室温孵育15 min,根据说明书配制β-半乳糖苷酶染色工作液,37 ℃水浴孵育过夜,光学显微镜观察并拍照。
1.7 统计学方法
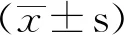
2 结果
2.1 Omi/HtrA2过表达心肌组织衰老标志物表达增加
与野生型相比,Omi组(心肌特异性过表达Omi/HtrA2小鼠)心肌内Omi/HtrA2表达显著增加(1.007±0.379vs0.456±0.216,P<0.01)(图1A)。
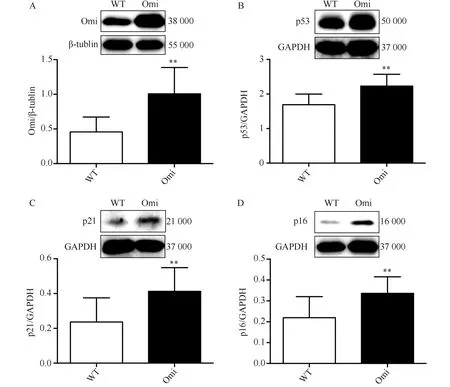
图1 Omi/HtrA2过表达心肌组织衰老标志物表达增加Fig.1 The senescence markers increased in the myocardium of overexpressed cardiac-specific Omi/HtrA2 transgenic miceA: Western blotting shows that the expression of Omi/HtrA2 increased in Omi group compared with WT group; B-D: Western blotting results show the expression of senescence markers p53, p21 and p16 increased in Omi group compared with WT group. **P<0.01 vs WT group; n=6 per group. WT: wild type group; Omi: overexpressed cardiac-specific Omi/HtrA2 transgenic mice group.
与野生型相比,Omi组心肌p53表达显著增加(2.227±0.343vs1.691±0.308,P<0.01),p21表达增加(0.413±0.136vs0.237±0.190,P<0.01),p16表达增加(0.336±0.079vs0.220±0.128,P<0.01)(图1B、C、D)。
2.2 衰老标志物p53、p21、p16与心肌表达增加的Omi/HtrA2呈正相关
衰老标志物p53的表达与心肌组织内Omi/HtrA2的表达呈正相关(r=0.530 8,P<0.05),p21的表达与Omi/HtrA2表达呈正相关(r=0.590 5,P<0.05),p16的表达与Omi/HtrA2表达呈正相关(r=0.643 1,P<0.05)(图2)。
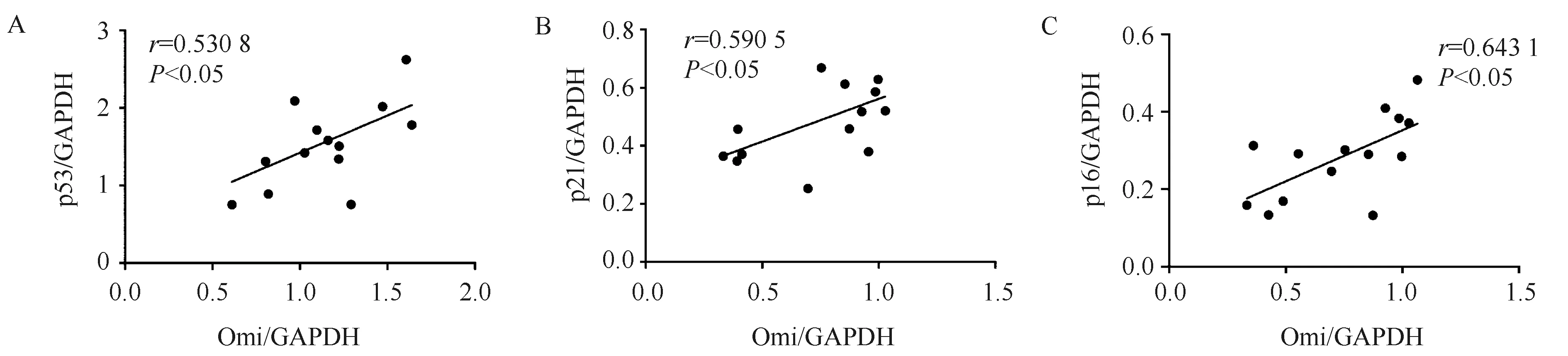
图2 Omi/HtrA2与衰老标志物表达呈正相关Fig.2 Positive correlation between senescence markers and Omi/HtrA2A-C: The positive correlation between senescence markers p53,p21,p16 and Omi/HtrA2. n=13-14 per group; Omi: overexpressed cardiac-specific Omi/HtrA2 transgenic mice group.
2.3 Omi/HtrA2特异性抑制剂UCF101改善Omi/HtrA2引起的细胞衰老
与对照组H9c2细胞系相比,稳转Omi/HtrA2细胞p53表达增加(0.936±0.108vs0.586±0.036,P<0.05),p21表达增加(0.292±0.008vs0.155±0.019,P<0.01),p16表达显著增加(0.436±0.069vs0.138±0.083,P<0.01)。
Omi/HtrA2特异性抑制剂UCF101处理Omi/HtrA2稳转H9c2细胞48 h后,结果显示:与Omi组细胞相比,Omi+UCF101组衰老标志物p53表达降低(0.682±0.031vs0.936±0.108,P<0.01),p21表达降低(0.215±0.022vs0.292±0.008,P<0.05),p16表达降低(0.220±0.055vs0.436±0.069,P<0.05)(图3)。
图3 Omi/HtrA2特异性抑制剂UCF101改善Omi/HtrA2稳转细胞衰老Fig.3 The cellular senescence was ameliorated in Omi/HtrA2 overexpressed H9c2 cells treated by Omi/HtrA2 inhibitor UCF101A-C: Western blotting shows the expression of senescence markers p53, p21 and p16 decreased in Omi/HtrA2+UCF101 group compared with Omi group. D: The β-Galactosidase staining results show the senescent cells decreased in Omi+UCF101group compared with that in Omi group. Scale bar: 100 μm. *P<0.05, **P<0.01 vs control group; #P<0.05, ##P<0.01 vs Omi group; Control group: H9c2 cells; Omi group: Omi/HtrA2 overexpressed H9c2 cells; Omi+UCF101 group: Omi/HtrA2 overexpressed H9c2 cells treated by UCF101. n=4 per group.
3 讨论
我国已进入老龄化社会,而且老龄化程度正在逐年加剧。在我国老年群体中存在多种年龄相关疾病,如心血管疾病、神经退行性疾病、代谢性疾病等,其发病率随年龄增长显著增加[2]。细胞衰老是机体整体衰老的结构基础,因此研究细胞衰老的机制十分重要。
文献[20]报道,对衰老细胞的清除可从器官及整体水平逆转衰老。但心肌组织属于永久性细胞,不可再生,因此无法通过清除衰老细胞,逆转心肌衰老。已知心血管疾病的致死率在我国居首位[21],且衰老是心血管疾病的独立危险因素[22],因此,研究心肌衰老的机制十分重要。
目前已知多种因素参与衰老的诱发,越来越多的证据[8]表明,在多种细胞衰老的机制中,线粒体功能障碍是衰老的重要调节机制。线粒体作为真核细胞的“能力工厂”,通过氧化磷酸化分解葡萄糖和脂肪酸产生能量(ATP)。同时,线粒体还参与降解细胞内错误折叠蛋白[23]、钙铁的细胞内稳态及凋亡信号转导等,对细胞代谢及存活至关重要[9]。线粒体质量调控包括线粒体生物发生[24],线粒体内蛋白酶修复损伤线粒体[25]及线粒体自噬降解损伤线粒体[26]等。线粒体质量调控异常导致损伤线粒体的过度积累,加重氧化应激损伤从而诱发细胞衰老的发生[27]。因此,线粒体质量异常是细胞衰老的重要诱因[28-29]。
本实验室前期研究[30]了一种线粒体质量调控蛋白Omi/HtrA2,Omi/HtrA2由核基因编码,定位于线粒体膜间隙发挥伴侣蛋白的作用,调控线粒体质量。在线粒体破裂或线粒体外膜通透性增加时,释放入胞质,与抗凋亡蛋白XIAP结合,激活Caspase3,促进凋亡的发生[31]。文献[32]报道,Omi/HtrA2的缺乏严重影响线粒体质量,且Omi/HtrA2活性丧失诱发小鼠早衰。同时,Omi/HtrA2的表达增加也可影响线粒体功能,参与线粒体损伤[19]。这提示Omi/HtrA2对线粒体质量的调控具有双重作用,但Omi/HtrA2对细胞衰老是否也具有双重作用?Omi/HtrA2表达增加是否影响细胞衰老,Omi/HtrA2表达增加是否可作为衰老的标志仍不十分清楚。
本文探讨Omi/HtrA2表达增加是否促进细胞衰老。通过Western blotting法检测衰老标志物表达水平及β-半乳糖苷酶阳性细胞率反映衰老指标的改变。已知细胞周期不可逆停滞是细胞衰老的重要标志。衰老标志物有p53、p21和p16。p53/p21信号通路通过调控细胞周期激活细胞衰老的发生[33]。已知p53在多种损伤刺激下活化,激活下游衰老标志物p21和有丝分裂关键蛋白E2F7,共同参与G1细胞周期的阻滞。p16随年龄呈指数型增加,是最强的衰老标志物之一。独立于p53/p21通路,通过阻止DNA复制的启动,参与细胞周期G1/S检查点的阻断。β-半乳糖苷酶是细胞衰老的重要标志物,在细胞周期被抑制后,β-半乳糖苷酶活性增加,是目前检测细胞衰老的金标准[34]。
在本研究中,为验证心肌中过表达Omi/HtrA2是否促进细胞衰老,笔者构建心肌特异性过表达Omi/HtrA2小鼠,Omi/HtrA2表达显著增加。同时发现,心肌组织中特异性过表达Omi/HtrA2,衰老标志物表达显著增加,且表达增加的Omi/HtrA2与衰老标志物p53、p21、p16呈正相关。本课题组在细胞水平构建Omi/HtrA2稳转H9c2细胞系,过表达Omi/HtrA2后,衰老标志物及β-gal染色阳性率增加,通过UCF101抑制Omi/HtrA2功能,可改善衰老指标。本文证实Omi/HtrA2表达增加促进心肌衰老。已知,Omi/HtrA2活性丧失也可加速小鼠早衰,这提示Omi/HtrA2对衰老的影响具有双重作用,即Omi/HtrA2活性丧失引起早衰,但Omi/HtrA2过度表达也会引起细胞衰老。因此Omi表达失衡均会引起细胞衰老,保持Omi/HtrA2的水平平衡是保障Omi/HtrA2发挥细胞保护作用的关键机制。
那么Omi/HtrA2表达增加可能通过何种机制介导衰老的发生?文献[18]报道,Omi/HtrA2缺乏引起线粒体功能障碍,加剧细胞衰老。那么Omi/HtrA2作为伴侣蛋白降解错误折叠的线粒体蛋白。Omi/HtrA2表达过度增加可能在线粒体内对线粒体膜间隙蛋白降解过度,影响线粒体功能;此外,已知线粒体动力学即线粒体分裂融合的平衡是把控线粒体质量的关键因素之一[35]。Omi/HtrA2还可与线粒体内膜蛋白OPA1相互作用[36],调控线粒体融合,这提示Omi/HtrA2表达过度增加可能通过影响线粒体动力学,引起线粒体分裂融合失衡,进而影响线粒体质量,参与衰老的发生。
本课题组前期研究[37]显示,心肌中Omi/HtrA2的表达随年龄增加,且老年时增加的p53通过激活Omi/HtrA2的转录促进其在心肌中的表达。本文证实Omi/HtrA2过度表达还可进一步加重心肌衰老,形成心肌衰老损伤的恶性循环,提示维持Omi/HtrA2水平的稳态对维持心肌功能,减缓衰老进程具有重要作用。
本文证实Omi/HtrA2过度表达促进心肌衰老,为Omi/HtrA2表达增加对细胞衰老的影响提供了病理生理学依据。
