视神经脊髓炎谱系疾病与多发性硬化患者部分脑脊液免疫标志物的比较分析
2021-11-04时丽丽王金玲王怡斐王培昌
时丽丽 王金玲 王怡斐 李 蕾 王培昌*
(1. 首都医科大学宣武医院检验科,北京 100053; 2. 首都医科大学医学检验技术系,北京 100053)
中枢神经系统(central nervous system,CNS)炎性脱髓鞘疾病是一类免疫介导的髓鞘脱失为主的疾病,最常见的是多发性硬化症(multiple sclerosis, MS)和视神经脊髓炎(neuromyelitis optica,NMO)。既往认为NMO是MS的一种特异亚型,但随着水通道蛋白-4(aquaporin-4,AQP4)自身抗体NMO-IgG的发现,表明NMO是独立于MS之外的一类炎性脱髓鞘疾病,其病理学机制有别于NMO。然而,MS与视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders,NMOSD)的临床表现相似,且其诊断均基于临床症状和体征,结合磁共振成像(magnetic resonance imaging,MRI)和实验室检查结果[1],临床上不易鉴别。另外,针对MS患者的精准治疗方法会加重NMOSD的疾病严重程度[2]。因此,准确鉴别MS与NMOSD对于上述疾病精准治疗具有重要意义。鉴于MS、NMOSD鞘内免疫球蛋白合成异常,本文重点比较分析了上述两类疾病脑脊液(cerebrospinal fluid,CSF)免疫球蛋白及补体变化,并初步分析了其在两种疾病鉴别诊断中的价值。
1 对象与方法
1.1 研究对象
本研究收集了2018年1月至2021年1月就诊于首都医科大学宣武医院神经内科诊断为多发性硬化症与视神经脊髓炎的患者血清和CSF,选取多发性硬化患者33例、视神经脊髓炎谱系疾病患者58例作为研究对象。另选取头痛患者50例作为非炎性对照组(纳入标准:脑脊液白细胞<5个/mm3)。
1.2 纳入与排除标准
①MS诊断:依据McDonald 等[3]诊断标准。②NMOSD诊断:依据 2010年欧洲神经病学联盟诊断标准[4]。③排除标准:所有患者均排除高血压、糖尿病、心脑血管病、其他风湿免疫相关疾病、肝肾疾病、恶性肿瘤,近1个月内无发热、感染病等病史。
1.3 资料收集
于入院当天收集所有患者详细的病史资料,包括性别、年龄、发病时间与临床症状、既往病史与治疗史、MS和NMOSD家族史、血压、体质量等。
1.4 生化指标测定
入院72 h内,采集所有患者空腹>8 h的静脉全血、CSF。采用免疫比浊法测定血清白蛋白(albumin,ALB)、IgA、IgM、IgG、C3、C4和CSF IgA、IgM、IgG、ALB。检测系统为IMMAGE 800全自动免疫分析仪(Beckman coulter公司,美国),配套试剂、标准品、校准品与质控品,设置高、低两个水平质控。
根据Reibers推荐指南,计算Q值(脑脊液/血清,IgG Q,IgA Q,IgM Q和ALB Q),计算IgG 24 h鞘内合成率。与年龄相关的Reiber双曲线上部判别值(Reiber’s upper hyperbolic discrimination line, Qlim)(ALB)的计算公式为4+(age/15)[5]。 ALB Q与ALB Q>Qlim (ALB)可用于血-脑脊液屏障功能评估。
1.5 统计学方法
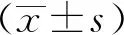
2 结果
2.1 3组患者间性别与年龄比较
3组患者间性别比例差异有统计学意义(P<0.01),NMOSD组女性比例明显高于MS及头痛组;组间年龄差异无统计学意义(P>0.05),详见表1。
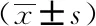
表1 MS、NMOSD与对照组性别与年龄的比较
2.2 3组患者间血清免疫球蛋白与补体浓度的比较
3组患者血清IgA、IgM、IgG、C3和C4浓度,差异均无统计学意义(P>0.05)。详见表2。
2.3 3组患者间CSF免疫球蛋白与补体浓度的比较
CSF ALB、IgA、IgM在3组间差异无统计学意义(P>0.05),但3组患者间CSF IgG浓度差异有统计学意义(P<0.05),MS组和NMOSD组明显升高。详见表3。
2.4 3组患者间熵值(Q值)比较
MS、NMOSD与头痛对照组IgA Q、IgM Q呈依次下降趋势,但各组间差异无统计学意义(P>0.05); MS、NMOSD和对照组的IgG Q及IgG 24 h鞘内合成率差异有统计学意义(P<0.05);两两比较显示,MS组明显高于NMOSD组,两组均高于HA组(P<0.05)。详见表4。

表4 MS、NMOSD与对照组Q值和24 h鞘内合成率比较 Tab.4 Comparison of Q value and 24 h intrathecal synthesis rate of IgG between MS and NMOSD and the control
表2 MS、NMOSD与对照组血清免疫球蛋白与补体的比较
Tab.2 Comparison of serum immunoglobulin and complements between MS and the NMOSD and the control group
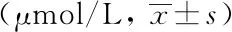
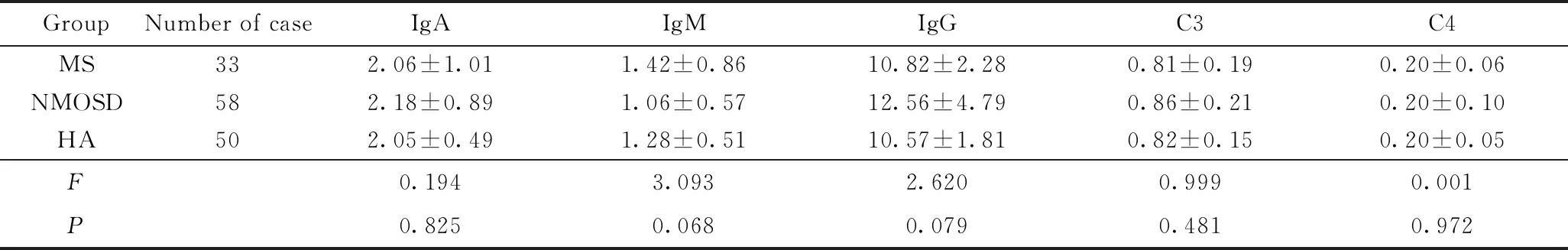
GroupNumber of caseIgAIgMIgGC3C4MS332.06±1.011.42±0.8610.82±2.280.81±0.190.20±0.06NMOSD582.18±0.891.06±0.5712.56±4.790.86±0.210.20±0.10HA502.05±0.491.28±0.5110.57±1.810.82±0.150.20±0.05F0.1943.0932.6200.9990.001P0.8250.0680.0790.4810.972
表3 MS、NMOSD与对照组CSF免疫球蛋白水平分析
Tab.3 Analysis of CSF immunoglobulin between MS, NMOSD and the control group
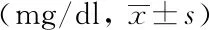
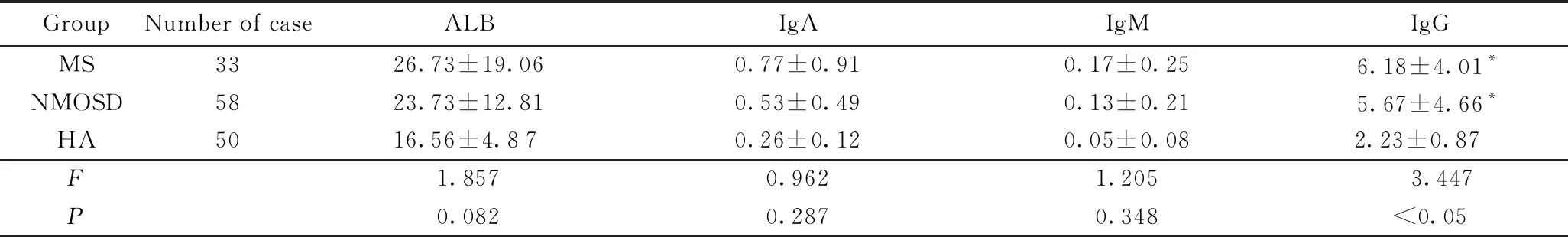
GroupNumber of caseALBIgAIgMIgGMS3326.73±19.060.77±0.910.17±0.256.18±4.01*NMOSD5823.73±12.810.53±0.490.13±0.215.67±4.66*HA5016.56±4.870.26±0.120.05±0.082.23±0.87 F1.8570.9621.205 3.447P0.0820.2870.348<0.05
2.5 3组患者间ALBQ与ALBQ>Qlim (ALB)比较分析
3组间ALB Q差异无统计学意义(P>0.05);3组间ALBQ>Qlim (ALB)的比例差异有统计学意义(P<0.05);两两比较显示,MS组和NMOSD组明显高于HA组(P<0.05)。详见表5。
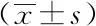
表5 MS、NMOSD与头痛对照组ALB Q与ALB Q>Qlim (ALB)比例的分析
3 讨论
MS是中枢神经系统最常见的自身免疫性脱髓鞘病,全球MS患者约两百多万,其中我国MS患者约占1.5%。NMOSD是一种中枢神经系统特异性抗体脱髓鞘的神经疾病[6-7]。MS通常缺乏疾病特异性抗体,而NMOSD的特点是存在特异性抗体,如抗水通道蛋白4免疫球蛋白G和抗髓鞘少突胶质细胞糖蛋白免疫球蛋白G[8]。前期研究[9]显示,MS患者病情变
化与细胞免疫有关,由于抑制性T细胞缺乏,免疫应答过度而致髓鞘破坏导致病情恶化。组织病理学检查显示,MS表现特点为中枢神经系统炎症、脱髓鞘病变和神经胶质瘢痕。NMOSD的疾病特点是严重且易复发的视神经炎和纵形扩展性脊髓炎。NMOSD的病理学特点为免疫球蛋白(IgG为主)沉积在血管周围、补体激活及嗜酸性细胞浸润,强烈提示其为Th2应答,不同于以Thl应答为主的MS。这提示体液免疫应答反应在NMOSD的发病机制中有着重要作用[10]。两组疾病均是神经系统炎症性疾病,本研究显示MS、NMOSD患者CSF IgG浓度均较非炎症性对照组高,既说明上述患者鞘内IgG合成升高,亦提示CSF IgG具有作为MS、NMOSD疾病诊断及监测标志物的潜在价值。
MS、NMOSD好发于20~40岁人群,本研究一般资料分析显示,MS和NMOSD患者女性居多,MS组的女性患者比例接近90%。表明女性可能为MS的独立风险因素。然而,本研究MS、NMOSD入组病例的年龄均值分别为42.1和46.1岁,可能与本院就诊人群存在一定关系。
血-脑脊液屏障(blood-brain barrier,BBB)是大脑的天然屏障,可阻止血液中蛋白质、脂肪酸等生物大分子和微生物病原体进入中枢神经系统或脑脊液中[11-12]。因为白蛋白只来源于血液,脑脊液/血清白蛋白熵(ALB Q)是目前评价血-脑脊液屏障通透性最简单和最可靠的生物标志物 。由于ALB Q的参考上限与年龄有关,根据Reiber[13]的研究, Qlim(ALB)的计算方法为4+(a/15),其中a代表患者年龄。ALB Q> Qlim(ALB)可有效评估血-脑脊液屏障功能损伤[5]。本研究结果表明,MS组和NMOSD患者均有血-脑脊液屏障障碍,但两组间ALB Q> Qlim(ALB)比例差异并无统计学意义,表明MS、NMOSD患者间血-脑脊液屏障损伤程度并没有明显区别[14]。以往有研究[15]显示,NMOSD的血-脑脊液屏障损伤程度高于MS,但其研究以ALB Q评估血-脑脊液屏障功能,未考虑年龄因素。
MS 分为三种临床表型: 复发缓解型 MS (relapse-remitting MS,RRMS)、原发性进展型 MS (primary progressive MS,PPMS)和继发性进展型 MS (secondary progressive MS,SPMS)[16]。大多数MS患者首先出现RRMS 阶段,特点是交替出现神经功能障碍和恢复。这个阶段后(在20~25年内),60%~70%的RRMS患者进入SPMS 阶段,以神经功能衰退为主要临床特点[17]。在MS的所有临床亚型中,血-脑脊液屏障的病理变化是疾病过程的一个关键特征。急性MS表现为血-脑脊液屏障破坏,MRI 增强扫描和尸检证据显示,局灶性微血管渗漏和血管周围炎性细胞聚集。在PPMS和SPMS阶段,血-脑脊液屏障完整性持续丧失,特点是血管渗漏和紧密连接蛋白表达的减少[18]。而在NMOSD 急性期观察到MRI病变增强和/或脑脊液白蛋白渗漏增加。外周血浆细胞比鞘内浆细胞产生更多的AQP4抗体。当以外周血中的AQP4-IgG注射到正常小鼠体内时,其不足以诱导类似NMO的组织病理学改变。然而,这些抗体与预先激活的诱导中枢神经系统炎症的T细胞(导致血-脑脊液屏障破坏)可诱导实验动物出现类NMOSD疾病[19]。疾病特异性抗体AQP4-IgG的致病性,是通过血-脑脊液屏障或血-脑脊液屏障被动地从外周血转入中枢神经系统或脑脊液后产生的[20],并且有研究[21]证明,脑脊液中的 AQP4-IgG 主要来源于组织驻留者(如骨髓)或循环外周产生 AQP4-IgG 的浆细胞。因此,血-脑脊液屏障障碍和 AQP4-IgG 是NMOSD疾病进展的关键控制点。
IgG的脑脊液/血清比值(熵,IgG Q)反映了IgG通过血液渗入脑脊液的速度和鞘内IgG(IS-IgG)的合成速度。本研究显示,尽管MS组和NMOSD组的血-脑脊液屏障损伤程度没有明显差异,但MS组患者的IgG Q明显高于NMOSD组,提示MS组患者IS-IgG的合成快于NMOSD患者。IgG 24 h鞘内合成率是评估鞘内IgG合成的一个常用指标[22]。本研究数据表明,MS组的IgG 24 h鞘内合成率明显大于NMOSD组,进一步证明了两组疾病的病理学特征不同,为“NMOSD并非MS的一个疾病亚型”理论学说提供了进一步的证据。
近年研究[23]显示,鞘内IgG合成对MS有重要意义,在预测MS严重程度和预后中有重要作用,也有研究[24]指出,鞘内IgG合成的标志物,如IgG指数和比值IgGQ也与MS 神经预后显著相关。在本研究中,鞘内IgG合成的两个指标24h鞘内合成率和IgG Q,在MS组中均明显高于NMOSD组,但其与临床疾病特征,例如疾病复发和严重程度的关系,仍值得进一步研究。
综上所述,MS和NMOSD均有血-脑脊液屏障功能损伤,在疾病进展中有重要意义,而鞘内IgG的合成是MS和NMOSD的一个关键区分点,在两者的鉴别诊断中有重要意义。
