PTEN和Eg5蛋白在前列腺癌中表达及相关性
2021-11-03徐礼臻徐旻朱再生
徐礼臻 徐旻 朱再生

[关键词] 前列腺癌;PTEN 蛋白;Eg5 蛋白;免疫组织化学
[中图分类号] R737.2 [文献标识码] A [文章编号] 1673-9701(2021)17-0004-04
Expression and correlation of PTEN and Eg5 protein in prostate cancer
XU Lizhen XU Min ZHU Zaisheng
Department of Urology, Jinhua Hospital Affiliated to Zhejiang University Medical College, Jinhua 321000, China
[Abstract] Objective To detect PTEN and Eg5 protein in prostate cancer(PC) by immunohistochemistry, and to explore the correlation between the expression of PTEN and Eg5 protein and clinicopathology of prostate cancer. Methods Immunohistochemical SP method was used to detect the expressions of PTEN and Eg5 protein in 81 PC cases and 45 cases with prostatic hyperplasia in Jinhua Hospital Affiliated to Zhejiang University School of Medicine from December 2014 to March 2016. The clinicopathological data of PC patients were analyzed with PTEN and Eg5 expression. Spearmen was used to analyze the correlation between PTEN and Eg5 protein expression. Results The positive rate of PTEN protein expression was 25.93% (21/81) in PC and 88.89% (40/45) in benign prostatic hyperplasia (BPH), with statistically significant difference (P<0.05). The positive rate of Eg5 protein was 70.37%(57/81) in PC and 4.44% (2/45) in BPH, with statistically significant difference(P<0.05). The loss of PTEN protein expression and the increased expression of Eg5 protein were closely related to Gleason score, TNM stage, preoperative PSA, seminal vesicle invasion, pelvic lymph node metastasis and five-year biochemical recurrence of PC (P<0.05). Spearmen correlation analysis showed that the expression of PTEN was negatively correlated with the expression of Eg5 protein(r=-0.763, P<0.05). Conclusion The expression of PTEN protein decreases and Eg5 protein increases in PC, and their abnormal expressions are related to the progression of PC.
[Key words] Prostate cancer; PTEN protein; Eg5 protein; Immunohistochemistry
PTEN基因(Phosphatase and tensin homologue deleted on chromosome ten,PTEN)為具有脂质磷酸酶和蛋白磷酸酶活性的抑癌基因,位于10号染色体上[1-2],研究显示PTEN去磷酸化在肿瘤细胞增殖、分化、浸润、转移及肿瘤血管形成中有重要的作用[3]。Eg5(Kinesin spindle protein 5,Eg5)基因位于10q24.1,其翻译的蛋白产物由1057个氨基酸组成,在细胞有丝分裂过程中纺锤体定位、形成、染色体分离和细胞质分裂中起重要作用[4-5],异常表达干扰正常纺锤体的形成和功能,导致遗传不稳定和肿瘤发生[6-7]。虽然在前列腺癌中PTEN蛋白异常表达与其临床病理特征关系有部分研究,但PTEN和Eg5蛋白在前列腺癌中的异常表达相关性未见报道,本研究采用免疫组化SP(Streptavidin method,SP)法对PTEN和Eg5蛋白在前列腺癌中的表达及临床病理相关性及生化复发之间的关系进行研究,现报道如下。
1 资料与方法
1.1 一般资料
选取2014年12月至2016年3月浙江大学医学院附属金华医院81例前列腺癌患者,年龄51~83岁,中位年龄66.5岁,同时选取同期45例前列腺增生患者,所有患者的病理均经两名有经验的病理医师再次确认诊断。前列腺癌病理分级按Gleason分级系统[8],Gleason评分<7分45例,Gleason评分≥7分36例。临床分期按2002年AJCC的TNM分期标准[9],Ⅰ~Ⅱ期42例,Ⅲ~Ⅳ期39例。术前49例PSA(Prostate specific antigen,PSA)4~10 ng/mL,32例PSA>10 ng/mL,有精囊浸潤21例,无精囊浸润60例,18例有盆腔淋巴结转移,63例无盆腔淋巴结转移,5年有生化复发37例,5年无生化复发44例,所有前列腺癌患者术前均未接受放疗、化疗和内分泌治疗。本研究经本院医学伦理委员会同意,患者签署知情同意书。
1.2 方法
研究组织标本经4%甲醛溶液固定,常规石蜡包埋,连续切片,厚3 μm,分别行HE染色和免疫组化染色再次确认诊断;以磷酸盐缓冲液代替一抗作为阴性对照,兔抗人单克隆PTEN抗体、兔抗人单克隆Eg5抗体购自美国Abcam公司,免疫组化SP试剂盒、DAB显色试剂和二抗均为北京中杉生物技术公司产品,染色方法按说明书进行。PTEN抗体(工作浓度l∶150,规格:150 μg,批号:BS6265),Eg5抗体(工作浓度1∶100,规格:100 μg,批号:abs7431),用已知PTEN和Eg5染色阳性切片作对照。
1.3 观察指标及评价标准
PTEN蛋白主要表达于细胞质,细胞浆和细胞膜表达较少;Eg5蛋白主要表达于细胞质,胞浆及胞核中表达较少。每张切片在高倍镜下选定5个视野,每个视野计数100个肿瘤细胞,观察阳性细胞的百分比:阳性细胞百分数<50%为(-);>50%为(+)。
1.4 统计学方法
应用SPSS 23.0统计学软件进行数据分析,计数资料采用χ2检验或Fisher确切概率法进行统计学分析,采用Spearman等级相关分析PTEN与Eg5蛋白表达的相关性,PTEN和Eg5蛋白表达与前列腺癌5年生化复发采用Kaplan-Meier分析,以P<0.05为差异有统计学意义。
2 结果
2.1 PTEN蛋白和Eg5蛋白在前列腺癌和前列腺增生中的表达状况
PTEN蛋白表达于细胞质,细胞浆和细胞膜表达较少;Eg5蛋白表达主要表达在细胞质,而在胞浆及胞核中表达较少。PTEN和Eg5在前列腺癌中的表达见封三图1。
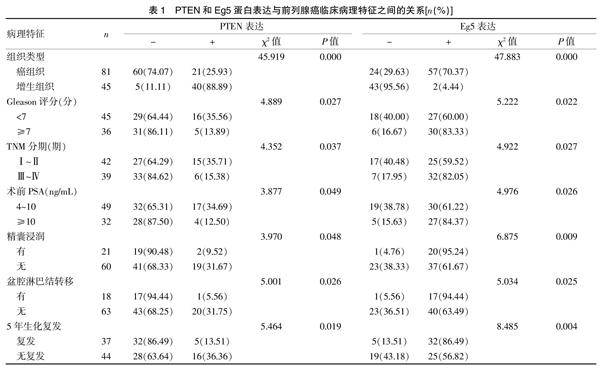
2.2 Eg5在前列腺癌表达与前列腺癌临床病理特征之间的关系
81例前列腺癌中 PTEN 蛋白表达率 25.93%(21/81),45例前列腺增生中PTEN蛋白表达率88.89%,二者比较,差异有统计学意义(P<0.05)。PTEN蛋白表达与前列腺癌Gleason评分、临床分期、术前PSA、精囊浸润、盆腔淋巴结转移及有无5年生化复发有关,差异有统计学意义(P<0.05)。Eg5蛋白在前列腺癌表达率70.37%(57/81),前列腺增生中表达率为4.44%(2/45),差异有统计学意义(P<0.05)。Eg5蛋白增高表达与前列腺癌Gleason评分、临床分期、术前PSA、精囊浸润、盆腔淋巴结转移及5年生化复发有关,差异均有统计学意义(P<0.05)。见表1。
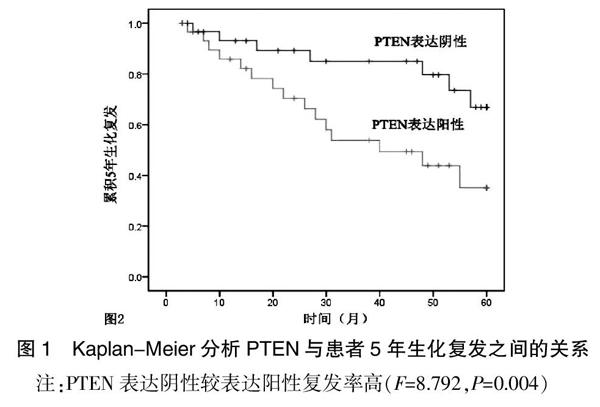
2.3 PTEN和Eg5蛋白表达与前列腺癌5年生化复发Kaplan-Meier分析结果
Kaplan-Meier分析PTEN和Eg5蛋白表达与前列腺癌患者5年生化复发之间的关系,81例前列腺癌中37例出现5年生化复发,44例无5年生化复发,PTEN蛋白表达阴性患者复发较PTEN表达阳性为高(P<0.05),Eg5蛋白表达阳性较表达阴性5年生化复发高(P<0.05)。见图1~2。
2.4 对前列腺癌中PTEN与Eg5蛋白Spearman相关性分析
对PTEN与Eg5蛋白在前列腺癌癌中表达的结果进行Spearman相关性分析显示,PTEN与Eg5蛋白的表达呈负相关(r=-0.763,P<0.05)。见图3。
3 讨论
多基因参与前列腺癌的发生进展,研究发现前列腺癌发生进展的相关基因较多,其中肿瘤抑制基因PTEN是1997年发现的具有双特异性磷酸酶活性的抑瘤基因[10],主要通过3,4,5-三磷酸磷脂酞肌醇去磷酸化拮抗PI3K-Akt信号系统参与细胞凋亡和抑制细胞增殖[11];其在上皮细胞中表达丰富,对肿瘤细胞迁移和侵袭等多种功能有抑制作用,但研究显示前列腺癌发生进展中有癌基因协同参与,最近有研究发现增高表达的Eg5可以增强肿瘤浸润和增加肿瘤血管形成[12],作用机制可能与Eg5可阻断CD4阳性T细胞影响肿瘤细胞的周期,影响肿瘤的发生、进展和血管形成;Eg5抑制后可以增强多西紫杉醇类药物的抗癌活性,减少耐药性;有研究显示在结肠肿瘤中PTEN可影响Eg5蛋白表达,使野生型p62蛋白稳定和积聚,从而抑制肿瘤的发生进展[13],在前列腺癌中是否有相同的作用方式,目前未见报道。
DNA甲基化是目前研究的比较深入的表观遗传修饰形式,是肿瘤中最常见的分子水平改变之一。PTEN异常表达包括DNA甲基化、组蛋白乙酰化、染色质重塑及非编码RNA的调控等几个方面,例如,在肝癌和子宫内膜癌中PTEN基因呈现杂合性缺失和甲基化改变[14-15],有研究显示,PTEN是P13K/AKT信号通路的重要调节因子,PTEN的缺失会导致其下游pAKT的聚集和分布的改变,从而影响细胞的增殖与分化;在前列腺癌中PTEN基因的表达状况国内也有部分研究,有采用Real-Time PCR对前列腺癌中PTEN与TGF-β(Transforming growth factor beta)mRNA定量表达与前列腺癌TNM分期和分化程度进行研究,结果发现PTEN表达与前列腺癌TNM分期和分化程度相关,PTEN和TGF-β呈负相关(P<0.05)[16];周留正等[17]采用蛋白质印迹法和免疫组化SP法对31例前列腺癌和18例前列腺增生进行凋亡抑制蛋白Livin与PTEN的表达状况和相关性进行研究,蛋白质印迹结果显示,前列腺癌组织Livin蛋白表达量高于前列腺增生;PTEN蛋白表达量低于前列腺增生;免疫组化显示两个基因的表达与前列腺癌的临床分期和淋巴结转移显著相关,但PTEN蛋白阳性表达与年龄、前列腺体积、病理分级和术前PSA无关;韩文华[18]对45例前列腺癌导管癌和40例高级别前列腺上皮内瘤(High grade prostatic intraepithelial neoplasia,HPIN)中的PTEN和ERG采用免疫标记的方法加以区别观察免疫标记对前列腺导管癌识别作用,结果显示,导管癌中84%PTEN表达缺失,而HPIN中无一例细胞质PTEN缺失(P<0.01),导管癌58%的ERG表达,PIN中15%的ERG表达,说明前列腺导管癌绝大多数存在细胞质PTEN缺失,PTEN缺失对前列腺导管癌是有用的免疫标记;本研究采用免疫组化SP法对PTEN 和Eg5蛋白在前列腺癌的表达与前列腺癌临床病理之间的关系进行研究,结果显示,前列腺癌PTEN蛋白表达阳性率为25.93%,而前列腺增生中表达阳性率为88.89%,二者差异有统计学意义(P<0.05),PTEN蛋白表达缺失与前列腺癌Gleason评分、临床分期、术前PSA水平、精囊浸润、盆腔淋巴结转移和5年生化复发有关,提示PTEN蛋白表达使前列腺癌侵袭能力下降,抑制前列腺癌恶性表型,与国内报道一致[19-20];Eg5蛋白在前列腺癌中表达明显高于前列腺增生,在前列腺癌中阳性表达率为70.37%,高于前列腺增生,且Eg5蛋白增高表达与前列腺癌Gleason评分、临床分期、术前PSA水平、精囊浸润、盆腔淋巴结转移和5年生化复发有关;此外,本研究对PTEN和Eg5蛋白与前列腺癌患者5年生化复发Kaplan-Meier分析显示,PTEN表达下降和Eg5表达增高与前列腺癌患者5年生化复发有关,同时本研究也对PTEN和Eg5蛋白Spearman相关性分析显示在前列腺癌中呈负相关(r=-0.763,P<0.05),提示在前列腺癌发生进展中二者有相互作用。
综上所述,在前列腺癌中PTEN蛋白表达下降和Eg5蛋白表达增高与前列腺的发生进展有关,但确切的作用机制尚未阐明,进一步需要在前列腺癌细胞学水平进行实验研究,探寻它们在前列腺癌发生进展中的作用机制。
[参考文献]
[1] Steck PA,Pershouse MA,Jasser SA,et al. Identification of a candidate tumour suppressor gene,MMAC1,at chromosome 10q23.3 that is mutated in multiple advanced cancers[J]. Nat Genet,1997,15(4):356-362.
[2] Gong J,Xu X,Zhang X,et al. Circular RNA-9119 suppresses in ovarian cancer cell viability via targeting the microRNA-21-5p-PTEN-Akt pathway[J]. Aging (Albany NY), 2020,12(14):14 314-14 328.
[3] Li J,Yen C,Liaw D,et al.PTEN,a putative protein tyrosine phosphatase gene mutated in human brain,breast,and prostate cancer[J]. Science,1997,275(5308):1943-1947.
[4] Gon?觭alves IL,Rockenbach L,G?觟ethel G,et al.New pharmacological findings linked to biphenyl DHPMs,kinesin Eg5 ligands:Anticancer and antioxidant effects[J].Future Med Chem,2020,12(12):1137-1154.
[5] Zeeshan M,Brady D,Stanway RR,et al. Plasmodium berghei Kinesin-5 associates with the spindle apparatus during cell division and is important for efficient production of infectious sporozoites[J].Front Cell Infect Microbiol,2020, 10:583 812.
[6] She ZY,Zhong N,Yu KW,et al. Kinesin-5 Eg5 is essential for spindle assembly and chromosome alignment of mouse spermatocytes[J]. Cell Div,2020,15:6.
[7] Mann BJ,Wadsworth P. Kinesin-5 regulation and function in mitosis[J]. Trends Cell Biol,2019,29(1):66-79.
[8] McNeal JE,Bostwick DG,Kindrachuk RA,et al. Patterns of progression in prostate cancer[J]. Lancet,1986(8472):60-63.
[9] Dash A,Sanda MG,Yu M,et al.Prostate cancer involving the bladder neck:Recurrence-free survival and implications for AJCC staging modification.American joint committee on cancer[J]. Urology,2002,60:276-280.
[10] Lv PY,Gao PF,Tian GJ,et al. Osteocyte-derived exosomes induced by mechanical strain promote human periodontal ligament stem cell proliferation and osteogenic differentiation via the miR-181b-5p/PTEN/AKT signaling pathway[J]. Stem Cell Res Ther,2020,11(1):295.
[11] Osei-Amponsa V,Buckwalter JM,Shuman L,et al. Hypermethylation of FOXA1 and allelic loss of PTEN drive squamous differentiation and promote heterogeneity in bladder cancer[J]. Oncogene,2020,39(6):1302-1317.
[12] Wang B,Hua P,Zhang L,et al. LncRNA-IUR up-regulates PTEN by sponging miR-21 to regulate cancer cell proliferation and apoptosis in esophageal squamous cell carcinoma[J].Esophagus,2020,17(3):298-304.
[13] Gon?觭alves IL,Rockenbach L,G?觟ethel G,et al. New pharmacological findings linked to biphenyl DHPMs, kinesin Eg5 ligands:Anticancer and antioxidant effects[J].Future Med Chem,2020,12(12):1137-1154.
[14] 張谢,谭麟,林剑,等.PTEN-Long对肝癌细胞的抑制作用研究[J].浙江医学,2019,41(15):1575-1578,1583.
[15] 赖世平,邓再兴,沈伟卫.子宫内膜癌中PTEN与NDRG1的表达和临床病理特征[J].浙江实用医学,2019,24(2):120-122.
[16] 王孝.PLCε通过PTEN/AKT信号通路对前列腺癌细胞增殖的影响[D].重庆:重庆医科大学,2018.
[17] 周留正,陈兵海,孙浩,等.前列腺癌组织Livin表达与PTEN相关性研究[J].中华肿瘤防治杂志,2017,24(23):1651-1655.
[18] 韩文华.细胞质基因PTEN蛋白缺失用于高级别前列腺上皮内瘤与前列腺导管癌的鉴别价值[J].中国老年学杂志,2016,36(9):2168-2171.
[19] 孙健玮,王剑松,刘子超,等.PTEN基因调控Raf-1磷酸化对前列腺癌PC3细胞凋亡的影响[J].昆明医科大学学报,2020,41(1):18-25.
[20] 洪艺华,刘曈彤,刘彦君,等.钒化合物通过活性氧水平的调节对PTEN表达缺失的前列腺癌细胞发挥更强的抑制作用[J].中国药学(英文版),2017,26(6):432-439.
(收稿日期:2020-10-02)
