纺织品中大肠杆菌O157:H7的检测方法
2021-11-03张子宏禹建鹰连素梅丁友超谢堂堂傅科杰郭会清
李 轲,张子宏,禹建鹰,连素梅,丁友超,谢堂堂,傅科杰,郭会清
(1.郑州海关,河南 郑州 450003;2.石家庄海关,河北 石家庄 050051;3.南京海关工业产品检测中心,江苏 南京 210001;4.深圳海关工业品检测技术中心,广东 深圳 518067;5.宁波检验检疫科学技术研究院,浙江 宁波 315000)
大肠杆菌O157:H7(EscherichiacoliO157:H7)是肠杆菌科埃希氏菌属的代表血清型,是一种人兽共患病原菌[1]。人畜感染剂量很低,危害严重,一般摄入10~100个活菌就能引起人的感染[2-3],尤其极易感染4岁以下儿童[4-5]。它具有强烈的致病性与致死性,能够引起出血性肠炎、溶血性尿毒综合症、血栓性血小板减少性紫癜[6],已被世界卫生组织确定为新发现的28种传染病病原体之一[7-8]。
大肠杆菌O157:H7在自然环境中分布广、数量多,因此,通常纺织品从生产到使用的任何环节都可能遭受该菌污染。该菌对环境抵抗力较强,耐酸耐低温,纺织材料遭受该菌污染后,为适应生存环境,菌体通过增殖分泌胞外基质,形成生物菌膜,成熟的菌膜可脱落释放出细菌,这些细菌又可以形成新的生物被膜,使病原菌一直处于可存活但不可培养的自我保护状态[9-10],处于这种状态的菌体仍然具有代谢活性和毒性表达[11-12]。细菌受菌膜保护,对外界环境的耐受性更强,工业清洗剂和消毒剂不易清除,成为潜在污染源,引发严重的生物安全问题[13-14]。
目前检测大肠杆菌O157:H7的快速方法主要包括荧光定量聚合酶链式反应(PCR)方法、适配体技术和免疫学方法[15-17]等,现有的检测方法已在食品领域成熟应用。而大肠杆菌O157:H7在食品和纺织品中生存环境不同,其基因全序列存在很大差异,纺织品和食品分属独立领域,2个领域的检测方法无法通用。因此,迫切需要探索针对纺织品基质检测大肠杆菌O157:H7的技术,不用培养,灵敏、特异、快速、高效的检测方法,以便于日常监测中发现可疑污染源,以及在发生公共卫生事件时做出快速反应。
本研究选取大肠杆菌O157:H7特有的rfbE基因保守序列,设计PCR特异性引物和荧光双标记探针,结合免疫磁珠技术,集成创新开发一种目标菌低浓度、不可培养情况下的样品中高效、快速富集分离大肠杆菌O157:H7的技术,建立了一种针对纺织品基质的免疫磁珠(immunomagnetic bead,IMB)富集-实时荧光PCR(real-time PCR)方法,其检测下限可达8 CFU/mL,实现了纺织品中大肠杆菌O157:H7的快速灵敏鉴定,为纺织品污染该菌的检测提供新的思路。
1 实验部分
1.1 实验材料
实验菌株:大肠杆菌O157:H7(ATCC 700728)、大肠杆菌O157:H7(ATCC 43888)、大肠杆菌O157:H7(CICC 21530)、大肠杆菌O157:H7(DC01-10纺织品中分离)、福氏志贺氏菌(CGMCC 1.186 8)、猪霍乱沙门氏菌(CICC 21493)、伦敦沙门氏菌(CMCC 50106)、单核细胞增生李斯特菌(CMCC 54002)、金黄色葡萄球菌(ATCC 29213)、铜绿假单胞菌(ATCC 15442)、空肠弯曲杆菌(CICC 22936)、副溶血性弧菌(ATCC 10782)、阪崎肠杆菌(IQCC10403)。
主要仪器:岛津BioSpec-nano超微量分光光度计,美国赛默飞公司;CFX96荧光PCR仪,美国伯乐公司。
试剂:大肠杆菌O157:H7免疫磁珠分离检测试剂,天津生物芯片技术有限责任公司;改良胰蛋白胨大豆肉汤(mTSB)、PCR缓冲溶液(10倍浓缩)、脱氧核糖核苷三磷酸(dNTP,10 mmol/L)、水生栖热菌(Taq)DNA聚合酶(5U/μL),北京陆桥公司;细菌基因组DNA提取试剂盒,天根生化公司。
1.2 实验方法
1.2.1 引物与探针设计
在GenBank中选取大肠杆菌O157:H7的rfbE(CP035 366.1)基因序列,利用Oligo7.0软件,在没有碱基变异的基因保守区段,设计PCR特异性引物和荧光双标记探针,用分析软件分析设计好的引物和探针序列的二级结构,并利用生物序列的相似性搜索工具BLAST分析其特异性,显示引物和探针比较理想,特异性较好。设计好的序列交由南京金斯瑞生物科技有限公司合成,按说明用双蒸水(ddH2O)稀释成0.4 μmol/L,置于-20 ℃保存。
1.2.2 免疫磁珠富集
称取25 g待检样品,剪碎,放入装有225 mL mTSB肉汤培养基的均质袋中均质,41.5 ℃条件下放置5 h复壮样品中的目标微生物。取出大肠杆菌O157:H7免疫磁珠,在漩涡振荡器上振荡10 s至磁珠全部重悬。取1支1.5 mL无菌离心管,分别吸取1 mL上述复壮后的mTSB培养基和20 μL大肠杆菌O157:H7免疫磁珠加入到离心管中,颠倒混合后将离心管放在摇床中,振荡混合20 min。取下离心管,放入磁力架孔中,静置3 min,吸弃管中液体。取1 mL洗脱缓冲溶液重悬磁珠,将离心管颠倒混匀5~8次,再置于磁力架孔中,静置3 min,小心吸走多余液体。重复洗涤2次,最后加入50 μL洗脱缓冲溶液重悬磁珠。
上述实验可根据需求做多个平行,多个平行得到的磁珠重悬液可混合到一起作为一个样品进行下列实验。
1.2.3 DNA模板制备
取富集好的重悬磁珠接种到10 mL已灭菌的mTSB培养基中,于37 ℃培养20 h,取增菌液用细菌基因组DNA提取试剂盒提取DNA;也可不用培养,取重悬磁珠液直接按照试剂盒说明书进行模板制备,用岛津BioSpec-nano超微量分光光度计测定其浓度和纯度。
1.2.4 PCR反应体系和参数
PCR反应总体系体积为25 μL:PCR缓冲溶液2.5 μL,dNTP混合溶液1.0 μL,Taq DNA聚合酶0.5 μL,上、下游引物和探针各1 μL,DNA模板2 μL,其余用ddH2O补足。反应参数:37 ℃ 5 min,95 ℃ 预变性3 min;94 ℃变性5 s,60 ℃退火延伸40 s,同时收集荧光,40个循环。
1.3 检测体系优化
1.3.1 引物优化
引物和探针设计的目的是在扩增特异性和扩增效率之间取得平衡。根据大肠杆菌O157:H7 rfbE基因,设计2组引物及探针,探针5’端为FAM标记,3’端为TAMRA标记,如表1所示。

表1 2组引物参数Tab.1 Parameter of two sets of primers
取大肠杆菌O157:H7(ATCC 700728)、大肠杆菌O157:H7(ATCC 43888)、大肠杆菌O157:H7(CICC 21530)、大肠杆菌O157:H7(DC01-10纺织品中分离)菌液,稀释至104倍,提取DNA模板,反应体系中分别加入2组引物,按1.2.4节反应参数扩增验证2组引物、探针的扩增效率。
1.3.2 引物浓度优化
利用1.3.1节中提取的菌液DNA,按照反应体系调整引物和探针量,如表2所示,总体系体积为25 μL,用灭菌ddH2O补足总体积,按照1.2.4节反应参数进行PCR扩增。

表2 体系中引物和探针各终浓度下对应的量Tab.2 Corresponding amount of primers and probes at each final concentration in system
1.3.3 模板量优化
利用提取的菌液DNA,在扩增体系中分别设定模板量为1、2、3、4、5 μL,总反应体系体积为25 μL,不足量用灭菌ddH2O补足,进行PCR扩增反应。
1.3.4 退火延伸温度优化
利用提取的菌液DNA,分别设定扩增退火延伸温度为56、58、60、62 ℃,其他反应参数不变,分别进行PCR反应扩增。
1.4 特异性实验
取所有实验菌株菌液提取DNA,进行PCR扩增。
1.5 灵敏性实验
1.5.1 纯培养物的灵敏度测试
取所有菌液各10 mL制成混合菌液,接种平板,培养后计数,原始菌液计数结果为8×109CFU/mL。将原始菌液进行倍比稀释,选取浓度为8×105、8×104、8×103、8×102、80、8及0.8 CFU/mL 7个稀释度提取DNA,进行PCR扩增,每个稀释度进行4次平行测试。
1.5.2 添加目标菌的阳性样品的灵敏度测试
选取上述浓度为80 CFU/mL的菌液,添加5份不同材质的纺织品样品(收集的已知大肠杆菌O157:H7阴性样品,包括棉麻布1份、羊毛浆制品1份、丝制品1份、腈纶布1份、竹浆纤维制品1份)中,每个样品添加1 mL,隔夜放置。提取DNA,进行PCR扩增,每个样品做2个平行,重复3次测试。
1.6 检出限验证
市场采集7份纺织品样品(包括涤/棉布1份、涤纶布1份、兔毛绒线1份、宝宝绒线1份、混纺平布1份、油布1份、帆布1份,经过统一漂洗、晾晒、高压灭菌处理后备用),取中低浓度水平菌液(浓度为8 CFU/mL)1 mL人工添加上述5份样品,选取高浓度水平菌液(菌液浓度为8×105CFU/mL)1 mL人工添加1份样品,1份未添加做对照,所有样品隔夜放置。取所有隔夜放置样品分别提取DNA,连同1.5.2节中5份样品共12个样品DNA,一起进行PCR扩增测试,每个样品做10个平行,同时用传统方法进行验证。
1.7 重复性实验
取隔夜放置人工污染样品培养液,提取DNA,进行PCR扩增测试,每个样品做20个平行实验,同时用传统方法进行测试。
1.8 已知自然污染样品检测
取已知结果为阳性的自然污染样品30份(6份来自某宾馆的公用浴巾,10份来自某医院的护士服、病号服,10份来自火车卧铺的床单、被罩,4份来自某小区“依依不舍”捐赠衣服),所有样品先进行免疫磁珠富集,20份样品培养后提取DNA、10份样品直接用重悬磁珠提取DNA,每个样品做2个平行,一并进行PCR扩增。
2 结果与讨论
2.1 检测体系优化
2.1.1 引物优化分析
2组引物的扩增结果见图1。第1组引物扩增结果和预期结果100%相符,并且扩增开始时间(都在20 min内)早,扩增效率较高;第2组引物的扩增结果出现了假阴性和假阳性,开始扩增(30 min后)较晚,结果符合率较低,可能是因为引物中嘌呤和嘧啶含量相对较高的缘故。因此新建方法确定选择第1组引物。

1—第1组引物;2—第2组引物。图1 2组引物扩增曲线Fig.1 Amplification curve of two sets of primers
2.1.2 引物浓度优化分析
引物浓度优化结果如图2所示。引物、探针浓度为0.2 μmol/L时,扩增曲线不明显;引物、探针浓度为1.0 μmol/L时,由于引物浓度大,抑制扩增,扩增开始较晚,达到平台期也较晚;引物、探针浓度为0.4、0.6、0.8 μmol/L时,扩增开始较早,扩增结束时都达到了平台期,扩增曲线呈现明显的S型,扩增效率都符合要求,0.8 μmol/L浓度时达到平台期稍晚,扩增效率不如0.4、0.6 μmol/L浓度。综合考虑试剂节约和扩增效率,PCR反应体系中引物和探针浓度选择0.4 μmol/L。

1—0.2 μmol/L;2—0.4 μmol/L;3—0.6 μmol/L;4—0.8 μmol/L;5—1.0 μmol/L。图2 引物与探针各终浓度时扩增曲线Fig.2 Amplification curve of primers and probes at different final concentrations
2.1.3 模板量优化分析
扩增体系中模板量不同,结果差异很大,如图3所示。当模板量为1 μL时,扩增效果最差,最先扩增出峰的模板上样量为2 μL,其次是3、4、5 μL,在该 4个模板量条件下扩增效果都符合要求,而模板量为2 μL的扩增效率明显更高,因此本方法扩增体系设定模板上样量为2 μL。

1—1 μL;2—2 μL;3—3 μL;4—4 μL;5—5 μL。图3 不同模板量扩增结果Fig.3 Amplification results of different templates
2.1.4 退火延伸温度优化
不同退火延伸温度扩增效率差异很大,退火延伸温度太低、太高肯定会影响引物的结合效率,在本实验其他条件固定不变的情况下,60 ℃退火延伸温度扩增效率最高。图4示出退火延伸温度为60 ℃时的扩增结果。本文选择60 ℃为退火延伸温度。
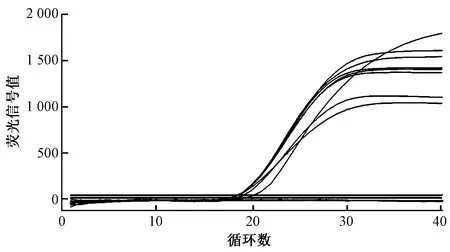
图4 退火延伸温度为60 ℃时的扩增结果Fig.4 Amplification results at 60 ℃
2.2 特异性分析
选择标准菌株、纺织品分离株提取DNA,进行PCR扩增,结果见图5。对13株不同来源的大肠杆菌O157:H7及分离株都能有效扩增,而非大肠杆菌O157:H7不能扩增,所建方法特异性符合要求。
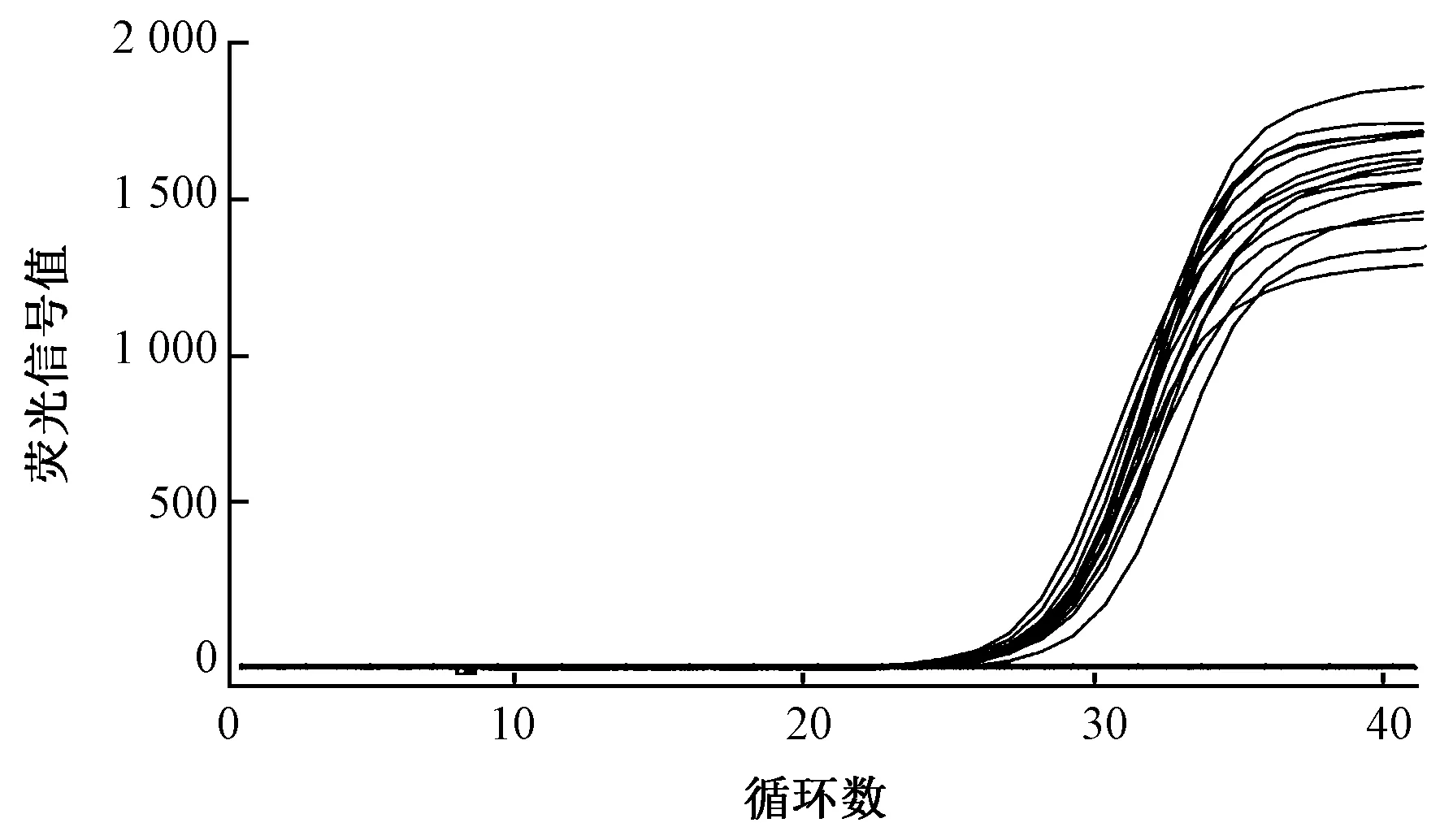
图5 特异性扩增曲线图Fig.5 Specific amplification curve
2.3 灵敏性分析
2.3.1 纯培养物的灵敏度分析
纯培养物的灵敏性测试结果见图6。样液稀释到大于80 CFU/mL时扩增明显,稀释到8 CFU/mL时,Ct值在30~35之间,结果为可疑;0.8 CFU/mL时扩增不明显,判定阴性。取稀释到8 CFU/mL的纯培养物重复实验,Ct值均在30~35之间,可判定阳性。

1—8×105 CFU/mL ;2—8×104 CFU/mL;3—8×103 CFU/mL;4—8×102 CFU/mL;5—80 CFU/mL;6—8 CFU/mL;7—0.8 CFU/mL图6 7个稀释度的扩增曲线图Fig.6 Amplification curves of 7 dilutions
2.3.2 添加目标菌的阳性样品的灵敏度测试
添加目标菌的阳性样品的灵敏度测试结果如图7 所示。选取不同材质的纺织品做基质样品,当添加水平在80 CFU/mL样品时,添加的目标菌测试结果和预期结果一样。

图7 添加目标菌的部分阳性样品扩增曲线Fig.7 Amplification curve of some positive samples added with target bacteria
2.4 检出限验证
当添加水平在80 CFU/mL时,用传统方法测试,检出阳性概率为96%,用PCR方法测试时检出阳性概率为100%。当添加水平在8 CFU/mL时,传统方法测试检出阳性概率为76%,用PCR方法测试时检出阳性概率为90%,结果如表3所示。

表3 2种方法测试情况Tab.3 Test results of two methods
2.5 重复性试验
采用中水平添加5种不同材质纺织品,由测试结果可知采用传统方法检出概率为100%,PCR方法检出概率为100%,2种方法结果无差异。结果见表4。
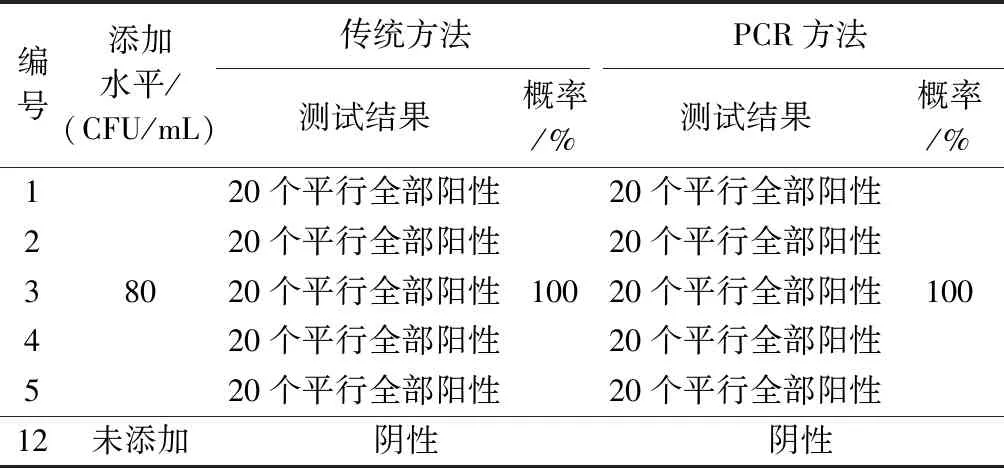
表4 5个样品20个平行测试情况Tab.4 Parallel test of 20 samples of 5 samples
2.6 已知自然污染样品检测
所收集的30份阳性样品分别来自部分公共场所,用传统方法分离结果均为阳性;20份进行增菌培养后取增菌液提取DNA,10份直接用磁珠重悬液提取DNA,30份样品全部进行PCR扩增,结果和预期结果符合,且每个反应管内的荧光信号到达设定的域值时所经历的循环数(Ct值)差异不明显,结果见图8。

图8 自然污染样品扩增结果Fig.8 Amplification results of natural pollution sample
3 结果与讨论
目前国内外对纺织品中大肠杆菌O157:H7没有统一检测的标准[18],由于纺织品中的大肠杆菌O157:H7接近环境菌菌落特性,传统的培养分离鉴定有一定困难。且传统方法操作繁琐,检测周期长,对于在环境中由于自我保护变异产生菌膜的细菌,特异性和灵敏性都有欠缺,易漏检。免疫磁珠富集技术是一种具有高效、特异的样品预处理方法,本研究应用的免疫磁珠表面偶联有大肠杆菌O157:H7特异抗体,可与样本中的大肠杆菌O157:H7的表面抗原进行特异性结合,磁珠在磁场作用下与样本中的其他物质快速分离,分离纯度高,并保留目标病原菌生物活性,利于下游的检测鉴别,是理想的样品预处理方法[19]。实时荧光PCR技术是在PCR体系中引入荧光信号,利用荧光信号的变化实时监测PCR扩增反应每个循环产物量的变化[20],该技术操作简便,耗时短,特异性强。灵敏性、检出限、重复性等技术参数验证时均用了不同材质的样品,结果发现天然纤维与合成纤维相比,PCR扩增时循环数略低,这可能是由于天然纤维营养丰富,菌体复壮迅速,由于PCR方法灵敏性和检出限高于传统方法,因此样品材质对实验结果影响不大。
4 结 论
本文根据纺织品微生物污染的特殊性,利用免疫磁珠特异性富集技术结合荧光定量PCR特异性引物,建立了针对纺织品的实时荧光PCR体系,该方法具有双重特异性,降低了结果误判概率,其检测下限可达8 CFU/mL。通过对自然污染样品进行检测发现,无论培养与否,富集重悬液提取DNA后扩增都能收集到目标荧光信号,且循环数(Ct值)无显著性差异,与传统方法相比,检测效率提高60%。本研究所建立的技术方法能够比较快速、准确、高效地鉴定纺织品中的大肠杆菌O157:H7,实用性较强,可应用于生物安全、公共卫生安全等领域,为大肠杆菌O157:H7大规模流行病学调查提供技术支撑。
