肿瘤相关巨噬细胞在胃癌中的研究进展
2021-11-03李泽锋赵东兵
李泽锋,赵东兵
国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院胰胃外科,北京 100021
胃癌是全球第六高发的恶性肿瘤。中国是胃癌高发区,胃癌的发病率和病死率在恶性肿瘤中均高居第三位。近年来,手术、化疗、放疗、分子靶向治疗、免疫治疗等多学科综合治疗使胃癌的5年生存率有了一定提高,但结果仍不令人满意。在胃癌的发生发展过程中,肿瘤免疫微环境起了关键作用。其中,起源于外周血单核细胞的肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)是肿瘤免疫微环境的重要组成部分,通常分为M1和M2两种类型。M1促进炎症反应,促进辅助T细胞1(T help cell 1,Th1)免疫反应,具有抗癌作用;M2是TAM的主要分型,可引起机体免疫耐受,加速肿瘤进展。TAM在多种实体肿瘤中被证实具有抑制免疫监管、促进肿瘤转移等作用,然而TAM在胃癌中的作用尚存争议,其具体机制还没有被完全阐明。本文将就TAM在胃癌中的分布、作用机制及其与胃癌预后的相关性进行综述,以期明确现阶段TAM在胃癌中的争议焦点以及其在未来可能的研究方向。
1 TAM在胃癌中的分布
在不同分型的胃癌中,TAM的浸润程度不同。根据Lauren分型,肠型和弥漫型胃癌中总的TAM浸润无差异,但M2在弥漫型胃癌中较肠型多。根据2014年癌症基因组图谱(The Cancer Genome Atlas,TCGA)胃癌分子分型,EB病毒阳性胃癌中M2浸润最少,这可能是肠型、EB病毒阳性胃癌患者预后较好的原因之一。同时说明,在不同亚型胃癌的致病过程中,TAM扮演了不同角色,需要通过后续研究明确哪类胃癌患者能够从靶向TAM的治疗中获益。除了分型上的差异外,发生转移患者的胃癌组织中的TAM高于非转移胃癌患者;发生腹膜转移的胃癌患者腹膜中的M2数量较没有腹膜转移的胃癌患者多;胃癌浸润边缘的TAM比胃癌中心多。这些TAM分布上的差异提示了TAM可能在胃癌的浸润和转移中扮演了重要角色。
2 TAM在胃癌中的作用
2.1 胃癌细胞可以通过多种途径招募巨噬细胞
胃癌细胞可以通过分泌C-C趋化因子配体2(C-C chemokine ligand 2,CCL2)、骨桥蛋白(osteopontin,OPN)直接招募TAM;也可以分泌白细胞介素(interleukin,IL)-33作用于肥大细胞,使肥大细胞分泌IL-6、IL-13、CCL2、巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)、巨噬细胞炎症蛋白-1α(macrophage inflammatory protein-1 alpha,MIP-1α)、MIP1等间接招募TAM。
2.2 TAM的极化是影响胃癌进展的关键步骤
巨噬细胞可通过经典途径信号通路干扰素调节因子(interferon regulatory factor,IRF)/干扰素(interferon,IFN)/信号转导及转录激活因子1(signal transduction and activator of transcription 1,STAT1)极化为 M1型;或通过 IL-10/STAT3、IL-4/STAT6信号通路极化为M2型。胃癌细胞能促进巨噬细胞极化为M2型,还能使已经极化为M1的巨噬细胞转化为M2型。胃癌细胞促进巨噬细胞极化为M2的能力可能与其微环境中神经-肿瘤腹侧抗原 1(neuro-oncological ventral antigen 1,NOVA1)基因表达下降有关。NOVA1能与mRNA 3'端非翻译区结合,增加mRNA稳定性,在结肠癌中被证实与STAT3信号通路相关。除了胃癌细胞外,腹膜下成纤维细胞、胃癌源性的间充质干细胞也会诱导巨噬细胞极化为M2型。
越来越多的研究发现,胃癌细胞与TAM的相互作用不仅局限于直接接触、旁分泌,还能通过体循环在全身范围发生,这提示胃癌在发生远处转移前可能已使某些部位的巨噬细胞提前极化,建立供肿瘤细胞转移的免疫耐受微环境(图1)。Liu等给小鼠皮下注射胃癌细胞4周后发现,胃癌小鼠腹膜巨噬细胞比正常小鼠更多地表现为M2型巨噬细胞。
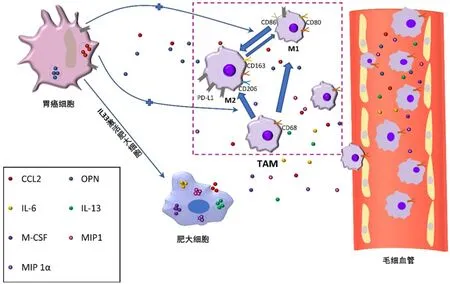
图1 胃癌细胞招募、极化TAM示意图
2.3 TAM促进胃癌新生血管和淋巴管
凝血因子(Ⅲ、Ⅶa、Ⅻa)可以刺激M2分泌IL-4、IL-10、转化生长因子-β(transforming growth factor-β,TGF-β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎症因子。同时,经凝血因子激活的M2还可分泌血管内皮生长因子(vascular endothelial growth factor,VEGF)和基质金属蛋白酶 9(matrix metalloproteinase,MMP9)正反馈刺激血管内皮细胞继续分泌凝血因子。M2和血管内皮细胞相互作用促使胃癌血管新生。TAM还能提高轴突导向因子4D(semaphorin 4D,SEMA4D)表达、磷酸化激活表皮生长因子受体(epidermal growth factor receptor,EGFR)/蛋白激酶B(protein kinase B,PKB,又称AKT)/细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)/STAT3信号通路促进血管再生。除了促进血管新生外,通过诱导淋巴上皮细胞发生表型和功能改变,TAM可刺激淋巴上皮细胞增殖,促进淋巴管新生,使胃癌易于发生淋巴结转移。
2.4 TAM促进胃癌侵袭和迁移
TAM通过分泌含有miRNA-21、miRNA-223的外泌体至胃癌细胞,能够下调胃癌细胞磷酸酶张力蛋白同源物(phosphatase and tensin homolog,PTEN)表达,激活磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)/AKT信号通路。胃癌细胞产生丝状伪足,发生扭曲、增长等形态变化,胃癌细胞边缘的肌动蛋白带消失,细胞骨架重塑,易于运动和迁移。
TAM可以通过诱导胃癌细胞发生上皮-间充质转化(epithelial-mesenchymal transition,EMT)促进胃癌转移。TAM还可以通过分泌MMP9作用于PI3K/AKT/Snail通路促进胃癌细胞EMT,从而促进胃癌转移。幽门螺杆菌(helicobacter pylori,HP)是胃癌的主要诱因之一,而HP的促癌作用也与TAM相关。HP感染的胃癌细胞可分泌含间充质-上皮转化因子的外泌体转入TAM,通过AKT、促分裂原活化的蛋白激酶(mitogen-activated protein kinase,MAPK)通路的联合作用,促进TAM分泌IL-1β,使胃癌细胞发生EMT,成为转移的前提和基础。
MMP家族可以破坏细胞外基质,促进肿瘤转移,得到了越来越多的关注。TAM不仅可以直接分泌MMP2、MMP9促进胃癌侵袭和转移,还可以诱导胃癌细胞增加MMP表达。其主要机制是M2分泌壳多糖酶3样蛋白1(chitinase 3-like protein 1,CHI3L1)激活胃癌细胞MAPK,上调了胃癌细胞中MMP的表达。Zhu等构建胃癌细胞微型胶囊模型发现,胃癌细胞在与TAM共培养后,细胞内的VEGF和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)表达增加,并且在培养基上清液中也检测到了MMP2和MMP9的表达。VEGF除了可以促进新生血管,低氧条件下的TAM还可以通过分泌VEGF激活胃癌细胞PI3K/AKT和p38通路,增强胃癌细胞的增殖和迁徙能力。值得一提的是,MMP7在HP感染的胃黏膜上皮细胞中起保护作用,MMP7表达下降会诱导TAM向M1极化,增强炎症反应,促使胃黏膜上皮细胞不典型增生。这提示MMP家族中不同分子在胃癌中发挥了不同的作用,TAM在不同分期的肿瘤中也会扮演不同角色,M1可能阻止了后期胃癌的进展,但在前期则促进了胃癌癌前病变。
2.5 免疫检查点及表观遗传
TAM源性C-X-C趋化因子配体8(C-X-C chemokine ligand 8,CXCL8)可以诱导TAM表达PD-L1,从而抑制CD8T细胞功能。M1、M2均表达PD-L1,M2表达量较M1更高。Zhao等指出,M1可以通过释放CXCL9、CXCL10、CXCL11招募CD8T细胞,但由于M1表达的PD-L1可与CD8T细胞表面PD-1结合,抑制CD8T细胞功能,招募来的CD8T细胞并不能有效杀伤肿瘤细胞。因此,M1高浸润的胃癌患者或许是PD-1单抗免疫治疗的潜在获益人群。M2不仅能直接表达PD-L1,还能促进胃癌细胞表达PD-L1从而促进肿瘤进展。TAM还可以通过影响表观遗传的方式促进胃癌进展。TAM通过分泌CCL5作用于胃癌细胞CCR5受体,激活JAK2/STAT3信号通路,上调DNA甲基转移酶1(DNA methyltransferase 1,DNMT1),使凝溶胶蛋白(gelsolin,GSN)基因启动子甲基化,GSN表达下降。GSN可影响肌动蛋白的聚合和解聚,能抑制肿瘤细胞生长和转移。当GSN表达下降时,胃癌进展。
3 TAM与胃癌预后
TAM对胃癌预后的影响尚未有定论,多数研究者认为M1浸润提示预后好,M2浸润提示预后差;由于M2在TAM中占比更高,因此TAM与生存时间通常呈负相关。M-CSF可招募外周血单核细胞,因此其在肿瘤组织中高表达通常预示预后不良。Taniyama等研究发现,TAM还是胃腺瘤进展成胃癌的关键因子,在恶变组中的表达高于非恶变组。此外,有研究报道TAM浸润少的胃癌患者对化疗的反应更加良好。这些发现意味着TAM在胃癌发生、发展及拮抗化疗等多个阶段发挥作用,可能成为判断患者预后的标志甚至潜在的治疗靶点。
然而M2并不能简单认为是胃癌预后不良的标志。有研究指出在印戒细胞癌和黏液腺癌中,M2高浸润提示预后良好。在分子分型为高度微卫星不稳定(microsatellite instability-high,MSI-H)的晚期胃癌中,CD163M2是患者预后良好的独立预测因子。CD163CD68CD206TAM(M2的一种亚型)大量存在于胃癌细胞附近时,患者预后较好。这些研究提示当具体到某一种亚型的胃癌或将M2分型细化时,M2反而成为患者预后良好的标志。因此,进一步明确TAM在各种亚型胃癌患者中的作用是今后研究的方向。
4 TAM作为治疗胃癌的潜在靶点
抑制TAM浸润可以有效减缓肿瘤进展,集落刺激因子1受体(macrophage colony stimulating factor 1 receptor,CSF1R)抑制剂培西达替尼(pexidartinib)在小鼠实验中可以减少招募来的TAM,从而减少血管新生,减小肿瘤负荷。通过干扰TAM细胞代谢重塑也能减缓肿瘤进展。二酰甘油酰基转移酶(diacylglycerol acyltransferase 2,DGAT)抑制剂可减少TAM,阻止肿瘤进展;雷帕霉素靶蛋白(mechanistic target of rapamycin kinase,MTOR)抑制剂可抑制线粒体有氧氧化,削弱TAM带来的免疫耐受。抑制脂肪酸β氧化可以减弱TAM引起的化疗抵抗。
此外,还有很多研究试图通过定向诱导TAM极化阻止胃癌进展。Zhuang等的研究发现,槐定碱通过 Toll样受体 4(Toll-like receptors 4,TLR4)/IRF3轴促使TAM向M1极化,并可通过下调肿瘤免疫微环境中的CCR2表达抑制TAM浸润。经槐定碱处理过的TAM还可以促进CD8T细胞增殖、增强其细胞毒功能进而抗肿瘤。低剂量紫杉醇、甲硫氨酸脑啡肽(methionine enkephalin,MENK)也被证明可以增加M1极化,减少M2极化。
通过作用于TAM分泌的促癌分子,MMP9抑制剂JNJ0966可以增强化疗药物奥沙利铂、多柔比星的作用。萘酚吡喃(naphthopyranones)除了直接抑制胃癌细胞生长以外,还可以通过抑制TAM表达诱导一氧化氮合酶,进而预防和治疗HP感染,阻止胃癌进展。在小鼠实验中,抑制TAM表达天冬酰胺内肽酶(legumain,LGMN)可抑制胃癌进展。
5 小结与展望
作为肿瘤免疫微环境的重要组成部分,TAM对于胃癌的调节作用已被广泛认可,但其具体作用机制尚未完全阐明。虽然多数研究指出TAM可能与胃癌预后不佳相关,但也有研究得到相反的结论。目前对于TAM在胃癌中作用机制的研究主要还是集中在TAM促进胃癌进展这一单向上。造成这一现象可能是由于:①在不同分型、分期的胃癌中,TAM扮演了不同的角色;②不同实验使用的TAM标志不同,例如CD163和CD206同是M2标志物,但可能代表了具有不同功能的TAM亚型;③M1和M2可以动态变化;④体外实验大多通过定向诱导THP-1细胞系模拟体内TAM,其作用和功能与体内TAM可能存在差异。因此,需要通过后续研究获得更精细的TAM分型,进一步揭示TAM在不同亚型、不同分期胃癌中对预后的预测作用及作用机制,明确靶向TAM治疗的适应证和潜在获益人群,以期其早日成为临床治疗靶点,改善胃癌患者的预后。
