脂肪间充质干细胞分泌蛋白对小型猪腹腔镜肝IRI合并肝部分切除肝细胞自噬损伤的影响
2021-11-02马亚军刘笑凝焦智慧朴晨曦徐嘉元张千振王洪斌东北农业大学动物医学学院黑龙江省普通高等学校动物普通疾病防治重点实验室黑龙江哈尔滨150030
马亚军,刘笑凝,焦智慧,朴晨曦,徐嘉元,张千振,王洪斌 (东北农业大学 动物医学学院 黑龙江省普通高等学校动物普通疾病防治重点实验室,黑龙江 哈尔滨 150030)
肝缺血再灌注损伤(ischemia reperfusion injury,IRI)是一种病理生理应激状态,指肝脏的血液供应被中断,一定时间后重新恢复血供所引起的损伤。肝IRI对肝脏和全身性的影响在肝移植临床应用中具有重要意义[1]。肝IRI发生后,肝脏细胞内多种细胞因子分泌发生紊乱,活性氧(reactive oxygen species,ROS)、活性氮(reactive nitrogen species,RNS)大量产生,从而加重肝脏损伤。自噬是一种高度保守的生物过程,其通过清除降解受损细胞器和蛋白质并进一步转化为能量来维持细胞稳态和活力[2]。肝脏在病理和生理学方面很大程度上依赖于自噬。自噬通常被认为是一种细胞内的自我保护机制,然而过度自噬却会导致细胞死亡[3-4]。在极端情况下,过度的自噬会导致自噬空泡的积累,从而使细胞死亡。肝脏缺血后,细胞内ATP过度消耗、生成不足,AMPK活化,mTOR被抑制,自噬发生。此时自噬能够帮助机体迅速适应乏氧及营养不足的环境。再灌注时,氧化应激增强,ROS介导自噬过程中的多种信号传导导致自噬进一步增强,进而诱导自噬性细胞死亡。PI3K/AKT通路在控制细胞生长、增殖、存活和代谢中起着重要作用,mTOR是细胞内自噬的主要抑制因子,其哺乳动物靶点受PI3K/AKT通路的正调控[5]。
随着干细胞治疗技术的深入研究,再生医学治疗寻求将非愈合性损伤引导至组织结构和功能的完全恢复。干细胞再生疗法最初的假设是基于干细胞分化功能,但有研究发现,干细胞的治疗潜力可能不只是单独来自于细胞分化和替代功能,还可能取决干细胞的旁分泌作用[6-7]。干细胞受其局部微环境、周围细胞和干细胞的分泌物共同作用影响[8-9],通过分泌一系列营养因子,如细胞因子、生长因子和趋化因子进入微环境中,进而控制细胞增殖、迁移和分化,并提供细胞保护[10-11]。本研究通过观察肝IRI合并肝部分切除术术后3,7 d肝细胞自噬水平变化,探究脂肪间充质干细胞分泌蛋白(adipose-derived mesenchymal stem cells-secretome,ADSCs-secretome)对于肝IRI合并肝部分切除肝细胞过度自噬损伤的修复作用,为进一步无细胞产品代替细胞疗法应用到临床提供了理论依据。
1 材料与方法
1.1 实验动物4~6月龄广西巴马小型猪24头,体质量20~30 kg,在同等条件下进行饲养,且临床及试验检查健康。随机分为4组:IRI组+saline对照组(IRI组)、IRI+DMEM对照组(DMEM组)、IRI+ADSCs-secretome干预组(ADSCs-sec组)、IRI+ADSCs干预组(ADSCs组),每组6头,雌雄各半。
1.2 主要试剂与仪器腹腔镜、气腹机(日本Olympus公司),冷光源、高清内窥镜摄像系统(深圳市神州医疗设备有限公司),腹腔镜手术器械(日本Olympus公司)实时荧光定量 PCR 仪(上海罗氏制药有限公司),电泳转印系统(美国 Bio-Rad 公司),二氧化碳培养箱(德国 Eppendorf 公司)。
注射用丙泊酚(西安力邦制药有限公司),小型猪复合麻醉剂(东北农业大学兽医外科教研室研制),异氟烷(河北一品制药有限公司),多聚甲醛试剂(武汉博士得生物有限公司),胎牛血清(美国 CLARK 公司),DMEM 低糖培养基(美国 Invitrogen 生命技术有限公司),Beclin1、LC3Ⅱ、P62 抗体(沈阳万类生物科技有限公司),p-Akt、Akt、p-mTOR、mTOR 抗体(武汉爱博泰克生物科技有限公司)。
1.3 小型猪ADSCs的体外分离培养在无菌条件下取猪脂肪组织,PBS洗涤、去筋膜、剪碎,与等体积的0.1% Ⅰ型胶原酶混合,37℃摇床中进行酶消化45 min,终止消化,过滤,1 500 r/min离心10 min。弃上清,向沉淀中加入红细胞裂解液,充分裂解5 min 除去红细胞,1 500 r/min离心5 min得到最终的细胞沉淀,培养液(DMEM,10% FBS,1%青链霉素和1%谷氨酰胺)重悬,吹匀,接种到培养瓶中,于37℃、5% CO2中进行培养。细胞约2 d完成贴壁。本试验使用P4代细胞。
1.4 ADSCs-secretome的制备ADSCs培养至P4代,待细胞全部铺满,弃去瓶中培养液,PBS清洗,换成无血清培养液进行饥饿培养。48 h后提取瓶中培养上清液。将提取的上清液1 500 r/min离心10 min,去除上清液中残留的死细胞和细胞碎片。然后使用无菌过滤器进行过滤,最后在无菌条件下放入3 KD超滤浓缩管中,5 000 r/min离心1 h进行浓缩,浓缩比例约为24∶1,浓缩后的上清液-80℃ 保存备用。
1.5 建立手术模型进行动物保定,肌肉注射阿托品(0.05 mg/kg),耳缘静脉注射丙泊酚、小型猪复合麻醉剂(0.02 mg/kg)。确认麻醉后,进行气管插管并连接呼吸麻醉机,进一步维持麻醉。调适手术台温度在37℃左右。麻醉过程中,异氟烷浓度为2.5%~4%,氧流量0.8~1 L/min,呼吸频率15~20次/min,潮气量10~15 mL/kg,呼吸比1∶2,术中通过静脉通路注射生理盐水。
消毒手术部位,在小型猪腹部相应位置插入套管(10 mm内径套管、5 mm内径套管各2个)(图1)。使用腹腔镜器械,首先游离肝脏右叶根部胆囊管,使用止血带穿过胆囊游离处,再从肝脏右叶基部两侧肝实质处穿过,环住整个肝脏右叶。收紧止血带,进行肝脏右叶缺血处理,60 min后,松开止血带,恢复右肝血供。采用三排缝合法对肝脏左叶进行结扎。结扎完成后,切除肝脏左叶,检查肝脏断面出血情况,进行止血处理。术后即刻,采用分点注射法向肝实质注射相同剂量的相应干预物。IRI组注射生理盐水,DMEM组注射DMEM浓缩液,ADSCs组注射ADSCs重悬液,ADSCs-sec组注射ADSCs-secretome浓缩液。最后取出离断肝脏组织,关闭气腹,排出腹腔内气体,缝合外部创口。
A、B.10 mm内径套管;C、D.5 mm内径套管图1 建立手术通路
于术前、术后3,7 d应用腹腔镜技术进行组织样本采集,于液氮中迅速冷冻后,-80℃保存,采集的组织样本主要用于基因、蛋白检测。
1.6 RT-qPCR检测向组织样本中加入TRIzol进行研磨、裂解、试剂处理、离心、水浴提取总RNA,应用超微量核酸检测仪检测RNA浓度与纯度,使用反转录试剂盒合成cDNA,最后进行实时荧光定量PCR反应。引物设计与合成见表1。
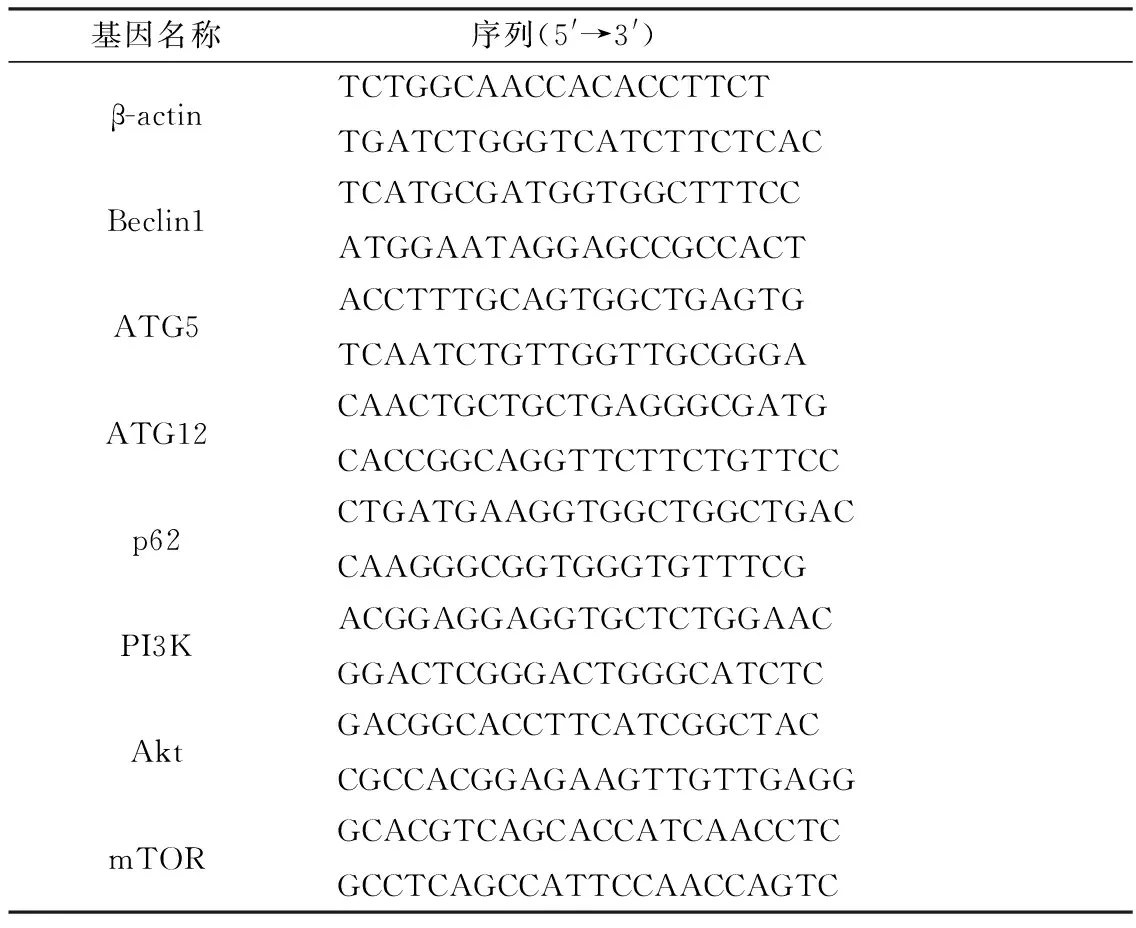
表1 PCR引物序列
1.7 Western blot检测在肝组织样本中加入裂解液经研磨、裂解、离心提取样本总蛋白,采用BCA法测定总蛋白浓度,使用Buffer(5×)进行样本处理,经电泳、转膜、封闭、一抗孵育、二抗孵育、曝光检测样本目的蛋白含量。
1.8 免疫组化肝组织样本经固定、包埋、切片制成切片。处理好的切片依次进行脱蜡、阻断、抗原修复、封闭、一抗孵育、二抗孵育、DAB显色、脱水、封片,最终在光学显微镜下观察染色情况,获取图片,并进行图片分析。

2 结果
2.1 ADSCs-secretome对肝脏自噬相关基因的影响如图2所示,与术前相比,术后3 d,IRI组与DMEM组肝组织中的Beclin-1、ATG5、ATG12 mRNA表达量均呈极显著性上升(P<0.01),p62 mRNA表达量呈极显著性下降(P<0.01);ADSCs-sec组与ADSCs组Beclin-1、ATG5、ATG12 mRNA表达量基本恢复至正常水平(P>0.05),p62 mRNA 呈显著性下降(P<0.05);术后7 d,各分组中的Beclin-1、ATG5、ATG12、p62 mRNA表达水平已全部恢复至术前水平(P>0.05)。结果显示,术后3 d,DMEM组与IRI组相比,Beclin1、ATG5、ATG12、p62 mRNA表达水平无显著性差异(P>0.05);ADSCs-sec组与DMEM组相比,Beclin1、ATG5、ATG12 mRNA表达水平明显降低,p62 mRNA表达量明显升高,且差异具有统计学意义(P<0.01);ADSCs-sec组与ADSCs组相比,各自噬相关基因指标结果无显著性差异。术后7 d,4个分组数据显示已无显著性差异(P>0.05)。

A~D.分别为Beclin-1、ATG5、ATG12、p62在肝组织中的mRNA表达量变化;▲▲P <0.01,▲P < 0.05,与术前相比;##P < 0.01,与DMEM组相比图2 自噬相关基因表达情况
2.2 ADSCs-secretome对肝脏自噬相关蛋白的影响如图3所示,术后3 d,DMEM组与IRI组相比,Beclin1、LC3Ⅱ、p62蛋白表达量差异不显著(P>0.05);ADSCs-sec组与DMEM组相比,Beclin1、LC3Ⅱ蛋白表达水平呈极显著性降低(P<0.01),p62蛋白表达水平呈极显著性上升(P<0.01);ADSCs-sec组与ADSCs组相比,Beclin1、LC3Ⅱ、p62蛋白表达水平无显著性差异(P>0.05)。术后7 d,各组之间各自噬相关蛋白表达量差异不显著(P>0.05)。

A.自噬相关蛋白图;B~D.分别为Beclin-1、LC3Ⅱ、p62在肝组织中的蛋白表达量变化;##P<0.01,与DMEM组相比图3 自噬相关蛋白表达量
2.3 ADSCs-secretome对肝脏自噬相关蛋白LC3Ⅱ影响的免疫组化结果如图4,5所示,术后3 d,DMEM组与IRI组相比,LC3Ⅱ蛋白表达量无明显差异(P>0.05);ADSCs-sec组与DMEM组相比,LC3Ⅱ蛋白表达量呈极显著性降低(P<0.01);ADSCs-sec组与ADSCs组相比,两者无显著性差异(P>0.05)。术后7 d,4组之间LC3Ⅱ蛋白表达量已无显著性差异(P>0.05)。

##P < 0.01,与DMEM组相比图5 LC3Ⅱ蛋白表达情况
2.4 ADSCs-secretome对肝脏自噬通路PI3K/Akt/mTOR相关基因的影响由图6可见,术前,各组PI3K、Akt、mTOR基因表达量较高。相比于术前,术后3 d,ADSCs组与ADSCs-sec组PI3K、Akt、mTOR mRNA已基本接近术前水平(P>0.05),IRI组和DMEM组仍未恢复(P<0.01);术后7 d,各组中PI3K、Akt、mTOR mRNA全部恢复至术前水平(P>0.05)。其中,结果显示,术后3 d,DMEM组与IRI组之间无显著性差别(P>0.05);ADSCs-sec组PI3K、Akt、mTOR mRNA表达量显著高于DMEM组(P<0.01);ADSCs-sec组与ADSCs结果无显著性差异(P>0.05)。术后7 d,各组之间已无显著性差异(P>0.05)。
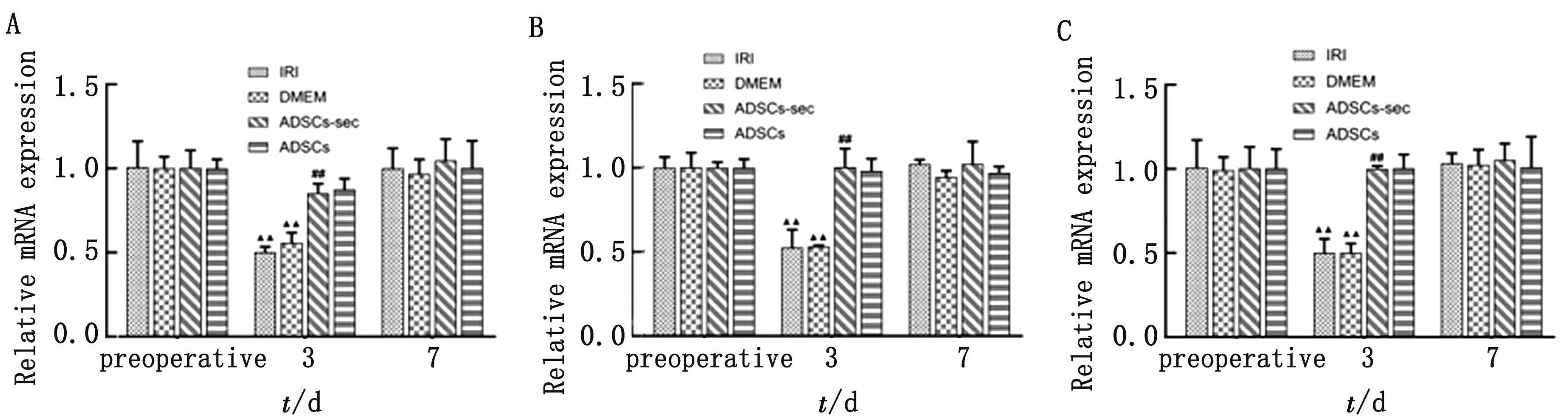
A~C.分别为PI3K、Akt、mTOR在肝组织中的mRNA表达量变化;▲▲P<0.01,与术前相比;##P<0.01,与DMEM组相比图6 自噬通路相关基因表达情况
2.5 ADSCs-secretome对肝脏自噬通路PI3K/Akt/mTOR相关蛋白的影响如图7所示,术后3 d,DMEM组与IRI组中的p-Akt/Akt、p-mTOR/mTOR比值无显著性差异(P>0.05);ADSCs-sec组中的p-Akt/Akt、p-mTOR/mTOR比值显著高于DMEM组(P<0.01);ADSCs-sec组与ADSCs组之间无显著性差异(P>0.05)。术后7 d,各组之间p-Akt/Akt、p-mTOR/mTOR比值均无显著性差异(P>0.05)。
3 讨论
3.1 ADSCs-secretome对肝细胞自噬损伤后期修复的调节作用肝IRI是一种严重的并发症,发生在低血容量休克、肝切除和肝移植过程中,会对患者的预后产生不利影响[12]。自噬在维持肝细胞内环境稳定方面起着重要作用。当细胞受到损伤时,自噬发生为细胞提供能量,旨在降低损伤程度,防止细胞死亡。然而,重度IRI却会导致自噬过度增强,过度的自噬会破坏细胞内正常的蛋白质和细胞器,从而导致细胞损伤加重,甚至死亡。多项研究发现,降低肝IRI术后过度自噬反应能够改善肝损伤,促进肝脏修复[13-14]。有研究表明,肝IRI合并肝切除能够引起肝细胞过度自噬,进而加重了肝损伤[3-4]。然而,目前关于自噬的研究大多针对于肝IRI 24 h内的自噬变化进行观察检测,对于肝IRI细胞自噬后期变化知之甚少。针对这一问题,本试验对肝IRI术后3,7 d的样本进行提取、检测。结果显示,肝IRI术后3 d时,自噬表达仍处于较高水平,术后7 d,自噬水平恢复正常。因具有易获得肝细胞分化潜力以及旁分泌效应等优势,ADSCs已成为一种很有前途的缺血性肝脏疾病治疗细胞。目前,有研究表明,基于ADSCs治疗的组织修复主要归因于其旁分泌效应,包括抗凋亡、促血管生成、抗炎作用和抑制纤维化[15-16],而不是直接其分化作用。LEE等[17]研究发现ADSCs-secretome能够减轻肝损伤,改善肝IRI后的肝脏微环境。此外,GE等[4]研究结果显示,ADSCs移植能够通过降低肝细胞过度自噬水平进而减轻肝IRI造成的肝损伤。为进一步探究了ADSCs旁分泌作用在肝IRI肝细胞过度自噬损伤修复中的调节作用,本试验对自噬相关因子Beclin-1、ATG5、ATG12、LC3Ⅱ、p62进行了检测,观察ADSCs-secretome干预后,肝细胞自噬反应的变化。结果显示,与术前相比,术后3 d,IRI组与DMEM组肝组织中的Beclin-1、ATG5、ATG12 mRNA表达量均表现为显著性升高,p62 mRNA表现为显著性降低,以上结果表明,术后3 d时,肝IRI合并肝切除肝细胞过度自噬损伤仍未恢复。术后3,7 d,DMEM组与IRI组结果显示均无明显差异,结果表明,DMEM对肝IRI合并肝切除引起的肝细胞过度自噬损伤后期无调节作用,与生理盐水无差别。术后3 d,ADSCs-sec组与DMEM组相比,肝细胞过度自噬损伤明显得到缓解,ADSCs-sec组在术后3 d时,各自噬相关基因指标已基本恢复至术前水平,以上结果表明,ADSCs-secretome能够加快肝IRI合并肝部分切除引起的肝细胞过度自噬损伤修复。
3.2 ADSCs-secretome对肝细胞自噬损伤后期修复的调节机制研究表明,PI3K/Akt/mTOR 信号通路对细胞自噬和凋亡均具有调节作用[18-20]。mTOR是哺乳动物细胞中雷帕霉素的分子靶标,是调节细胞生长与代谢的重要因子,mTOR的活化可抑制自噬的表达。磷酸化的Akt可激活mTOR,mTOR则会抑制下游分子ULK1复合物从而负调节自噬反应。结果显示,与术前相比,术后3 d,IRI组与DMEM组肝组织中的PI3K、Akt、mTOR mRNA表达量均呈显著性降低,自噬通路PI3K/Akt/mTOR受抑制。DMEM组与IRI组在术后3,7 d,PI3K/Akt/mTOR相关指标检测结果显示无显著差异,因此,DMEM对术后PI3K/Akt/mTOR通路无调节作用。术后3 d,与DMEM组相比,ADSCs-sec组中的PI3K、Akt、mTOR mRNA及p-Akt/Akt、p-mTOR/mTOR蛋白比值均呈显著性升高,且与术前相比,术后3 d,ADSCs-sec组中的PI3K/Akt/mTOR相关基因结果显示已无显著性差别。结合以上自噬相关结果分析得出,ADSCs-secretome可能通过激活PI3K/Akt/mTOR通路从而促进肝IRI合并肝部分切除引起的肝细胞过度自噬损伤修复。
本试验结果表明,肝IRI合并肝切除术后3 d时,肝细胞过度自噬仍未恢复,而ADSCs-secretome能够加快肝IRI合并肝部分切除引起的肝细胞过度自噬损伤修复,且其修复机制可能是通过激活自噬负调控通路PI3K/Akt/mTOR进行调节的。
