母鼠长期铜暴露对子代雄性SD大鼠睾丸功能的影响
2021-11-02曾雅惠杨文艳杨连玉吉林农业大学动物科学技术学院动物医学院吉林省动物营养与饲料科学重点实验室吉林长春130118
曾雅惠,杨文艳,杨连玉 (吉林农业大学 动物科学技术学院/动物医学院/吉林省动物营养与饲料科学 重点实验室,吉林 长春 130118)
铜(Cu)是生物体必不可少的过渡金属元素,作为金属酶的组成成分,直接参与体内代谢、神经递质合成、自由基清除等过程,对机体的生理功能和生长发育起着重要的作用[1-2]。高铜可促进动物生长,因此被作为添加剂广泛应用于畜牧行业生产中,但高剂量的铜代谢缓慢,易导致动物慢性铜中毒[3-6]。关于铜负荷的肝毒性、肾毒性、免疫抑制等导致机体氧化损伤均有报道,亦有研究表明铜负荷对机体生殖系统的毒性作用也非常明显[7-8]。李英等[9]研究发现高铜可引起铜在睾丸中沉积,影响精子数量及其活力,损伤雄性生殖。然而目前,母体铜营养水平是否对出生后其子代的生殖系统发育和功能产生影响,尚未可知。因此本试验建立亲代大鼠长期铜暴露模型,观察子代大鼠睾丸组织形态、精子活力,探究亲代不同铜水平对子代大鼠血清抗氧化指标及睾丸功能的影响。
1 材料与方法
1.1 实验动物及分组实验动物选用SPF清洁级,健康程度良好、胎次相同、体质量相近(44.04±3.05) g 的21日龄断奶雌性SD大鼠24只,购自长春市宽城区宏达动物养殖场。随机分为3个日粮处理组,每组8只雌性大鼠,每天12 h光照,饲养温度24℃,相对湿度50%,自由饮水采食。
1.2 主要试剂酶联免疫分析试剂盒购自上海酶联生物科技有限公司,饲料级含铜25% CuSO4·5H2O(广泽,中国),PrimeScript TM RT reagent Kit with gDNAEraser(TaKaRa,日本),硝酸(HNO3),无水乙醇购自长春商贸添侯生物科技有限公司。
1.3 动物模型及日粮设计3个日粮处理组分别饲喂A、B、C 3种不同铜水平日粮。A 组饲喂AIN-93G基础日粮,B 组饲喂AIN-93G基础日粮+CuSO4120 mg/kg,C组饲喂AIN-93G基础日粮+CuSO4240 mg/kg。试验过程中,每天定时饲喂1次(17:00),自由采食和饮水,预饲7 d,试验期8周,与全同胞性成熟雄性SD大鼠和笼交配,妊娠后单笼饲养,并继续染铜至子代大鼠断乳后。日粮配方见表1。
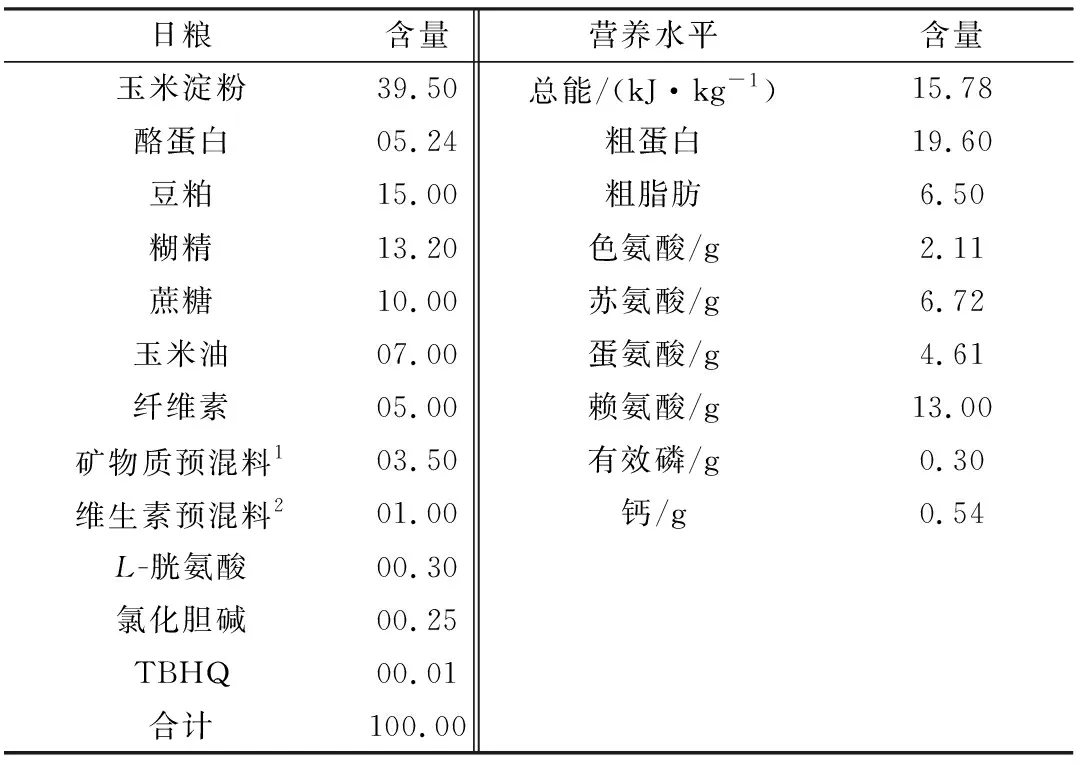
表1 日粮成分及营养水平 %
1.4 样本采集及数据收集子代大鼠3周龄后,每组均继续饲喂AIN-93G基础日粮,待子代雄性大鼠10周龄每组随机取8只作为实验动物,分别标记A0、B0、C0组。空腹眼球采血,断颈处死,分离双侧睾丸和附睾,左侧分离后称量睾丸和附睾湿重,计算脏器指数,用于睾丸石蜡切片,右侧于4℃预冷4%多聚甲醛中固定,用于组织铜的测定。附睾用于精液质量检测。
1.5 血清铜、睾丸组织铜的测定取1 mL血清样品于三角瓶中,加5 mL浓HNO3和2 mL HClO4于电热板上消煮至透明,有少量白烟。静置冷却,加2.5 mL 10% HNO3,转入50 mL容量瓶中,用去离子水定容,摇匀待测,同时做空白试验。待测液用电感耦合等离子发射光谱(ICP-7500)测定。睾丸组织同上。
1.6 血清中抗氧化指标的测定将血液离心,收集上清,试剂盒采用双抗体夹心法测定大鼠血清中谷胱甘肽过氧化物酶(GSH-Px)及超氧化物歧化酶(SOD)活力、丙二醛(MDA)含量、铜蓝蛋白(CP)水平,并严格按照说明书操作。
1.7 精液质量检测脱颈法处理大鼠后,切除附睾尾,用眼科剪剪开,置于1 mL预热的PBS的离心管中,37℃培养箱孵育3 min,使精子游出,用精子稀释液将精子悬液稀释20倍,取10 μL稀释后的精子悬液滴在精子计数板上在光学显微镜下计数,用活动的精子数与总精子数的比值表示精子活力。
1.8 睾丸组织的切片观察左侧睾丸组织于4%多聚甲醛中固定超过24 h后置于包埋盒中,在自动脱水机中按照70%乙醇、80%乙醇、90%乙醇、95%乙醇、100%乙醇、二甲苯、二甲苯Ⅱ的顺序进行脱水,用石蜡包埋,准备切片,再用苏木精-伊红染色,用中性树胶封片,最后在显微镜下观察。

2 结果
2.1 子代大鼠体质量、睾丸湿重、附睾湿重、睾丸及附睾脏器指数由表2可知,子代大鼠体质量、睾丸湿重、附睾湿重、睾丸脏器指数及附睾脏器指数随着亲代日粮铜水平的升高而降低,且与A0 组相比,C0组呈显著降低趋势(P<0.05)。附睾湿重B0组显著低于A0组(P<0.05)。

表2 子代大鼠体质量、睾丸湿重、附睾湿重、睾丸及附睾脏器指数的影响
2.2 血清铜、睾丸组织铜水平由图1可知,子代大鼠血清铜、睾丸铜含量随日粮铜水平的增加而增加。与A0组相比,B0组血清中铜含量显著升高(P<0.05),C0组血清中铜含量极显著升高(P<0.01)。与A0组相比,C0组睾丸中铜浓度显著升高(P<0.05)。

注:与A0相比 *P<0.05;**P<0.01图1 血清铜(左)、睾丸铜含量(右)
2.3 血清中抗氧化指标的变化由表3结果可知,亲代日粮添加120,240 mg/kg硫酸铜,能影响子代大鼠血清中抗氧化指标水平,与A0组相比,亲代添加240 mg/kg的硫酸铜能显著降低子代大鼠血清GSH-Px、SOD水平(P<0.05),但均与B0组差异不显著。与对照组相比,B0、C0组MDA水平均极显著升高(P<0.01)。CP水平随着铜水平增加呈上升趋势,且C0组显著高于A0组(P<0.05)。

表3 子代大鼠血清抗氧化指标
2.4 长期铜暴露对子代大鼠精子的影响由表4可知,子代大鼠精子数量、活动率随着亲代染铜水平的升高而呈下降趋势。与A0、B0组相比,C0组的精子数量和精子活动率显著降低(P<0.05);C0组的精子畸形率显著高于A0、B0组(P<0.05)。

表4 大鼠精子数量、活力及畸形率
2.5 睾丸组织的形态学变化如图2所示,A0组睾丸内部结构正常,生精小管基膜完整,B0组睾丸生精小管扩张且排列松散,C0组睾丸发育不佳,生精小管基膜不完整,生精细胞排列层次不清晰,精子减少,睾丸间质细胞数减少。

图2 大鼠睾丸组织切片(HE × 200)
3 讨论
铜可以通过胎盘和母乳由母体向后代进行转移,胎儿的铜营养完全依赖于母体,妊娠期胎盘作为母体和胎儿之间物质传递的纽带,使铜在胎盘转运过程中优先供给胎儿,导致胎儿体内铜的含量较高。HADDAD 等[10]研究发现用130 mg/kg硫酸铜饲喂妊娠期大鼠,其后代出现生长和发育迟缓的现象,本试验也获得了相似的结果,不同铜水平日粮饲喂亲代大鼠对子代雄性大鼠体质量、睾丸湿重、睾丸系数有降低的趋势,但与吴国星等[11]的试验结果不同,这可能与实验动物的种类及器官的敏感度不同导致。随着日粮铜水平的提高和子代大鼠日粮采食时间的延长,血清和睾丸中的铜水平均呈升高的趋势,通过相关性分析表明,两组数据显著正相关。表明,亲代饲喂不同水平铜日粮会导致铜在子代大鼠体内蓄积,影响大鼠体质量及组织湿重。
动物日粮添加铜能显著提高血清铜SOD活性[12],但高剂量的铜可引起机体组织的病理损伤,导致血清中Cu/Zn-SOD活性降低[13]。GSH-Px能将H2O2分解,产生水和O2,有效防止自由基的生成。血清铜95%是CP结合铜,CP具有氧化酶活性,由肝脏合成,并参与铁代谢和运输铜,血清内的CP水平会随着铜摄入量的增加而显著升高[14]。本试验发现,亲代覆盖120,240 mg/kg的铜,子代大鼠血清中SOD和GSH-Px的活性均随铜水平的增加而逐渐降低,而MDA含量和CP水平逐渐升高,且在亲代添加240 mg/kg铜的子代大鼠中显著升高,这可能是由于亲代铜摄入增加了子代肝脏铜浓度,肝脏通过某一途径继续合成CP。MDA水平上升,意味着动物体内抗氧化系统可能受到破坏,动物机体膜结构已经发生损伤,提示亲代大鼠长期铜暴露后,铜可通过胎盘屏障和血睾屏障进入子代大鼠血清和睾丸内,引起催化类Fenton反应,导致氧化损伤。
睾丸是雄性动物最为重要的生殖器官,主要由曲细精管和间质构成。曲细精管由支持细胞和各级生精细胞组成,前者对生殖细胞具有支持、保护和营养作用。有研究发现,慢性铜暴露的小鼠睾丸组织出现严重的空泡化,曲细精管出现较大的不规则空隙,精原细胞和精母细胞数量减少,而睾丸系数无显著性差异;此外,在高铜暴露的小鼠中发现,精子的活力及运动能力下降,畸形率升高[15-16]。生精小管的萎缩和塌陷、生殖细胞数量的减少和上皮细胞高度的降低是铜暴露小鼠睾丸中典型的组织病理学损伤[17]。本试验结果显示,亲代铜暴露下,子代大鼠睾丸的生精小管中生精细胞疏散,各级精原细胞排列紊乱且形态异常;精子数量减少,活力下降,畸形率上升,而且铜处理剂量越大,超过机体自身耐受剂量,损伤和病理改变程度就越明显,睾丸中铜沉积也越多。研究结果说明了高浓度铜引起的睾丸损伤、精子数量及活力降低,其机制可能是高铜激活了线粒体凋亡的信号通路,降低精原细胞和精母细胞的数量并影响精子发育,引起睾丸发生表观遗传修饰,最终损伤雄性生殖[18]。综上所述,亲代饲喂高铜日粮,会引起子代大鼠发生氧化应激,影响精子生成及睾丸功能。
