脂肪变性对蛋鸡原代肝细胞相关炎性因子表达的影响
2021-11-02郭连营胡国良郭小权江西农业大学动物科学技术学院江西省畜禽疫病诊断与防控重点实验室江西南昌330045
郭连营,黄 橙,刘 平,庄 煜,胡国良,郭小权 (江西农业大学 动物科学技术学院 江西省畜禽疫病诊断与防控重点实验室,江西 南昌 330045)
蛋鸡脂肪肝出血综合征(fatty liver hemorrhage syndrome,FLHS)是一种以脂质蓄积引起肝脏脂肪变性为特征的营养代谢病,在养殖业中易造成严重的经济损失,营养、环境、遗传等是其形成的主要因素[1-2]。FLHS的发病机制尚未完全解释,但游离脂肪酸增多,肝脏脂质代谢紊乱是其形成的主要机理[3-4]。在肝细胞中,游离脂肪酸可通过一系列反应合成甘油三脂(TG)。随着TG在肝脏的逐渐堆积、肝脏对脂肪酸的β氧化能力的减弱以及脂质过氧化程度的增强导致肝脏抗氧化能力减弱,细胞活性氧(ROS)的生成增加触发炎症反应的产生。当蛋鸡发生FLHS时,肝脏脂肪蓄积,同时引起细胞因子和炎症物质的产生,因此进一步研究炎症介质和FLHS引起的脂肪变性发生的关系,对FLHS进行早期干预和靶向治疗具有一定意义。
目前,对于蛋鸡FLHS的研究多基于通过饲喂特殊饲料饮食、药物、基因改造等方法构建的动物模型,但动物模型的建立存在一定的缺点,如研究周期长、存在个体差异等;而构建体外肝细胞模型,具有环境可控、试验时间短、节约试验成本、个体样本与试验批次之间的误差小、针对性强等优点[5]。其中相对于细胞系,原代肝细胞培养虽有难度但可保持正常的细胞形态更能反应生物体内坏境,获得的数据具有更好相关性等特点[6]。
本研究通过提取高产蛋鸡原代肝细胞利用油酸/棕榈酸诱导培养24 h建立FLHS细胞模型,同时观察脂肪酸引起肝细胞炎症通路和脂肪代谢变化,以揭示脂肪变性对蛋鸡原代肝细胞相关炎性因子表达的影响。
1 材料与方法
1.1 实验动物34~40周龄海兰褐蛋鸡购自江西省吉安市某蛋鸡养殖场。
1.2 主要试剂及仪器胎牛血清(Biological Industries公司),油酸(Sigma公司),DMEM/F12细胞培养液、PBS缓冲液(Hyclone公司),Ⅳ型胶原酶、青链霉素(100×)、L-谷氨酰胺、维生素C、转铁蛋白、牛源胰岛素、棕榈酸、牛血清白蛋白(不含脂肪酸)、戊巴比妥钠、肝素钠、油红O染色液、曲拉通Triton X-100均购自Solarbio公司。ROS、丙二醛(MDA)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)试剂盒购自南京建成生物工程研究所。6孔细胞培养板(美国康宁公司),反转录试剂盒、荧光定量PCR试剂盒(TaKaRa公司),流式细胞仪(美国BD公司),显微镜(日本Nikon公司),实时荧光定量PCR扩增仪(美国Thermo公司)。
1.3 蛋鸡原代肝细胞的分离培养蛋鸡原代肝细胞的分离培养参照文献[7-8]的方法进行。将提取的鸡原代肝细胞以1×106/mL的浓度接种到6孔细胞培养板中,将细胞置于37℃、饱和湿度、5% CO2细胞培养箱中,每24 h换液1次。
1.4 蛋鸡原代肝细胞FFA模型的构建当细胞贴壁至70%时(约24 h)对细胞进行换液,换成无血清培养液继续培养12 h,使细胞均一化。之后再次换液,正常组(Con组)为无血清贴壁培养液,脂肪肝造模组(FFA组)为添加1 mmol/L油酸/棕榈酸(2∶1)的贴壁培养液,造模培养24 h。
1.5 倒置显微镜观察细胞形态新鲜分离的肝细胞在培养24 h时以及在添加FFA造模后24 h的细胞置于倒置显微镜观察细胞形态并拍照。
1.6 抗氧化指标及ROS的测定肝细胞中MDA含量、CAT和 SOD活力的测定按照试剂盒说明书进行。细胞中ROS的测定按照试剂盒说明书操作,流式细胞仪在激发波长500 nm,发射波长525 nm处测定细胞内ROS的荧光值。
1.7 油红染色按照油红O染色(细胞专用)说明书进行操作,弃掉经过FFA诱导处理后24 h的细胞培养液,PBS清洗2次,用10%多聚甲醛固定15~25 min,弃固定液,用双蒸水润洗2次,加入60%异丙醇溶液作用5 min后弃去,加入油红染色液浸染10~20 min,弃油红染液,利用60%异丙醇和双蒸水清洗多次去掉浮色,加入Mayer苏木精染色浸染5 min用双蒸水洗掉浮色,1%盐酸溶液蓝化,双蒸水清洗至无多余染液,晾干,封片,显微镜下观察。
1.8 炎性相关因子的测定将FFA诱导处理以及正常培养的细胞,弃上清后,向每组培养的贴壁细胞6孔板中每孔分别加入1 mL TRIzol试剂收集细胞样品至相应的离心管中,分别提取细胞总RNA,测定其mRNA的浓度,反转录成cDNA后,采用SYBR GreenⅠ实时荧光定量PCR方法检测相关炎性因子肿瘤坏死因子α(TNF-α)、γ-干扰素(IFN-γ)、IL-18、IL-1β、IL-8、IL-2的表达量。根据GenBank中TNF-α、IFN-γ、IL-18、IL-1β、IL-8、IL-2 mRNA序列和引物涉及原则,利用Primer Premier 5.0软件设计引物,荧光定量PCR反应体系为10 μL,反应程序:95℃ 30 s;95℃ 5 s,62℃ 30 s,40个循环。采用ABI 7500 Real-time PCR system PCR扩增仪(美国ABI公司)进行荧光定量PCR。
1.9 数据统计分析对每组细胞6孔板中的6个样品分别收集进行各指标试验数据的测定。用SPSS 22.0统计学软件,运用ANOVA检验方法对数据进行差异显著性分析,P<0.05表示试验组与对照组相比差异显著,P<0.01表示试验组与对照组相比差异极显著。
2 结果
2.1 原代肝细胞形态观察及脂肪变性模型建立结果如图1A所示,正常肝细胞在培养24 h时呈多边形,接连成片,排列紧密,常见双核,呈现典型的上皮细胞形态。在添加油酸/棕榈酸培养24 h的FFA组细胞(图1B),细胞内脂滴逐渐蓄积呈明显的空泡化现象,但视野中细胞核清晰可见。

A.Con组;B.FFA组图1 24 h肝细胞形态学观察(200×)
2.2 油红O染色观察正常组细胞仅见少量橘红色脂滴,FFA组细胞可见大量红色脂滴甚至出现脂滴融合现象,细胞核呈蓝色(图2)。
2.3 肝细胞的氧化损伤和抗氧化能力流式细胞仪检测结果显示(图3),与Con组相比,FFA组细胞内ROS水平呈极显著上升(P<0.01)。FFA组细胞内MDA含量极显著升高(P<0.01);CAT和SOD活力显著下降(P<0.05)。

A.ROS含量;B.MDA含量;C.CAT活性;D.SOD活性图3 油酸/亚油酸诱导24 h肝细胞抗氧化应激指标的影响
2.4 炎性基因的表达与对照组(Con组)相比,抑炎因子IL-2在FFA组的表达量显著下降,促炎因子IL-18、IL-8、IL-1β、TNF-α、IFN-γ的表达量显著高于对照组,其中IL-18、IFN-γ的表达量极显著高于对照组,IL-1β的表达量显著高于对照组(图4)。
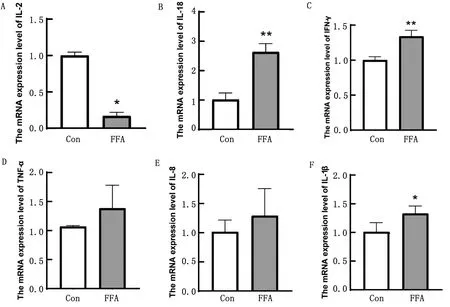
A.IL-2;B.IL-18;C.IFN-γ;D.TNF-α;E.IL-8;F.IL-1β图4 油酸/亚油酸诱导脂肪变性对相关炎症因子表达的影响
3 讨论
本研究采用的改良原位二步灌流法提取蛋鸡原代肝细胞,并利用油酸/棕榈酸诱导脂质变性是根据本实验室长期试验积累、对肝细胞形态学以及肝细胞功能分析后确定的[7-8],可使肝细胞脂质蓄积,造成脂肪变性以模拟蛋鸡体内肝脏脂肪变性的情况。本试验中,经油酸/棕榈酸诱导24 h的原代肝细胞在倒置显微镜下观察发现细胞脂肪空泡化严重,油红染色结果可见明显增多的橘红色脂滴,表明肝细胞脂肪变性模型成功建立。
氧化应激反映了机体ROS等自由基的产生与抗氧化系统清除能力之间的一种不平衡状态[9]。线粒体是ROS主要生成部位,线粒体功能障碍可导致ROS和脂质过氧化物的产生,影响抗氧化酶的活性,造成氧化应激[10-11]。SOD、CAT和MDA因为能清除ROS或间接反映损伤程度而常被用于检测机体抗氧化能力。SOD可将超氧阴离子O2·-转化为H2O2,而CAT可将H2O2解离为H2O。MDA作为细胞脂质氧化的产物,反映了氧化应激的状态。在本试验中FFA组ROS含量显著高于Con组,MDA含量极显著升高,CAT和SOD活力显著降低,表明油酸/棕榈酸诱导的脂肪变性引起肝细胞线粒体功能障碍继而引起ROS生成增多、抗氧化能力降低引起脂质过氧化导致肝细胞氧化应激,从而造成肝细胞损伤。
相关研究表明ROS在促炎反应中起重要作用,可间接引起促炎细胞因子IL-18、IL-1β和TNF-α的分泌[12-14],导致细胞发生炎性浸润和坏死。IL-18可由肝脏Kupffer细胞和损伤肝细胞合成,是重要的前炎症细胞因子,其参与的炎症反应也是介导肝损伤的重要媒介,是细胞因子网络中致肝细胞损伤的关键因子[15]。IL-18在参与诱导细胞因子IFN-γ分泌的同时也可产生大量的TNF-α、IL-8、IL-1β等炎性细胞因子,从而加剧代谢紊乱及免疫功能损伤[16]。IL-1β作为一种促炎因子,除参与组织炎症反应外,还可抑制肝细胞对TG等脂质的转运,脂质通过过氧化反应导致细胞受损,引起组织炎症和细胞凋亡。本研究FFA组细胞中IL-18、IFN-γ、IL-1β的表达量显著升高,与之前的研究结果相似[17-19],表明油酸/棕榈酸诱导的肝细胞脂肪变性造成肝细胞线粒体氧化应激进而促发炎症反应的发生。
TNF-α可减弱肝细胞线粒体呼吸功能,降低线粒体跨膜电位和内外膜间的通透转换孔道开放,是介导早期肝损伤反应的一种主要炎症因子[20]。IL-8 是一种具有趋化和激活中性粒细胞功能的炎症趋化因子可使中性粒细胞弹性蛋白酶释放,生成活性氧化代谢产物,引起炎症细胞积聚并引发炎性反应。研究发现,当机体内肝脏脂质蓄积和内毒素水平升高时,将刺激促炎细胞因子TNF-α的释放和IL-8生成并参与肝脏细胞的炎症级联反应,加剧肝脏细胞损伤[21]。在本研究中也得出相似的结果,TNF-α,IL-8表达量均高于对照组。
同时,与对照组比较,本试验中炎性细胞因子IL-2在FFA组中表达水平显著降低,这一结果与BEN等[22]的研究中IL-2作为抗炎因子结果相似。IL-2表达量显著下降表明机体对炎症反应的抑制作用降低,从而加快了炎性细胞因子的表达,促使炎症反应进一步加重。但也有相关研究表明IL-2在非酒精性脂肪肝患者(NAFLD)体内表达量上升[23-24],这可能与IL-2作为一种多效细胞因子其具有抗炎和促炎特性有关[25-26]。总之,在本研究中利用油酸/棕榈油酸构建了蛋鸡肝细胞脂肪变性模型,发现FFA组中炎症因子IL-18、TNF-α、IL-8、IFN-γ、IL-1β的表达量增加,而抗炎因子IL-2表达量显著降低,说明油酸/棕榈酸处理蛋鸡原代肝细胞不仅导致肝细胞脂肪沉积与脂肪变性,还可诱发肝细胞炎症反应继而引起肝细胞损伤。
综上所述,本研究发现利用油酸/棕榈酸诱导蛋鸡原代肝细胞发生脂肪变性后,肝细胞线粒体功能代谢障碍产生大量ROS,抗氧化能力减弱引起氧化应激的增强,最终诱发炎症反应损伤机体细胞。本研究为FLHS的防治提供可靠的理论依据。
