前列腺素D2对大肠杆菌诱导的小鼠巨噬细胞细胞因子分泌的影响
2021-11-02李茜如巩志国顾柏臣赵佳敏曹金山内蒙古农业大学兽医学院内蒙古呼和浩特010018
金 凤,李茜如,巩志国,顾柏臣,赵佳敏,曹金山,刘 博 (内蒙古农业大学 兽医学院,内蒙古 呼和浩特 010018)
前列腺素(PGs)的形成过程为花生四烯酸(AA)在环氧合酶(COXs),包括COX-1和COX-2的作用下转化为前列腺素H2(PGH2),随后在前列腺素合成酶(prostaglandin synthetase)的作用下转化为PGs[1]。与炎症反应调控过程关联最紧密的PGs包括前列腺素E2(PGE2)和前列腺素D2(PGD2)[2]。在炎症反应中,PGE2可视为一种典型的炎症介质[3-6]。在此过程中,PGD2的分泌水平同样出现显著上升[7]。在小鼠巨噬细胞中,PGD2的合成分泌与其合成酶的表达呈正相关,主要通过造血型前列腺素D2合成酶(H-PGDS)依赖性途径产生[2,7-8]。PGD2是否能够调控病原菌感染后免疫细胞细胞因子的分泌,尚需进一步的探讨。
巨噬细胞可通过分泌细胞因子对病原微生物及其病原相关分子模式(PAMPs)所激活的天然免疫应答起到关键调节作用[9]。在小鼠巨噬细胞被金黄色葡萄球菌感染后,其PGE2的合成分泌依赖于细胞中TLR2(TLR2)、TLR4(TLR4)和NLRP3(NLRP3)等模式识别受体(PRRs)的存在[10]。此外,大肠杆菌感染可诱导小鼠巨噬细胞中PGs的合成分泌[11]。因此,在巨噬细胞中,PGs的合成分泌与细菌感染之间具有紧密的关联,但大肠杆菌感染巨噬细胞后通过何种模式识别受体诱导PGD2的合成分泌,目前尚不清楚。
本研究探讨了模式识别受体TLR2、TLR4和NLRP3在大肠杆菌诱导巨噬细胞PGD2合成分泌中的作用。此外,分析了内源性和外源性PGD2对大肠杆菌诱导的巨噬细胞细胞因子分泌影响。为阐明PGD2在宿主炎症反应中的调控作用提供依据。
1 材料与方法
1.1 主要试剂PGD2、PGD2ELISA试剂盒、两种前列腺品素D合成酶抑制剂HQL-79和H-PGDS抑制剂Ⅰ(H-PGDS Inhibitor Ⅰ)均购自Cayman chenical公司;总RNA提取试剂盒购自Axygen公司;反转录试剂盒购自Thermo Scientific公司;实时荧光定量PCR试剂盒(FastStart Universal SYBR Green Master)购自Roche Applied Science公司;小鼠TNF-α、IL-1β ELISA试剂盒购自Biolegend公司;小鼠IL-10 ELISA试剂盒购自eBioscience公司;小鼠RANTES ELISA试剂盒购自PeproTech公司。兔抗COX-2抗体购自Cell Signaling Technology公司;兔抗H-PGDS抗体购自Abcam公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗购自Cell Signaling Technology公司。
1.2 细菌野生型致病性大肠杆菌(WTE.coli,鉴定证书号:SYS110017)由本课题组分离鉴定保存[12]。
1.3 实验动物C57BL/6J野生型小鼠购自内蒙古大学实验动物中心,TLR2(TLR2-/-)和TLR4(TLR4-/-)基因敲除小鼠购自南京大学模型动物研究所,NLRP3基因敲除小鼠购自美国杰克逊实验室。本试验使用8~10周龄、体质量20 g左右的健康成年小鼠。
1.4 小鼠腹腔巨噬细胞培养和试验处理参照文献[10]方法进行小鼠腹腔巨噬细胞的提取,通过细胞计数将细胞密度调整至5×106个/孔,于37℃、5% CO2培养箱中培养,待细胞完全贴壁后用于后续试验。本研究大肠杆菌对巨噬细胞的感染量为1×106CFU/孔。在使用大肠杆菌感染野生型、TLR2-/-、TLR4-/-和NLRP3-/-小鼠腹腔巨噬细胞后,分别通过实时荧光定量PCR(2,4,6 h)、Western blot(0,6,12 h)和ELISA(6 h)方法分析巨噬细胞中COX-2和H-PGDS的表达水平,以及PGD2的分泌情况。在使用H-PGDS抑制剂(以抑制内源性PGD2的合成分泌)和外源性PGD2预处理巨噬细胞的试验中,细胞培养液中HQL-79、H-PGDS抑制剂和PGD2的终浓度均为1×10-6mol/L。在预处理24 h后,使用大肠杆菌感染野生型小鼠腹腔巨噬细胞,6 h后收集细胞培养上清,并通过ELISA方法检测分析巨噬细胞细胞因子分泌情况。
1.5 实时荧光定量PCR反应总mRNA的提取、反转录和实时定量RT-PCR反应按照说明书进行操作。从小鼠巨噬细胞提取的总RNA反转录为cDNA并进行扩增,步骤如下:使用ABI ViiA 7实时荧光定量PCR系统(Applied Biosystems),50℃ 2 min,1个循环;95℃ 10 min,1个循环;95℃ 15 s,60℃ 60 s,共40个循环。引物见表1。参照文献[13]的方法,以持家基因GAPDH作为内参照,使用2-ΔCt(ΔCt=Ct目的基因-CtGAPDH)的计算方法进行目的基因表达的统计与分析。

表1 实时荧光定量PCR引物序列
1.6 Western blot检测使用Western blot方法对样本中蛋白表达的水平进行分析[10]。其中,COX-2一抗稀释比例为1∶1 000;H-PGDS一抗稀释比例为1∶500;GAPDH一抗稀释比例为1∶10 000;二抗稀释比例为1∶8 000。
1.7 ELISA检测经H-PGDS抑制剂和PGD2预处理或未经预处理的小鼠巨噬细胞在大肠杆菌感染6 h后收集细胞培养上清。按照ELISA试剂盒说明书检测细胞培养上清中PGD2、TNF-α、IL-1β、RANTES和IL-10的水平。

2 结果
2.1 TLR2、TLR4和NLRP3在大肠杆菌感染诱导的小鼠腹腔巨噬细胞COX-2和H-PGDS表达中的作用由图1可见,在大肠杆菌感染后,相比于野生型小鼠来源的巨噬细胞,TLR2-/-、TLR4-/-和NLRP3-/-巨噬细胞中COX-2 mRNA(感染4,6 h后)和蛋白的表达(感染12 h后)处于较低水平(P<0.05)。此外,在未感染状态下,TLR2-/-、TLR4-/-和NLRP3-/-巨噬细胞H-PGDS蛋白表达水平低于野生型巨噬细胞(P<0.001)。在大肠杆菌感染2 h后,TLR2-/-、TLR4-/-和NLRP3-/-巨噬细胞H-PGDS mRNA表达水平与野生型巨噬细胞相比处于较低水平(P<0.001);感染4 h后NLRP3-/-巨噬细胞H-PGDS mRNA表达水平与野生型巨噬细胞相比处于较低水平(P<0.001);感染4,6 h后,TLR4-/-巨噬细胞H-PGDS mRNA表达水平与野生型巨噬细胞相比处于较低水平(P<0.001),该结果与感染12 h后H-PGDS蛋白表达的结果是一致的。因此,上述结果表明TLR2、TLR4和NLRP3参与了大肠杆菌诱导的巨噬细胞COX-2和H-PGDS表达。
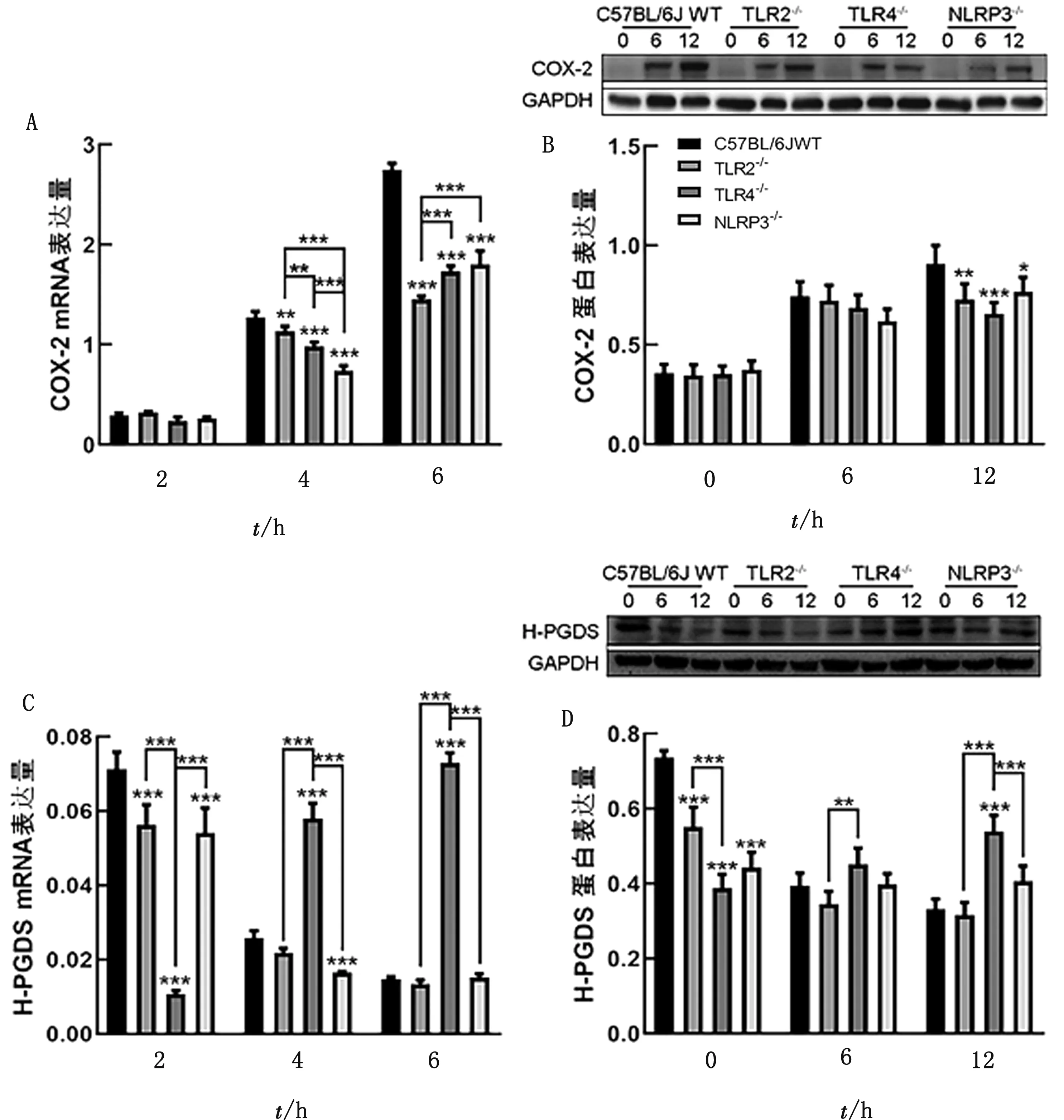
A.COX-2 mRNA表达水平;B.COX-2蛋白表达水平;C.H-PGDS mRNA 表达水平;D.H-PGDS 蛋白表达水平图1 大肠杆菌感染C57BL/6J野生型、TLR2-/-、TLR4-/-和NLRP3-/-巨噬细胞后COX-2和H-PGDS mRNA和蛋白的表达情况
2.2 TLR2、TLR4和NLRP3在大肠杆菌感染诱导的小鼠腹腔巨噬细胞PGD2分泌中的作用结果显示,与野生型巨噬细胞相比,大肠杆菌诱导的TLR2-/-、TLR4-/-和NLRP3-/-小鼠腹腔巨噬细胞PGD2分泌显著处于较低水平(P<0.001),表明TLR2、TLR4和NLRP3参与了大肠杆菌诱导的巨噬细胞PGD2分泌(图2)。

图2 大肠杆菌感染C57BL/6J野生型、TLR2-/-、TLR4-/-和NLRP3-/-巨噬细胞后PGD2的分泌情况
2.3 内源性PGD2对大肠杆菌诱导的小鼠巨噬细胞细胞因子分泌的影响结果显示,与未使用前列腺素D合成酶抑制剂处理感染试验组相比,内源性PGD2合成分泌被抑制后,大肠杆菌诱导的巨噬细胞促炎性细胞因子(TNF-α和IL-1β)、抗炎因子(IL-10)和趋化因子(RANTES)分泌出现显著性下调(P<0.05)。上述结果表明大肠杆菌诱导的巨噬细胞细胞因子分泌在一定程度上依赖于内源性PGD2的合成分泌(图3)。

A.TNF-α;B.IL-1β;C.IL-10;D.RANTES图3 内源性PGD2对大肠杆菌感染诱导的巨噬细胞细胞因子分泌的影响
2.4 外源性PGD2对大肠杆菌诱导的小鼠巨噬细胞细胞因子分泌的影响结果显示,外源性PGD2对大肠杆菌诱导的巨噬细胞促炎性细胞因子(TNF-α和IL-1β)具有上调作用(P<0.01),同时对抗炎因子(IL-10)和趋化因子(RANTES)的分泌具有抑制作用(P<0.001)。上述结果表明外源性PGD2对大肠杆菌诱导的巨噬细胞细胞因子分泌具有调控作用(图4)。
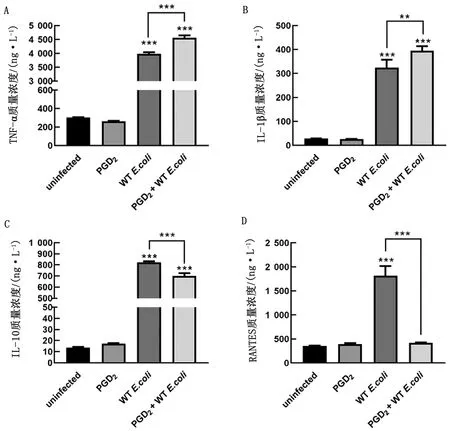
A.TNF-α;B.IL-1β;C.IL-10;D.RANTES图4 外源性PGD2对大肠杆菌感染诱导的巨噬细胞细胞因子分泌的影响
3 讨论
宿主天然免疫系统中模式识别受体的激活在细胞因子的分泌过程中发挥了关键性的作用[14]。此外,PGs的合成分泌与模式识别受体介导的天然免疫应答间具有紧密的联系[10,15-17]。本研究结果表明,TLR2、TLR4和NLRP3参与了大肠杆菌诱导的巨噬细胞PGD2合成分泌过程,并且内外源性PGD2均对大肠杆菌感染巨噬细胞后细胞因子的分泌产生影响。
WU等[10]在前期研究中发现,模式识别受体TLR2、TLR4和NLRP3的激活均参与金黄色葡萄球菌感染巨噬细胞后COX-2的表达过程,进而对PGE2的合成分泌产生影响。由于PGE2和PGD2在炎症反应发生后的合成过程中,均需COX-2的参与,因此,猜测TLR2、TLR4和NLRP3亦可能对PGD2的合成过程产生影响。本研究结果显示,大肠杆菌感染巨噬细胞后COX-2的正常表达依赖于上述模式识别受体的存在,而H-PGDS的表达在巨噬细胞TLR2、TLR4和NLRP3缺失后,并未出现一致性的变化规律。与COX-2表达趋势相一致的是,大肠杆菌诱导的TLR2-/-、TLR4-/-和NLRP3-/-小鼠腹腔巨噬细胞PGD2分泌水平显著低于野生型巨噬细胞。上述结果表明,虽然H-PGDS的表达可能是决定PGD2是否能够正常分泌的重要因素,但TLR2、TLR4和NLRP3的激活更可能直接通过对COX-2表达的调控,进而影响下游PGD2的合成分泌过程。
一般认为PGD2对炎症反应具有调控能力,但其具体作用目前尚不清楚[18]。本研究结果显示,在大肠杆菌感染过程中,巨噬细胞促炎性细胞因子、抗炎因子和趋化因子的表达分泌一定程度上依赖于内源性PGD2的合成分泌;外源性PGD2对大肠杆菌感染巨噬细胞后促炎性细胞因子的释放具有上调作用,对抗炎因子和趋化因子的表达具有抑制作用。上述结果表明,虽然PGD2对大肠杆菌诱导的巨噬细胞细胞因子分泌具有影响,但内源性和外源性PGD2对此过程的调控作用有所区别。
综上所述,本研究探讨了模式识别受体TLR2、TLR4和NLRP3在大肠杆菌感染巨噬细胞后PGD2合成分泌中的作用;此外,分析了内源性和外源性PGD2在此过程中对细胞因子分泌的影响。然而,PGD2通过何种途径对细胞因子的分泌产生调控作用尚未明确,尚待进一步研究。
