猪流行性腹泻病毒HB2018的分离鉴定及致病性
2021-11-02陆泓宇周丹娜杨克礼袁芳艳刘泽文赵红梅田永祥长江大学动物科学学院湖北荆州43405湖北省农业科学研究院畜牧兽医研究所农业部畜禽细菌病防治制剂创制重点实验室湖北武汉430064华中农业大学动物医学院湖北武汉430070
耿 超,陆泓宇,梁 婉,周丹娜,杨克礼,郭 锐,袁芳艳,刘 威,高 婷 ,刘泽文,赵红梅,田永祥* (1.长江大学 动物科学学院,湖北 荆州 43405;.湖北省农业科学研究院 畜牧兽医研究所 农业部畜禽细菌病防治制剂创制重点实验室,湖北 武汉 430064;3.华中农业大学 动物医学院,湖北 武汉 430070)
猪流行性腹泻病毒(PEDV)可引起一种以呕吐、水样腹泻和脱水为主要特征的急性、高度接触性传染病。各年龄段猪对该病毒均易感,7日龄以内的哺乳仔猪症状最为严重,感染致死率高达90%~100%,给养猪业造成了极大的经济损失[1-2]。
2010年,世界范围内暴发大规模PEDV疫情,其中,PEDV的S基因变异是毒株毒力改变的主要原因[3]。病原学研究显示,与疫苗毒株CV777相比,流行毒株发生了较大的变异,其S基因同源性为91%~94%[4]。随着PEDV、猪传染性胃肠炎病毒(TGEV)二联灭活疫苗,PEDV、TGEV和猪轮状病毒(PoRV)(G5型)三联活疫苗以及抗病毒制剂等防控产品的商品化,PEDV疫情得到了控制[5-6],但是PEDV的变异依然十分活跃,需要密切关注其变异趋势,为疫病的防控做好储备。
本试验分离得到1株可以在Vero细胞上稳定传代的PEDV变异株,并扩增测定其S基因序列,通过遗传进化分析,可以得出近年来PEDV流行株的变异趋势。测定分离株的病毒滴度以及设计动物回归试验,研究目前流行的PEDV变异株的特性,将为PEDV疫情的防控提供依据。
1 材料与方法
1.1 病料、细胞及实验动物17份病死仔猪的小肠病料采自湖北省发生腹泻的猪场,PEDV检测有7份为阳性,TGEV和伪狂犬病病毒(PRV)检测均为阴性;Vero细胞由湖北省农业科学院畜牧兽医研究所兽医室保存。10只26日龄健康仔猪购自湖北省某猪场,RT-PCR检测实验猪的PEDV、TGEV和PRV为阴性,PEDV-IgG酶联检测试剂盒(上海酶联)检测仔猪的血清抗体为阴性。
1.2 主要试剂DL2000 DNA Marker、2×Phanta Max Master Mix购自Vazyme公司;胎牛血清(FBS)、DMEM培养基、0.25%胰酶购自Gbico公司;中性红购自国药集团化学试剂有限公司;琼脂糖购自碧云天生物技术有限公司;RNA提取试剂盒购自Axygen公司;反转录试剂盒购自Thermo公司;产物纯化试剂盒购自南京诺唯赞生物科技有限公司;pMD18-T购自宝生物工程(大连)有限公司;PEDV抗体IgG(PEDV-IgG)酶联检测试剂盒购自上海酶联科技生物科技有限公司。
1.3 样品的处理和检测将采集的病料剪取合适大小置于2 mL离心管底部,加入1 mL pH 7.4的PBS缓冲液。用组织破碎仪27次/s破碎10 min后,12 000 r/min离心5 min,取上清,根据AXYGEN公司的DNA/RNA小量提取试剂盒说明书提取基因组,运用多重RT-PCR的方法进行鉴定[7]。将PEDV为阳性的上清液用0.22 μm微孔滤膜过滤除菌,分装后,加入1%双抗,-80℃备用。
1.4 病毒的分离与纯化将1 mL处理好的病毒液接种单层Vero细胞,于CO2培养箱37℃孵育2 h,弃上清,加入含7.5 mg /L的胰酶DMEM培养基6 mL,待细胞出现70%~80%病变,收取病毒液,反复冻融3次分装备用。参照文献[8]的噬斑试验和病毒滴度的测定方法,利用Vero细胞纯化F20代的病毒液,运用Reed-Muench法计算病毒液的TCID50。
1.5 S基因的克隆参考NCBI公布的CV777毒株的序列,将S基因分为S1和S2两段,用Primer 5.0设计引物(表1)。提取PEDV分离株的总RNA,按照反转录试剂盒说明书将RNA反转录为cDNA。以cDNA为模板进行PCR扩增。反应体系(总体积为50 μL):2×Phanta Max Master Mix 25 μL,上、下游引物各2 μL,PEDV cDNA 3 μL,ddH2O 18 μL。反应条件:95℃ 3 min;95℃ 15 s,60℃ 15 s,72℃ 150 s,35个循环;72℃延伸5 min,4℃保存2 h。用1%琼脂糖凝胶电泳鉴定PCR扩增产物。按照产物纯化试剂盒说明书,纯化目的条带,进行T载体克隆,得到重组阳性质粒,送擎科生物科技(武汉)有限公司测序。

表1 PEDV S基因的PCR扩增引物
1.6 S基因的遗传进化与分析参照GenBank登录的PEDV的代表性毒株以及我国近几年流行毒株的S基因序列(表2),运用Mega Ⅹ绘制遗传进化树,将HB2018株的S基因与不同时间不同地域分离的PEDV毒株进行对比分析。同时,将S基因的氨基酸序列与商品化疫苗株(CV777、DR13、AJ1102和LW/L)进行比对。
表2 PEDV参考毒株信息
1.7 动物试验10只26日龄断奶仔猪用PEDV-IgG酶联检测试剂盒检测仔猪的血清抗体为阴性。实验猪随机分成接毒组(n=5)和阴性组(n=5),每个试验组的猪被饲喂在P2动物房。接毒组口服接种4 mL/只病毒液(TCID50为106.7/mL),对照组口服接种相同剂量的DMEM培养基。接种猪和阴性对照猪在接种后每天观测腹泻情况,并采集直肠拭子进行病毒RNA的检测。在接种PEDV 6 d后,实施安乐死进行病理检查。腹泻通过粪便稠度评分来评估。粪便稠度评分标准如下:0=固体;1=糊状;2=半液态;3=液态,评分为2分或2分以上为腹泻。
2 结果
2.1 样品的检测结果通过多重RT-PCR检测,17份腹泻样品中检出PEDV阳性样品7份,约占41.18%,TGEV和 PRV阳性样品未检出。结果表明,湖北地区的仔猪腹泻病原主要为PEDV。
2.2 病毒的分离鉴定将PEDV阳性病料接种至Vero细胞后,有1份阳性病料能够在Vero细胞上出现明显的细胞病变(图1),主要表现为细胞轮廓消失、细胞融合拉网及细胞死亡脱落。经过RT-PCR检测,试验成功分离得到1株PEDV,命名为HB2018株。运用Reed-Muench法计算HB2018分离株的病毒滴度为106.7TCID50/mL。

A.对照组;B.接毒组图1 Vero细胞接毒结果
2.3 S基因的扩增使用分离株基因组反转录的cDNA为模板,进行PCR扩增,得到S1和S2的目的条带,长度分别为2 208,1 953 bp(图2)。送擎科生物科技(武汉)有限公司测序得到S1和S2的序列,拼接得到全长为4 161 bp的S基因。
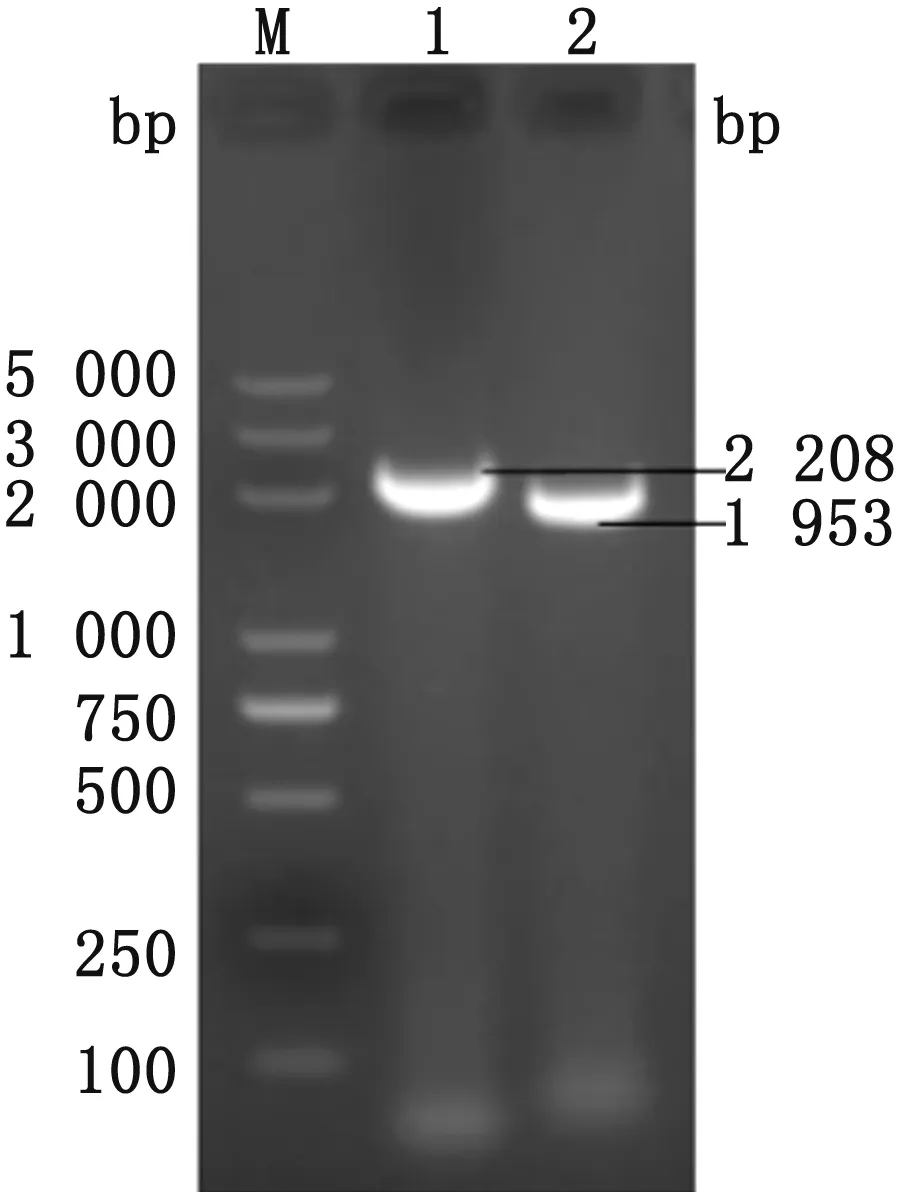
M.DL5000 DNA Marker;1.S1基因;2.S2基因图2 S基因的分段PCR扩增结果
2.4 S基因的遗传进化与分析将分离株S基因与NCBI上公布的典型序列进行比对(图3)。基于S基因绘制遗传进化树表明,PEDV毒株主要分为两个大的分支,GⅠ分支主要包含早期和经典PEDV毒株,而我国近几年的PEDV流行株基本属于GⅡ分支。HB2018株与我国近几年流行的毒株处于同一分支,与经典毒株CV777株等处于不同分支,同源性只有93.76%。HB2018株与我国近几年的流行株一样,均发生了明显的变异。此外,HB2018株与YC2014株、CH/HNLH/2015株和AHCZ-2株同源性较近,同源性分别为99.25%,99.13%,99.23%。
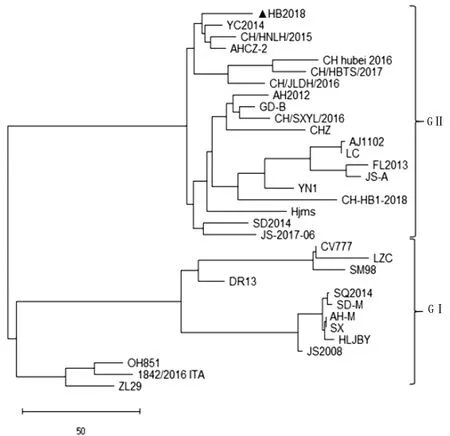
图3 PEDV分离株S基因的遗传进化分析
HB2018株与现有商品化疫苗株的S基因核苷酸和氨基酸进行比对,同源性比对结果显示,HB2018分离株与CV777和DR13(GⅠ亚群)的核苷酸同源性为93.76%和93.52%,与AJ1102和LW/L(GⅡ亚群)的核苷酸同源性为97.40%和97.00%(表3)。HB2018株与CV777和DR13(GⅠ亚群)的氨基酸同源性为93.44%和92.93%,与AJ1102和LW/L(GⅡ亚群)的氨基酸同源性为98.12%和96.90%(表3)。HB2018株与商品化疫苗株相比有11个氨基酸发生突变(表4),这11个位点的突变与GⅠ、GⅡ亚群皆不相同,且与同属于GⅡ亚群的疫苗株在1 199位有1个氨基酸的插入。
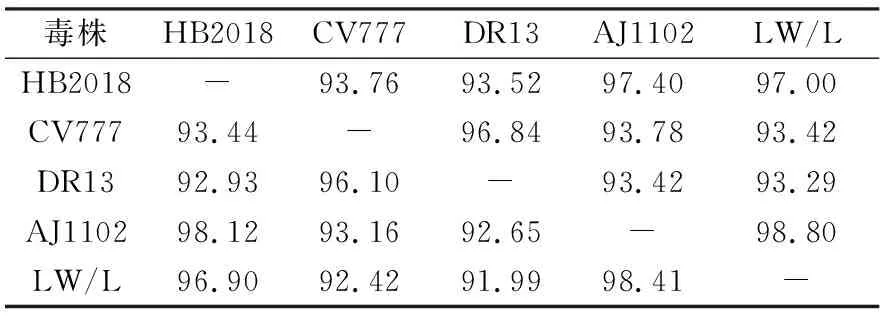
表3 HB2018分离株S基因核苷酸和氨基酸同源性分析 %

表4 HB2018分离株与疫苗株S基因关键氨基酸的突变位点
2.5 动物试验接种PEDV的断奶仔猪中,接种后1 d出现轻微腹泻,此后腹泻症状加剧,在接种3 d时,断奶仔猪腹泻症状严重(所有评分均≥2),随后,仔猪症状逐渐好转。在整个试验过程中,没有出现阴性对照的断奶仔猪出现腹泻或其他临床症状。在接种1~6 d,断奶仔猪的粪便稠度评分先上升后下降(每个时间点P<0.01)(图4)。通过RT-PCR检测断奶仔猪的直肠拭子,接毒组的3头仔猪在接种2 d检测到病毒RNA,接种3~6 d,接毒组的断奶仔猪均检测到病毒RNA。整个试验过程中,没有阴性对照猪的粪便中可检测到病毒RNA(表5)。在安乐死的接种断奶仔猪中没有明显的大体损伤。断奶仔猪的组织学检查显示,小肠的肠壁变得薄而透明,并且在小肠腔中积聚了大量的液体(图5)。阴性对照组的小肠及大肠等其他器官未见明显组织学损伤。

腹泻通过粪便稠度评分来评估。粪便稠度评分如下:0=固体;1=糊状;2=半液态;3=液态,评分为2分或2分以上为腹泻。每个数值为5头断奶仔猪的平均值图4 断奶仔猪粪便稠度评分
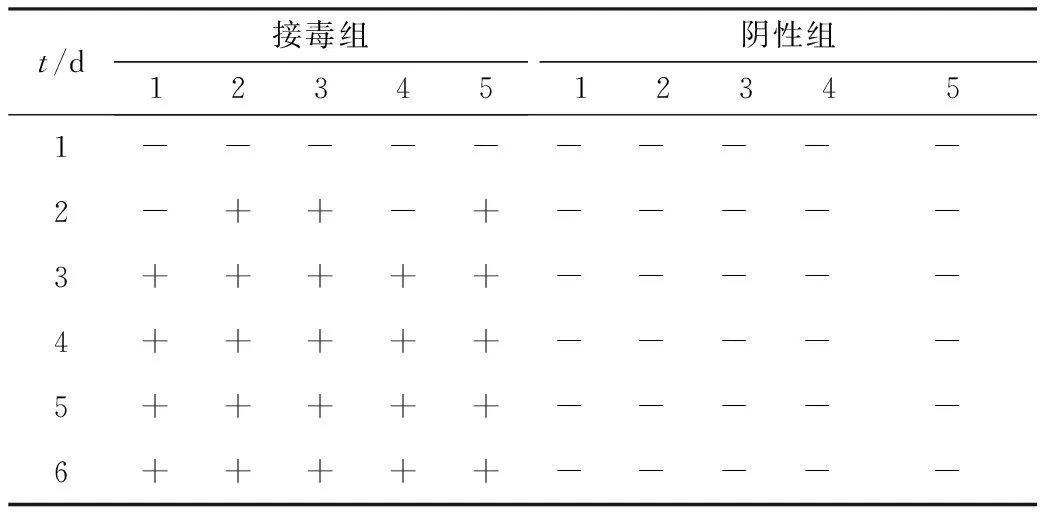
表5 断奶仔猪直肠拭子病毒RNA检测
3 讨论
本研究分离获得1株命名为HB2018的PEDV毒株,扩增其S基因,并分析S基因核苷酸和氨基酸的同源性。根据GUO等[9]的分型依据,HB2018株属于GⅡa亚群,与CV777等经典毒株的同源较低,仅为93.76%,处于不同的分支,与2011年以后我国分离报道的PEDV变异株(GⅡ亚群)处于同一分支,但与AJ1102、LW/L等GⅡ亚群的疫苗株相比,分离株HB2018依然处在不同分支,PEDV依然存在继续变异的潜在风险。氨基酸同源性分析显示,PEDV与现有的商品化疫苗株有较大差异,PEDV正在出现新的变异。由此可见,近几年我国的PEDV依旧处于不断地变异中,需要与流行株相匹配的疫苗株,研究HB2018分离株的特性,将为PEDV疫情的控制提供技术储备。
通过动物试验可知,分离株HB2018口服感染断奶仔猪,仔猪均出现腹泻症状,随后好转,但直肠拭子中可以检测到PEDV 的RNA,组织学检测小肠出现病变,由此可知,PEDV引起哺乳仔猪死亡主要为小肠损伤,脱水致死,结果与JUNG等[1]的研究相一致。此外,有研究对不同日龄仔猪进行动物回归试验,也证实了PEDV可引起仔猪小肠的组织学病变[10-11]。LIU等[12]测定直肠拭子PEDV RNA滴度的结果,与本研究中仔猪排毒的时间一致。
全球范围内广泛流行的PEDV流行株与经典株及疫苗株的基因序列发生了很大程度的变异,其S基因核苷酸序列与报道的PEDV流行株与经典株出现了较大的差异。原因是冠状病毒基因组为单股正链的RNA病毒,稳定性较差,易发生突变。2010年以来,我国暴发的大规模PEDV感染疫情是PEDV发生了较大变异所导致。王婧怡等[13]调查发现,我国原种猪场的PEDV血清阳性值较高,PEDV的疫情依然严峻。此外,PEDV还在变异,这种变异可能对PEDV的防控提出新的挑战,需加强该病原的流行病学研究,密切关注病原的遗传变异。因此,研究当前PEDV主要流行株为防控PED的发生有重要的意义。
