血清球蛋白对神经介入术后急性缺血性脑卒中患者炎症因子和神经激素的影响
2021-11-02李世芳王联军
李世芳,王联军
宝鸡市第三人民医院神经内科,陕西宝鸡 721000
缺血性脑卒中主要是由于血栓的形成和血管的闭塞导致的脑组织缺血坏死性疾病,致残和致死率较高,多数患者预后较差,严重影响患者的生存质量。脑部等血管内皮细胞损伤引起的粥样改变和机体的血小板异常聚集活化等导致的微小栓子形成是引起缺血性卒中的主要因素[1-2]。目前,该病的治疗手段主要是早期的溶栓治疗和神经介入进行机械取栓或支架置入等,但是溶栓治疗的时间窗狭窄和神经介入术后出血等问题严重影响该类患者的治疗效果和术后恢复[3]。目前研究已经证实,行神经介入术的血管内取栓联合溶栓治疗的效果明显优于静脉溶栓治疗,其能够明显改善患者术后7 d时的神经功能缺损和降低远期的病死率[4],故神经介入术后联合静脉溶栓治疗缺血性脑卒中成为临床上常用方法,但是术后的出血倾向仍然存在,并且严重影响患者的最终转归,故本研究关注介入术后患者的出血情况,并探讨该类患者的血清蛋白水平,为临床诊治提供依据。
1 资料与方法
1.1一般资料 选择2018年1月至2020年12月在本院就诊的急性缺血性脑卒中患者236例。纳入标准[3]:(1)经CT等影像学检查确诊为急性缺血性脑卒中;(2)发病时间≤4.5 h;(3)诊断证实为颈内动脉和(或)大脑中动脉闭塞引起的急性缺血性卒中;(5)出现偏瘫和失语等神经功能缺损症状;(6)能够完成全部治疗且依从性较好。排除标准:(1)存在阿替普酶等药物使用禁忌;(2)出现大面积梗死;(3)合并心、肝、肾等功能严重异常或消化道溃疡;(4)存在严重出血倾向。本研究获得患者或患者家属的知情同意,并经医院伦理委员会审核通过。根据治疗方案的不同将入选患者分为观察组(116例,行神经介入联合溶栓治疗)和对照组(120例,仅行静脉溶栓治疗)。根据术后7 d是否出血,将观察组患者分为出血组(23例)和未出血组(93例)。未出血组、出血组及对照组患者体质量指数等一般资料比较,差异均无统计学意义(P>0.05),见表1。为观察血清γ球蛋白对神经介入术后出血患者的炎症因子的影响,以γ球蛋白占比18.8%为临界值,将出血组进一步分为低值组(12例)和高值组(11例)。
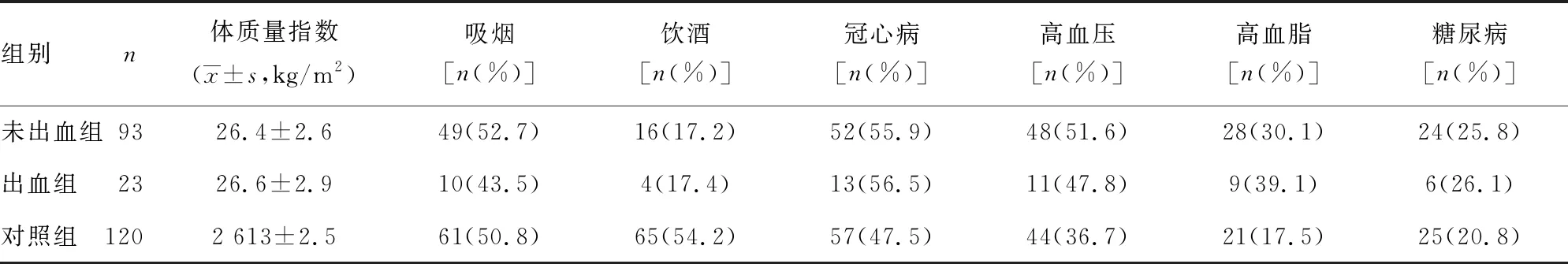
表1 未出血组、出血组及对照组患者一般资料比较
1.2方法
1.2.1治疗方法 对照组行静脉溶栓治疗,而观察组行神经介入术和静脉溶栓治疗。使用计算机断层扫描血管造影或者磁共振血管成像等明确缺血的部位和程度,同时明确侧支循环的建立情况,然后患者行局部麻醉,穿刺经股动脉进入,依据路径图至梗死血管行栓塞切除术,必要时行血管成型术、支架植入术或血管内溶栓术等治疗措施,使用血管造影术判断血管的再通情况。判断标准依据脑梗死溶栓分级(mTICI),0级为未通,1级为微量,2a级和2b级为再通<50%和≥50%,3级为完全再通。静脉溶栓治疗使用阿替普酶剂量0.9 mg/kg,最大剂量90 mg,其中9 mg阿替普酶溶于10 mL生理盐水中快速静脉推注,剩余药物溶于90 mL生理盐水中静脉滴注,观察24 h患者血管造影情况,并口服阿司匹林,剂量0.5 g/d,持续10 d后,逐渐降低剂量并长期使用。需要植入支架的患者,术前行氯吡格雷(75 mg,每天1次)和阿司匹林(300 mg,每天1次)联合抗血小板治疗,使用血栓弹力图检测血小板抑制率。如果存在阿司匹林和氯吡格雷抵抗则调整药物剂量或联用西洛他唑(100 mg,每天2次)抗血小板治疗。此外,该类患者大多合并高血压和高血脂等,需严格控制血压、血脂,随时复查,根据情况调整药物剂量。
1.2.2颅内出血的诊断 新发的颅内出血分为症状性颅内出血和无症状性颅内出血[3,5-6]。符合以下一条即可诊断为颅内出血:(1)神经功能恶化,与恶化前比较,美国国立卫生研究院卒中量表(NIHSS)评分≥4分;(2)NIHSS中任意指标评分≥2分;(3)需要去骨瓣、脑室引流等降颅内压措施;(4)出现颅内出血,但是引起的机体症状并不明显,如出血性梗死1型(点状出血)和2型(点状融合或者斑片状出血)等。
1.3观察指标 采用Sebia全自动凝胶电泳仪及配套试剂检测各组患者治疗前后血清γ球蛋白、β1球蛋白、β2球蛋白、α1球蛋白和α2球蛋白水平。采用酶联免疫吸附试验检测白细胞介素(IL)-2、IL-4、IL-6、IL-10、肿瘤坏死因子α(TNF-α)和γ干扰素(INF-γ)等水平,试剂盒购自上海罗氏诊断公司。通过检测超氧化物歧化酶(SOD)、丙二醛(MDA)、活性氧(ROS)水平观察各组氧化应激水平。使用化学发光法检测术前和神经介入术后7 d各组患者血管紧张素Ⅱ(AngⅡ)、醛固酮(ALD)和心钠素(ANP)等神经激素水平。

2 结 果
2.13组患者治疗前后血清球蛋白水平比较 3组患者治疗前5种血清球蛋白水平比较,差异无统计学意义(P>0.05);治疗后,未出血组γ球蛋白水平明显低于对照组和出血组,γ球蛋白、α1球蛋白和α2球蛋白明显高于对照组和未出血组,差异均有统计学意义(P<0.05)。见表2。
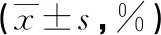
表2 3组患者治疗前后血清球蛋白水平比较
2.2γ球蛋白对出血组患者炎症因子水平的影响 治疗后,高值组IL-2、IL-6和IFN-γ水平明显高于低值组和未出血组,差异有统计学意义(P<0.05)。见表3。
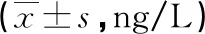
表3 γ球蛋白对出血组患者炎症因子水平的影响
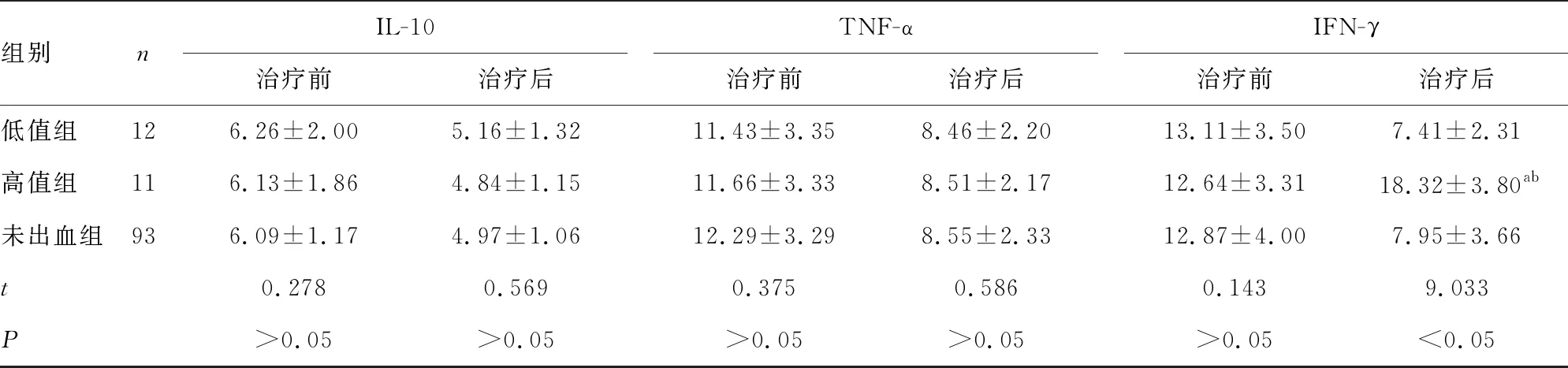
组别nIL-10治疗前治疗后TNF-α治疗前治疗后IFN-γ治疗前治疗后低值组126.26±2.005.16±1.3211.43±3.358.46±2.2013.11±3.507.41±2.31高值组116.13±1.864.84±1.1511.66±3.338.51±2.1712.64±3.3118.32±3.80ab未出血组936.09±1.174.97±1.0612.29±3.298.55±2.3312.87±4.007.95±3.66t0.2780.5690.3750.5860.1439.033P >0.05>0.05>0.05>0.05>0.05<0.05
2.3γ球蛋白低值组、高值组氧化应激水平比较 治疗后,高值组SOD水平较低值组明显降低,MDA和ROS水平较低值组明显升高,差异均有统计学意义(P<0.05)。见表4。
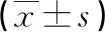
表4 γ球蛋白低值组、高值组氧化应激水平比较
2.4γ球蛋白低值组、高值组神经激素水平比较 高值组患者AngⅡ、ALD和ANP水平明显高于低值组和未出血组,低值组ALD水平明显低于未出血组,差异有统计学意义(P<0.05)。见表5。
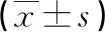
表5 γ球蛋白低值组、高值组神经激素水平比较
3 讨 论
随着医疗检测技术的提高,血清蛋白筛查变得越来越普遍,并逐渐得到临床医生的重视,异常血清蛋白电泳逐渐成为研究的热点[5]。依据所带电荷等性质不同导致的电泳速度差异,血清蛋白可以分为清蛋白、γ球蛋白、β1球蛋白、β2球蛋白、α1球蛋白和α2球蛋白。其中,清蛋白是重要的营养蛋白,α1球蛋白和α2球蛋白主要是抗胰蛋白酶等急性时相反应蛋白,β1球蛋白和β2球蛋白主要是脂蛋白和转铁蛋白,而γ球蛋白包括IgG等免疫球蛋白和炎性相关蛋白,如CRP[6]。
神经介入术后患者的出血现象并不少见,一般认为溶栓和抗凝剂等相关药物使用,血小板功能等自身凝血条件和介入操作对血管的损伤等都可能影响患者的出血转归。特别是血小板功能良好,介入操作顺利,药物使用合理的情况下仍然出现明显的出血转归,故本研究尝试关注患者其他临床指标可能产生的影响。本研究发现,出血组和非出血组患者治疗后γ球蛋白、α1球蛋白和α2球蛋白水平比较,差异有统计学意义(P<0.05)。有研究证实,γ球蛋白与感染相关疾病有密切联系[6-7]。目前,对于介入术后的出血转归预测主要使用血栓弹力图,但是单纯的血栓弹力图的预测价值具有明显的局限性,故本研究观察γ球蛋白对神经介入术后出血患者的影响,结果显示,出血组患者的γ球蛋白水平明显高于未出血组,说明γ球蛋白可能影响神经介入术后患者的出血及转归。本研究还以γ球蛋白的界值进行分组,观察γ球蛋白高值组及低值组患者炎症因子水平,结果显示,γ球蛋白高值组患者IL-6水平明显升高,说明患者处于较高的促炎症状态,而脑卒中后患者机体的高炎症状态会严重影响脑组织的缺血损伤恢复和侧支血流的再建立。
肾素-血管紧张素(RAS)系统是机体重要的水电解质调节系统,其水平的改变能够引起血管的收缩影响脑血管性疾病的再通恢复并加重缺血损伤[2,7-8]。有研究证实,蛛网膜下腔出血后RAS系统激活,高水平的AngⅡ和高表达的相关受体能够引起强烈的血管收缩,减少血液流通,进而导致脑组织的缺氧性损伤[5]。本研究中,出血组患者的γ球蛋白水平升高,RAS系统和促炎因子亦明显激活,其可能的原因是,γ球蛋白与应激、感染相关,γ球蛋白水平升高可引起炎症因子上调和氧化应激水平升高,进而导致AngⅡ和ALD激活,血管收缩,引起脑组织缺血损伤[9-10]。另一方面,脑卒中的出血转归亦会引起AngⅡ的产生,并进一步刺激炎性反应,促进炎症因子释放和血管收缩,以减少血管的持续出血,但是强烈的血管收缩可减少脑组织的血液供应,加重脑组织的炎性反应和氧化应激状态,降低大脑血管的顺应性,引起脑组织的缺血损伤[10-11]。所以,神经介入术后出血可能是一种正反馈的机制,而γ球蛋白水平升高可能参与这个过程,并影响最终转归。
在本研究中,超过60%的患者患有高血压等多种系统性疾病,多种基础疾病状态可能是导致入组患者术后出血率较高的主要原因。此外,严重出血事件和不严重出血事件均被统计,这是导致本研究出血率升高另一个原因。
总之,神经介入术后的出血转归严重影响患者的预后,其发生可能与高γ球蛋白水平相关的高促炎因子水平和高AngⅡ和ALD水平有关,但是γ球蛋白水平与脑血管疾病及神经介入术后的出血转归关系仍然需要进一步探讨。