病原微生物防控在实验动物设施管理与生物安全控制中的作用探讨
2021-11-02罗银珠闵凡贵何丽芳潘金春
罗银珠,闵凡贵,王 静,何丽芳,潘金春
(广东省实验动物监测所,广东省实验动物重点实验室,广州510663)
近年来,新发传染病和再发传染病在全球不断增加。人兽共患疾病可通过直接接触动物或食物、水和环境,从动物传播给人类[1]。实验动物从业人员时刻面临着两个职业健康挑战:一是生物性危害,二是生物安全防护。国内外时而报告的动物实验室获得性感染、实验动物病原微生物污染、实验室病毒泄露、携有危险病原样品丢失等事件均给生物安全管理敲响了警钟。把生物安全管理作为实验动物设施管理的核心要素进行贯彻落实,将是我国实验动物行业发展的一个重要环节[2]。本文围绕实验动物设施相关生物安全管理现状及相关法律、法规和标准、病原微生物污染来源和控制、生物安全管理及体系建设等方面进行分析阐述,旨在为实验动物设施管理及生物安全控制、公共卫生体系建设提供参考。
1 病原微生物防控的公共卫生属性
病原微生物防控在实验动物设施管理与生物安全控制中起到关键作用,具有独特的公共卫生属性。实验动物病原微生物防控的公共卫生属性主要包括4个方面:
一是保障实验从业者安全。动物病原微生物暴露是动物实验从业者的主要职业暴露之一。全球已知的人类传染病有60%来自动物,已发现人兽共患病有200多种[1]。据报告,每年都有在动物设施中因职业暴露而发生实验室获得性感染的事件。病原微生物控制对从源头上保证动物和人员健康安全起着关键作用。
二是保护实验动物健康。实验动物疫病众多,直接影响实验动物质量。有效保障实验动物质量,降低动物因病死亡率,减少因动物异常导致的实验失败等问题,需要良好的病原微生物防控体系,需要设施管理者或兽医制定和实施病原微生物控制计划。
三是保证科学研究实验结果可靠。影响科研实验结果的三大因素包括实验环境、技术人员技术水平及实验动物质量。2019年底爆发并流行至今的新型冠状病毒肺炎疫情更加凸显了实验动物在动物模型构建、病毒感染机制研究和药物筛选上的重要性。
四是保障环境安全。实验室特别是从事一、二类病原微生物动物感染实验室的污水、废气、样品尸体,以及实验操作过程中产生的固体废物(包括高效过滤器、防护用品)等均是威胁环境安全的潜在生物安全因子。识别这些潜在的环境安全威胁因子,采取相应防控措施,并加强重点管控,是提升实验室应对公共卫生事件能力的重要内容。
2 当前我国实验动物病原微生物防控和生物安全管理现状
实验动物的生物安全管理是对实验动物可能产生的潜在风险,或动物实验过程中可能产生的对人或动物的潜在风险或现实危害的防范和控制。国家一直高度重视实验动物的安全使用和规范利用,相关法律体系基本形成(表1~2)。但个别机构仍然出现实验动物从业人员对生物安全重视度不够、在岗培训流于形式,生物安全管理体系尚不完善或可执行性差、责任不明确、落实不到位,动物实验过程缺乏生物安全监管和指导、动物病原微生物控制水平和知识不足,动物实验室生物安全风险管理缺位等现象,不利于实验动物设施乃至整个行业的良性发展,给生物安全管理带来了一定的风险。
3 实验动物病原微生物危害和风险
已知实验动物病原微生物危害主要包括对人员健康的危害,对动物健康的危害,对科学研究的影响,以及对环境的影响。
国内外报告的实验动物微生物种类包括细菌、病毒和真菌共两百多种[3]。实验室获得性感染的来源以及可能引起感染的途径链中,吸入具有传染性的气溶胶,通过飞溅、触摸或溢出与黏膜接触,或经皮途径感染即咬伤、割伤、意外的自我接种等都是潜在的感染途径。目前有报告的情况包括:实验人员因为抓取不当,或使用锐器割伤,或动物实验时意外针刺,感染结核分支杆菌[4];在动物实验中暴露伤口,感染肾综合征出血热[5];解剖时防护不足,导致淋巴细胞性脉络膜脑膜炎病毒感染[6];给小鼠接种痘苗病毒后,尝试重新盖好针头时刺穿手套,感染痘苗病毒[7];因个人防护不当,感染牛痘[8];使用未经检疫大鼠,或未严格穿戴防护用品,感染流行性出血热[9];工作后发现防护衣服撕裂,形成埃博拉病毒感染风险[10];被带有埃博拉病毒的豚鼠血液注射器意外扎伤导致感染,医治无效死亡[11]。但在大多数的实验室获得性感染案例中,潜在的感染路径仍然没有明确[12-13],需要研究人员提高风险识别和评估能力,包括对实验动物设施病原微生物污染源(表3),以及对实验动物设施病原微生物污染风险的识别及控制措施(表4),并严格执行相关的病原微生物等级要求管理标准。
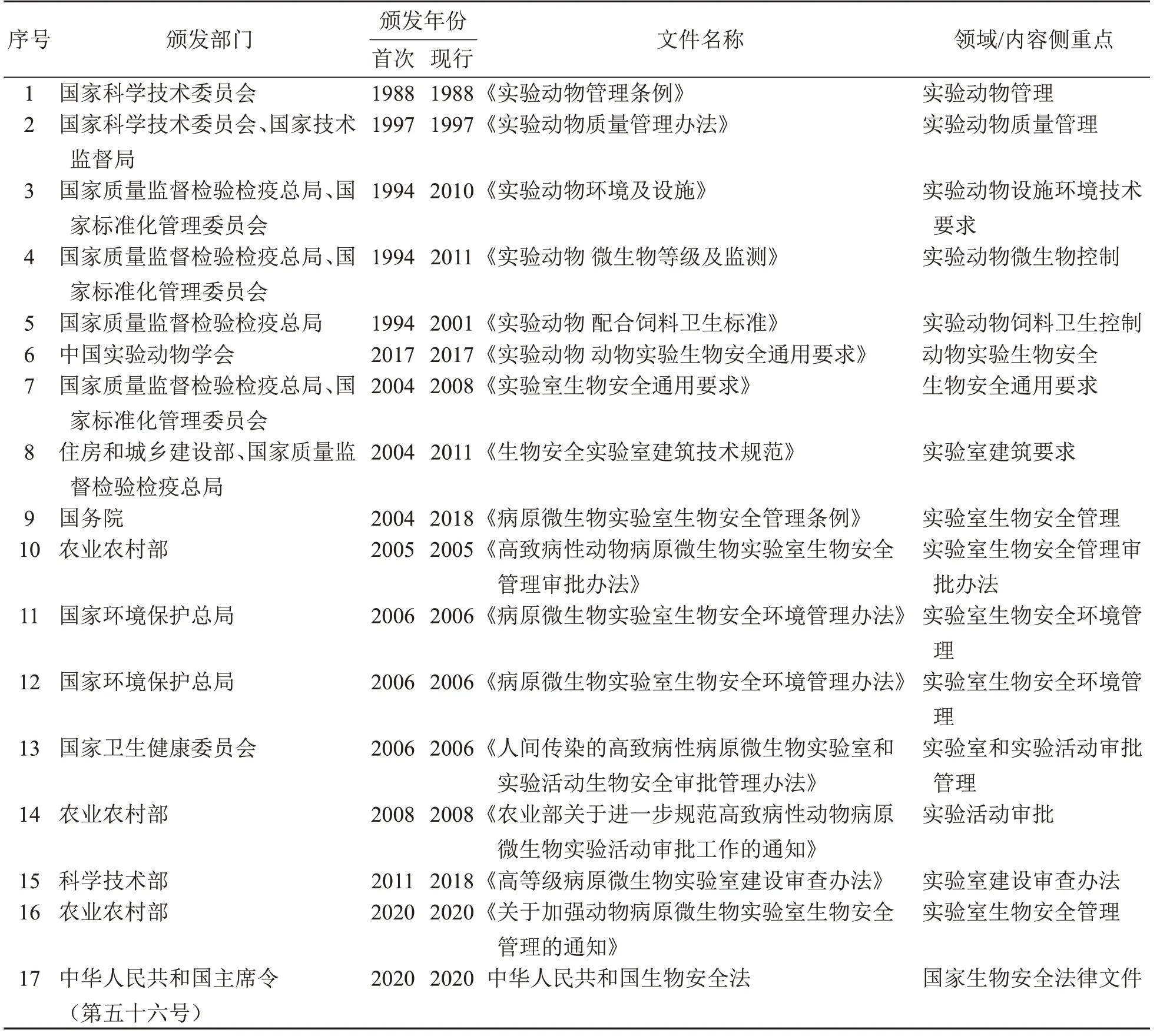
表1实验动物安全使用和规范利用的相关法规/标准/指南/办法及其侧重点Table 1 Legislations,regulations,and policies regarding the use of laboratory animals
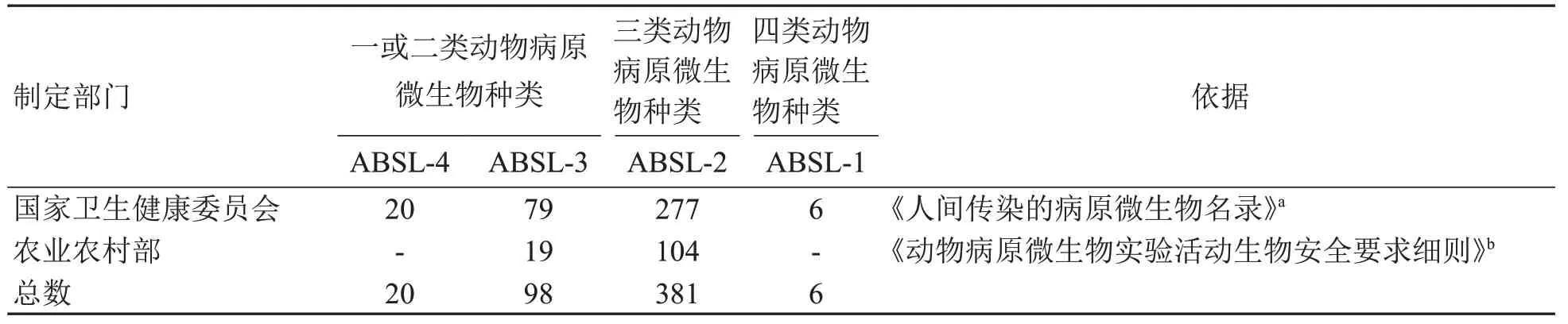
表2需在不同等级生物安全动物实验室开展的病原微生物分类和数量Table 2 Classification and number of pathogenic microorganisms conducted in animal laboratories of different biosafety levels
为减少污染源,近20年来国家及各地陆续制定了不同品种实验动物的病原微生物等级要求标准,明确了所需排除的病原微生物种类(表5),这为识别和降低实验动物设施病原微生物来源和危害提供了重要的依据。

表3实验动物设施中病原微生物污染源Table3 Sourcesof pathogenic microorganismsin laboratory animal facilities
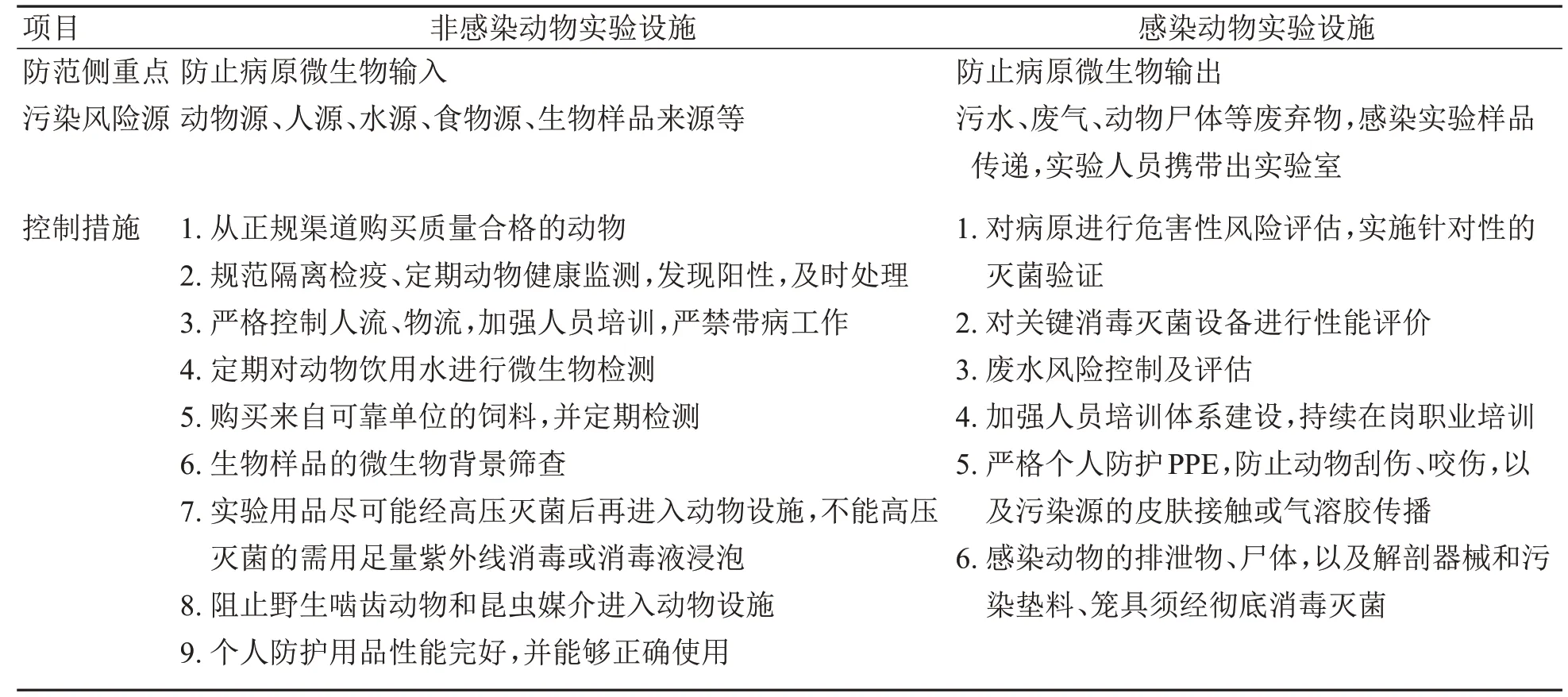
表4实验动物设施中病原微生物污染风险的识别及控制措施Table 4 Identification and control measuresof pathogenic microorganism contamination in laboratory animal facilities
4 实验动物设施病原微生物控制的对策和建议
4.1 加强行业内病原微生物控制意识和能力,优化从业人员的生物安全培训体系
在一项探究实验室获得性感染的数量与污染潜在原因的国际调查中发现,人为错误在实验室获得性感染病例中占有很大比例[14],提示病原微生物控制意识亟待加强,生物安全培训体系建设势在必行。
探索适合我国国情的实验动物从业人员专业性培训模式,提高从业人员对病原微生物防控的整体认知水平,可以从以下几个方面着手。一是培训渠道多元化,可结合现代网络化技术,组织开展线上、线下多形式跨地域的在职教育培训。二是培训形式多样化,如理论培训、实践培训、购买服务、专家上门培训、短期集中培训等。三是培训体系系统化,建立一套完善的人员知识水平评估体系,针对不同人群设定不同培训方式,并对培训效果进行评价和总结改善。
为改变以往培训过程中对病原微生物防控及生物安全重要性强调不足的问题,应聘请具有丰富的病原微生物防控及生物安全管理经验的人员,分岗位特点和对象,有侧重点地进行细化培训。例如,针对辅助人员,主要是强调动物污染粪便的规范收集和处理,以及处理污染物时正确做好个人防护,并注意消毒剂的正确配制和有效期内使用、合理使用灭菌高压锅等;而针对占比最大的技术人员,则应侧重防范动物抓咬、动物唾液尿液喷溅、个人防护、手术刀和针头等锐器的规范使用处理;针对涉及病原微生物感染实验的人员,则更加强调个人防护用品的完整和规范穿戴,注重病原微生物领用、灭活销毁污染动物的操作和处理,以及微生物危害及风险知识储备等[15]。
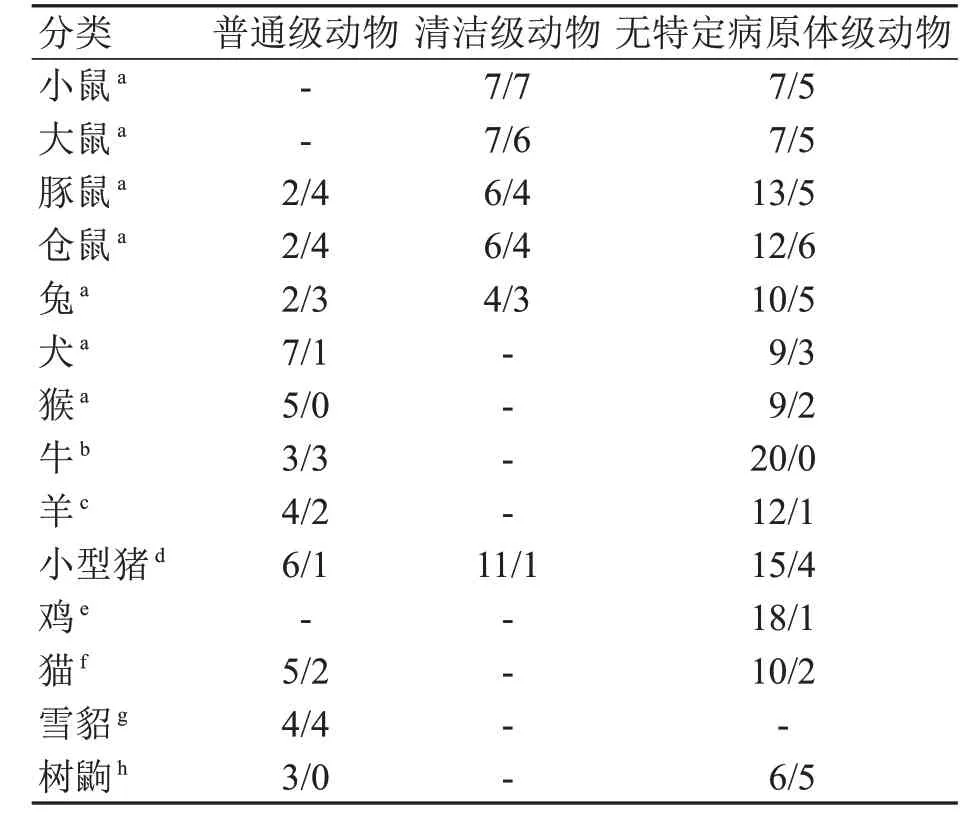
表5常用实验动物所需排除的病原微生物数量Table5 Number of pathogenic microorganismsshould be eliminated in commonlyused laboratoryanimals
4.2 健全动物健康监测体系,改变病原微生物防控被动局面
动物实验室获得性感染事件警示我们,实验动物能成为某种传染性疾病的传染源。因此,建立执行性好且完善的动物健康监测系统是提高实验动物设施病原微生物防控能力的有效措施。动物引入设施前,必须对动物进行传染病的卫生安全检疫和兽医临床检查,检疫期需强化实验室生物安全防护。对设施内常在动物群体应定期抽检,疑似异常的实验动物应及时送检[16]。对超过3个月长期实验,实验期间应定期进行人兽共患病监测[17]。合理选择病原监测方法,特别是对于肿瘤移植类实验、基因工程动物实验,需要设施管理人或兽医给予更多关注。传统的血清学、PCR分析和尸检对脏垫料哨兵动物进行病原微生物监测被越来越多的研究者证明在某些病原监测中存在弊端[18-19]。随着分子及宏基因组检测技术的发展,越来越多的报告显示,环境样品材料监测,特别是排风口粉尘(exhaust air dust,EAD)检测,与传统的哨兵监测相比更优越[20]。
近年来,实验动物新疾病不断出现,病原体检测技术不断更新完善。目前国内在成熟、主流的血清抗体监测体系基础上,又建立了多种病原微生物的核酸检测体系[21]。设施管理者或兽医需根据本设施内流行病情况及监测重点选择不同的检测方法,通过创新病原体监测手段和模型,自检或购买监测服务等,实现从传染病传播角度即传染源、传播途径、易感动物/人群进行控制预防,监测可能存在的潜在危险。不同技术的联合使用可充分发挥各技术的优势以及协同作用,能够提高病原体检测和处理效果,是控制病原微生物的重要技术发展方向。
4.3 更新生物风险评估观念,提升病原微生物污染/感染风险的识别能力
生物风险评估是生物安全管理的核心,主要是对具有传染性物质的风险识别与鉴定,制定降低风险的方案,并执行与再评估,其意义在于确定生物安全防护水平[22]。实验动物使用过程中的病原微生物风险是一个不容忽视的问题[23]。新购动物携带病原体背景评估、防范野鼠的病原微生物和遗传污染、实验人员携入病原微生物污染、饲养环境条件异常激发传染病爆发、动物异常表现或突然死亡等均是生物风险评估和识别的重点。
目前阻碍实验动物设施内相关生物安全措施应用的因素包括缺少具体的生物安全保障技术性文件、生物安全技能及培训不到位、使用不合格的实验室耗材、人员重视程度不够,以及生物风险评估工作减少等,这些均使得实验室危害持续存在,生物安全脆弱性增加[24]。面向整个机构人员建立风险评估和风险控制观念,成立专门的风控风评小组来进行科学评估,建立一套涵盖对实验室水、电、通风、空调、气流流向、相邻房间压差、核心硬件设备性能、预防气溶胶散逸和污染措施、消毒效果验证过程、突发事件紧急预案、应急事件处理方案、污染样品管理规范(保藏、运输、灭活、销毁)、菌毒种及含活毒样品的领用和监管、潜在危害分析与意外事故处理程序,个人防护及微生物操作程序等的科学评估体系[22]。
4.4 发挥管理委员会作用,加强生物安全监督和职业健康指导
实验动物机构的生物安全监督主要是通过实验动物管理委员会、职业健康及安全委员会和(或)生物安全委员会进行。实验动物管理委员会对拟开展的动物实验方案具有风险评估审核和监督职责。职业健康及安全委员会的工作则是实验动物机构申请国际实验动物管理评估与认证协会(Assessment and Accreditation of Laboratory Animal Care international,AAALAC)认证时的重要审查环节,旨在考核机构在实验动物从业人员健康和安全保障方面的成效。生物安全委员会是动物生物安全实验室备案及中国合格评定国家认可委员会(China National Accreditation Service for Conformity Assessment,CNAS)进行生物安全实验室认可的重要考量部分,在涉及病原微生物实验及操作方面发挥监督作用。然而,目前国内不少实验动物机构的这些委员会建设尚未完善或停留于表面,未切实发挥监督和监管作用,常因为缺少实际操作、制度不明确、责权不清、人员管理缺位、缺少专业的职业健康管理人才、从业人员对职业危害缺乏认识等,并未发挥委员会应有的作用,使制度落实不到位,给生物安全和职业健康管理带来了巨大隐患[24]。
实验动物从业人员是发生职业暴露、感染人兽共患病的高危人群。组织生物安全专业人员进行风险评估审查,由具备职业健康管理经验的人建立职业健康与安全计划,充分发挥管理委员会在动物设施生物安全管理和职业健康指导中的作用,建立和落实实验室生物安全自查制度,完善不符合生物安全要求的工作程序,提高实验室生物安全和职业健康管理能力。
4.5 完善实验动物设施的生物安全管理体系建设
实验动物不可避免会携带微生物,实验人员面临各种潜在的职业健康危害。建立良好的微生物规范(good microbiological practices,GMPs),加大对接触动物的人员的工作规范指导和生物安全管理,可以有效减少职业暴露,最大程度地降低人员受伤或患病风险,保护人员安全,这是病原微生物控制的重要内容[25]。建立完善的生物安全管理制度性文件,包括生物安全手册、程序文件、实验室生物安全、技术规范和操作规程、生物危害评估制度、实验室感染应急处置预案、生物安全监督机制等,以增强实验动物设施的自查防范能力。
4.6 发挥兽医在病原微生物防控中的作用
兽医因其职业特点和专业技术背景,熟悉流行病学和动物习性及生物学特性,在实验动物的生产管理、疾病的预防和治疗、动物实验技术的推广与应用、动物福利监管和生物安全保障等工作中都可发挥着不可替代的重要作用[26]。实验动物机构应充分发挥兽医在动物检疫、动物健康监测、动物疫病应急处理中的主导作用。另外,社会对兽医职业风险的关注程度也需要提高。2010年美国国家公共卫生兽医协会制定了兽医工作者(动物密切接触者)人兽共患病预防纲要,即兽医标准预防措施(veterinary standard precautions,VSP),旨在降低兽医工作者的人兽共患病发生风险。建议我国也尽快制定实验动物兽医的病原微生物防控工作相关指南,提高执业兽医在设施管理和生物安全控制中的话语权,让他们能有足够的平台发挥专业技术优势,应对设施内可能出现的感染风险。
