MC38结肠癌小鼠肿瘤浸润免疫细胞的动态变化
2021-11-02张波扬陈焕鹏余文兰刘忠华黄朝峰
张波扬,陈焕鹏,余文兰,刘忠华,黄朝峰
(1.华南农业大学实验动物中心,广州510642;2.中山大学人类病毒研究所,广州510080)
异质性是恶性肿瘤的重要特征。目前,研究者多从肿瘤本身探索肿瘤的发生发展机制,如肿瘤干细胞理论、肿瘤遗传学等,因此肿瘤曾一致被认为是细胞内突变的体细胞遗传病[1]。近年来,肿瘤微环境免疫特征已经被列入肿瘤十大特征之一[2]。探索肿瘤微环境与肿瘤发生的关系既能预测临床预后,亦可评价放化疗效果[3-4]。随着单细胞测序和质谱流式细胞术等新技术的应用,多种新型免疫细胞亚群得到鉴定,肿瘤浸润免疫细胞成为了研究的热点之一。
肿瘤微环境主要是由免疫细胞、间充质细胞、内皮细胞和细胞外基质等构成复杂的细胞和分子调控网络,通过代谢重编程和低氧调控等方式促进肿瘤的发生和发展[5]。肿瘤微环境中的免疫细胞主要分为淋巴系来源和骨髓来源,淋巴系来源的主要有CD8+T细胞(cytotoxic T lymphocytes,CTLs)、CD4+T细胞(regulatory Tcells,Ths)、自然杀伤(natural killer,NK)细胞和树突状细胞(dendriticcells,DC),主要发挥抗肿瘤作用。髓系来源的主要是肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)和髓源抑制性细胞(myeloid-derived suppressor cells,MDSC),主要发挥免疫抑制作用。肿瘤与其微环境之间的相互作用非常复杂,免疫浸润成分在每个肿瘤阶段都发生了变化,特定的细胞对患者的生存影响深远。其中,T细胞一直是研究者关注的一个热点。多项研究表明,大多数T细胞密度随肿瘤进展而降低,T细胞的低密度浸润与不良预后相关[6-7],这也是患者生存最重要的预测标准[8-10]。过继T细胞治疗的新方法为患者带来了新的希望,但是肿瘤浸润免疫细胞是高度不均匀的。除了淋巴系来源细胞,大部分髓系成分同样具有代表性,然而分析Th1和CD8以外的免疫细胞如何影响临床效果时常常得出矛盾的结果[6]。
目前,肿瘤与宿主免疫系统之间的关系尚不明确。通过绘制动态免疫图谱的方式,为患者定制免疫特征图谱,可以识别动态生物标志物,区分假性治疗进展,明确具有潜在反应的患者,为个性化精准治疗提供动态监测方案[11]。本文采用流式细胞术对荷瘤小鼠不同时间节点的肿瘤浸润免疫细胞进行分析,动态观察结肠癌发展的细胞学变化,绘制免疫微环境的时空变化景观,以期为寻找预后生物标志物和开发新的治疗方法提供思路。
1 材料与方法
1.1 实验动物
SPF级雌性C57BL/6J小鼠24只,体质量为19~21 g,42~56日龄,来源于广东省医学实验动物中心[SCXK(粤)2018-0002],实验动物质量合格证号为44007200068714。动物饲养于华南农业大学实验动物中心屏障环境[SYXK(粤)2019-0136]。本研究涉及的动物实验方案符合3R原则,经华南农业大学动物福利与伦理委员会批准(批号2019D086)。
1.2 仪器设备和试剂
流式细胞仪(型号:BD-LSRF fortessa)购自美国BD公司,小鼠结肠癌MC38细胞株来源于美国典型培养物保藏中心。RPMI 1640(C11875500BT)购自美国Gibco公司。大鼠抗小鼠pecific blue-CD45(48-0451-82)、pecy7-CD3(25-0031-82)、percpcy5.5-CD4(45-0042-82)、APC-CD8(17-0081-83)、PE-NK1.1(12-5941-82)、pecy7-CD11b(25-0112-82)、APC-Ly6G
(17-9668-80)、PE-F4/80(12-4801-82)和pecy7-CD206(25-2061-82)单克隆抗体均购自美国eBioscience公司,FITC-Ly6C(553104)单克隆抗体购自美国BD公司,percpcy5.5-CD11c(65-0114-U100)和APC-MHCⅡ(20-5321-U100)单克隆抗体购自美国Tonbo Biosciences公司。PBS和D-PBS为实验室配制,胶原酶2(V900892)、胶原酶4(V900893)、DNA脱氧核糖核苷酸酶1(D4513)和透明质酸酶(H3884)购自美国Sigma公司。
1.3 实验动物处理
调整小鼠结肠癌MC38细胞密度为5×105个/mL,均于C57BL/6J小鼠右侧腹股沟处行一次性皮下注射(0.1 mL/只)。24只小鼠均可观察到肿瘤生长,在肉眼可观测肿瘤大小(大约荷瘤1周)后,每周观察一次并使用游标卡尺记录皮下肿瘤的长宽数值,肿瘤体积=长×宽2/2。每周记录一次小鼠体质量。每周随机选取6只小鼠,采用流式细胞术检测小鼠肿瘤内免疫细胞浸润水平。
1.4 肿瘤组织单细胞悬液的制备
采用脱颈椎法处死小鼠后,剥离肿瘤组织,冰浴10 min,用1×PBS洗2次,剪碎肿瘤,加入胶原酶2(1 mg/mL)、胶原酶4(1 mg/mL)、透明质酸酶(100 U/mL)和DNA脱氧核糖核苷酸酶1(100 U/mL),消化30 min。70μm筛网过滤肿瘤组织,1×PBS洗1次,终止消化。1×PBS洗1次,吸取10μL细胞悬液用1×PBS稀释10倍,用于细胞计数。
1.5 流式细胞术检测肿瘤内免疫细胞浸润水平
将单细胞悬液调整至细胞密度为1×107个/mL,每管吸取100μL细胞悬液准备流式染色。检测分3组,先用抗小鼠CD45抗体4℃避光孵育10 min,然后组1加入抗小鼠CD3、CD4、CD8、NK1.1抗体和相应的同型对照抗体,组2加入抗小鼠CD11b、Ly6C、Ly6G抗体和相应的同型对照抗体,组3直接加入抗小鼠CD11c、F4/80、CD206、MHCⅡ抗体和相应的同型对照抗体。4℃避光孵育30 min后,1×PBS洗1次,用于流式细胞仪检测。各免疫细胞分子标志定义如下:CD3+T细 胞(CD45+CD3+),CD4+T细 胞(CD45+CD3+CD4+),CD8+T细胞(CD45+CD3+CD8+),NK细胞(CD45+CD3-NK1.1+),DC(CD45+CD11c+),总的巨噬细胞(macrophage,后用Mφ表示)(CD45+F4/80+),Ⅰ型Mφ(CD45+F4/80+MHCⅡ+),Ⅱ型Mφ(CD45+F4/80+CD206+),MDSC(CD45+CD11b+),单核MDSC(M-MDSC)(CD45+CD11b+Ly6C+),粒 细 胞MDSC(G-MDSC)(CD45+CD11b+Ly6G+)。流式数据使用Flowjo-V10软件分析处理,单位体积浸润细胞数=各亚群细胞数/肿瘤体积。
1.6 统计学分析
实验数据使用GraphPad Prism 8.0.1软件进行分析。将荷瘤2~4周时的数据分别与荷瘤1周时的数据进行比较,所有计数资料以±s表示;组间比较采用方差分析,两组之间比较采用t检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 荷瘤小鼠肿瘤体积变化及肿瘤免疫细胞浸润变化
相比荷瘤1周,荷瘤2周和3周时的小鼠肿瘤体积均明显增大(P<0.05),荷瘤4周时显著增大(P<0.000 1),提示肿瘤体积迅速增长,增长速率不断加快(图1A)。记录荷瘤4周的6只小鼠体质量,结果显示在荷瘤1~4周时未见显著变化(图1B)。
从荷瘤1周时开始,每周随机选择6只小鼠剖检取材并进行流式检测。结果显示,CD45+细胞比例在荷瘤2周时较1周时明显降低(P<0.001),荷瘤3周时显著降低(P<0.000 1),荷瘤4周时虽明显降低(P<0.01),但略有回升趋势(图1C)。
为排除肿瘤大小差异对实验结果的影响,计算单位体积内浸润细胞数(各亚群细胞数/mm3)以比较单位体积肿瘤内的细胞学变化。结果显示,单位体积肿瘤内CD45+细胞浸润数在荷瘤2周时无明显变化(P>0.05),荷瘤3周时降低(P<0.05),荷瘤4周时显著降低(P<0.001)(图1D)。CD45是白细胞共同抗原的标志,在淋巴细胞的发育、功能调节及信号传递中具有重要意义,被广泛用作浸润免疫细胞的整体标志物。检测发现,荷瘤1~4周时CD45+细胞水平整体呈现骤降趋势,但在荷瘤3周后趋于稳定(图1D)。

图1肿瘤生长曲线与免疫细胞浸润变化Figure 1 Variations in tumor growth curves and immune cell infiltration
2.2 荷瘤小鼠肿瘤T细胞浸润变化
流式细胞术检测结果显示,相比荷瘤1周时,总CD3+T细胞比例在荷瘤2周下降(P<0.05),荷瘤3周时显著降低(P<0.000 1),荷瘤4周时有明显回升(P>0.05)(图2A);CD4+T细胞比例在荷瘤2~4周时均显著上升(P<0.000 1,图2B);CD8+T细胞比例在荷瘤2周及3周时显著下降(P<0.01),荷瘤4周时下降极显著(P<0.000 1)(图2C)。相比荷瘤1周时,单位体积肿瘤内总CD3+细胞浸润数在荷瘤2周时保持平稳(P>0.05),荷瘤3周和4周时均显著降低(P<0.01)(图2D);单位体积肿瘤内CD4+细胞浸润数在荷瘤2~4周时均显著上升(P<0.01,图2E);单位体积肿瘤内CD8+细胞浸润数在荷瘤2周时无明显变化(P>0.05),荷瘤3周及4周时均降低(P<0.05)(图2F)。
2.3 荷瘤小鼠肿瘤NK细胞与DC浸润变化
流式细胞术检测结果显示,相比荷瘤1周时,NK细胞比例在荷瘤2周及3周时无显著变化(P>0.05),荷瘤4周时下降(P<0.05),在荷瘤后总体呈现下降趋势(图3A);DC比例在荷瘤2周及3周时无显著变化(P>0.05),荷瘤4周时显著上升(P<0.01,图3B)。相比荷瘤1周时,单位体积肿瘤内NK细胞浸润数在荷瘤2周时无显著变化(P>0.05),荷瘤3周及4周时显著下降(P<0.000 1,图3C);单位体积肿瘤内DC浸润数在荷瘤后2周及3周时无明显变化(P>0.05),荷瘤4周时下降(P<0.05,图3D)。
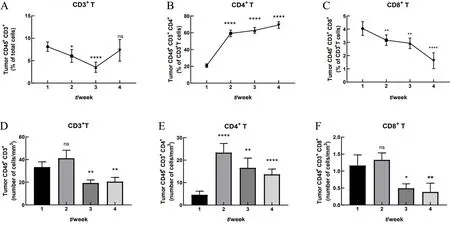
图2荷瘤小鼠肿瘤浸润T细胞变化Figure2 Variationsin theproportion of infiltrating T cellsin thetumor
2.4 荷瘤小鼠肿瘤相关巨噬细胞浸润变化
流式细胞术检测结果显示,相比荷瘤1周时,总的巨噬细胞(用Mφ表示)比例在荷瘤1周~4周后无显著变化(P>0.05,图4A);Ⅰ型Mφ比例在荷瘤1周到4周无显著变化(P>0.05,图4B);Ⅱ型Mφ比例在荷瘤2周及3周时无显著变化(P>0.05),但荷瘤4周时下降(P<0.05)(图4C)。相比荷瘤1周时,单位体积肿瘤内总Mφ浸润数在荷瘤2周时显著降低(P<0.05),荷瘤3周及4周时降低极显著(P<0.000 1)(图4D);单位体积肿瘤内Ⅰ型Mφ浸润数在荷瘤2周时无显著变化(P>0.05),荷瘤3周及4周时下降(P<0.05)(图4E);单位体积肿瘤内Ⅱ型Mφ浸润数在荷瘤2周及3周时无显著变化(P>0.05),荷瘤4周时下降(P<0.05)(图4F)。
2.5 荷瘤小鼠肿瘤髓源性抑制细胞浸润变化
流式细胞术检测结果显示,相比荷瘤1周时,CD11b+细胞比例在荷瘤后总体未呈现明显变化(P>0.05,图5A);M-MDSC比例在荷瘤2周和3周时无明显变化(P>0.05),荷瘤4周时明显上升(P<0.05),整体呈增长趋势(图5B);G-MDSC比例在荷瘤后2周及4周均明显下降(P<0.05),整体呈下降趋势(图5C)。相比荷瘤1周时,单位体积肿瘤内CD11b+及M-MDSC细胞浸润数在荷瘤1周到4周时无显著变化(P>0.05,图5D和5E);单位体积肿瘤内G-MDSC浸润数在荷瘤2周及3周时无明显变化(P>0.05),荷瘤4周时明显下降(P<0.05),总体呈下降趋势(图5F)。

图3荷瘤小鼠肿瘤浸润自然杀伤(NK)细胞和树突状细胞(DC)变化Figure 3 Variations of the infiltrating natural killer(NK)cells and dendritic cells(DCs)in the tumor
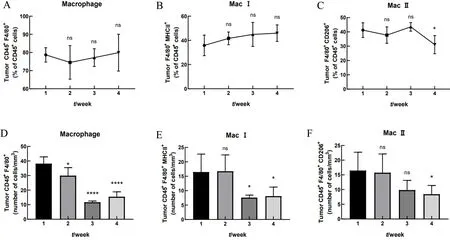
图4荷瘤小鼠肿瘤中浸润的巨噬细胞(Mφ)变化比较Figure4 Comparison of variationsin theproportion of infiltrating macrophages(Mφ)in thetumor
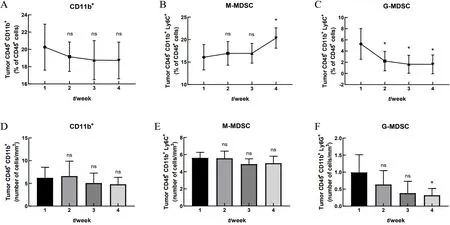
图5荷瘤小鼠肿瘤中浸润的髓源抑制性细胞(MDSC)变化比较Figure 5 Comparison of changes in the proportion of infiltrating myeloid-derived suppressor cells(MDSC)in the tumor
3 讨论
大多数肿瘤都有一个分步进展的过程,包括一系列组织学、形态学和遗传学的变化,这些变化随着时间的推移而改变或累积[12]。肿瘤微环境与肿瘤细胞之间复杂的相互作用贯穿了肿瘤发展全过程。目前,关于癌症免疫的研究主要集中在外周血、脾内或淋巴结,而对肿瘤内部免疫细胞浸润的复杂情形尚知之甚少。本研究检测几种具有代表性的免疫细胞浸润水平在结肠癌发展进程中的瘤内变化景观,旨在为结肠癌免疫学研究提供实验依据。
本实验数据显示,CD8+T细胞水平稳步下降至不可逆的水平,个别样本浸润细胞数极低,而CD4+T细胞比例在荷瘤早期就已迅速增长并持续累积,单位体积中浸润细胞数增长了近8倍。T细胞浸润水平在荷瘤1周及2周时有增长趋势,随后快速下降,这与CD4+T细胞的飞速增长保持一致,肿瘤浸润的T细胞几乎都是CD4+表型。已有研究表明,Th1细胞主要分泌白细胞介素(interleukin)-2、干扰素γ(interferon-γ,IFN-γ)等,通过干扰内皮细胞增殖来抑制肿瘤生长。Th2细胞主要分泌IL-4等,诱导TAMs产生M2表型,并通过分泌抗炎细胞因子激活体液免疫,促进肿瘤生长。而调节性T细胞(regulatory T cells,Tregs)通过直接表达抑制性细胞因子,或间接消耗IL-2,抑制CD8+T细胞的激活与增殖[13]。而肿瘤内的Th2细胞浸润水平往往远高于Th1细胞,即产生了Th1/Th2漂移的现象[14]。本研究结果支持CD4+T细胞在肿瘤进展中产生Th1/Th2漂移的假设,所产生的免疫抑制状态严重影响了CD8+T细胞和NK细胞的增殖和活化效率,并发现M-MDSC和CD4+T细胞的高水平浸润与CD8+T细胞和NK细胞水平的下降具有一定的相关性。另外,总T细胞比例在显著降低后出现反弹,这可能与NC细胞在荷瘤3周及4周的显著上升有关,这也体现了机体免疫在肿瘤发展整个过程中的顽强抗衡。然而尽管肿瘤体积飞速增长,单位体积浸润DC细胞数也没有表现出急剧下跌的趋势。曾有报告称,肿瘤相关树突状细胞(tumor-associated dendritic cells,TADC)在抗原提呈、诱导同种异体反应性和分泌IL-2等方面的能力均显著下降,其表面分子以及联合转运蛋白和抗原加工相关转运体的表达也明显降低,相反它们具有促进MDSC累积和促使髓系细胞分化为F4/80+TAM的作用[15]。事实上,大多数实体瘤都能通过产生IL-6、VEGF、CSF-1等细胞因子来抑制DC的分化和成熟,这种未成熟的TADC同样高表达CD11c,并在肿瘤内迅速累积,通过激活精氨酸酶1(arginase1,ARG1)和诱导型一氧化氮合成酶(inducible nitric oxide synthetase,iNOS),进一步加深免疫抑制作用。
TAMs是占比最大的肿瘤浸润免疫细胞,也是肿瘤进展、转移和抗治疗的关键驱动因素。本研究发现,总Mφ的细胞比例始终维持在较高水平。通常认为,M1型巨噬细胞高表达肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、主要组织相容性复合体Ⅱ(major histocompatibility complex-Ⅱ,MHCⅡ)分子等,发挥抗肿瘤作用;M2型巨噬细胞高表达ARG1和CD206等,发挥促肿瘤作用;然而肿瘤微环境中的Ⅰ型巨噬细胞往往可转变为Ⅱ型[16]。本研究结果中巨噬细胞浸润数整体下降,但Ⅰ型Mφ细胞数的下滑速度显著快于于Ⅱ型Mφ,未发现巨噬细胞的显著Ⅱ型漂移现象。实际上,TAMs完全不同于普通巨噬细胞,其具有抑制T细胞功能发挥、促进巨噬细胞和单核细胞分化以及促肿瘤血管生成的作用,从而形成了促肿瘤生长的旁分泌循环。
MDSC与免疫逃逸机制密切相关,可通过分泌炎性因子促进肿瘤细胞的存活和肿瘤血管生成,但由于其异质性和非成熟性,目前对该细胞群的定义一直存在争议[17]。本研究以CD11b+细胞标志肿瘤内浸润的MDSC,发现MDSC整体水平始终居高不下。于是本研究进一步分析GMDSC和M-MDSC的浸润水平,发现G-MDSC浸润水平稳步下降,这可能是肿瘤内的趋化因子CXC缺失引起。值得注意的是,M-MDSC的浸润水平稳定上升,且占比远高于G-MDSC。由于G-MDSC和M-MDSC抑制T细胞生长增殖的途径是相互独立的,笔者推测浸润的单核细胞和粒细胞主要是Ly6C+表型,M-MDSC可能是促瘤免疫和免疫逃逸的主角。
综上所述,笔者推测,癌细胞一旦接种于小鼠,机体迅速做出抗肿瘤和促肿瘤的免疫应答;肿瘤组织内免疫细胞浸润水平整体下降,CD8+T细胞和NK细胞水平的下降不断削弱机体抗肿瘤免疫效应。TADC和TAMs在促肿瘤免疫应答中发挥了重要作用,CD4+T细胞和M-MDSC可能是促肿瘤效应的关键点,促肿瘤免疫逐渐占据主导地位,从而促进结肠癌的发展。
