多囊卵巢综合征-胰岛素抵抗大鼠子宫组织中PPARs异常表达与胰岛素抵抗的关系
2021-11-02陈艺华张秀智冷义福尹天晓
魏 巍,陈艺华,张秀智,冷义福,李 纯,尹天晓
(1.大连大学附属中山医院生殖医学中心,大连116001;2.大连大学,大连116001)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种影响生殖和代谢的内分泌紊乱性疾病[1]。除了稀发排卵或无排卵、高雄激素等表现,PCOS患者常伴有胰岛素抵抗(insulin resistance),PCOS合并胰岛素抵抗的患者比例高达50%~70%[2]。PCOS患者排卵障碍和内分泌异常可影响子宫内膜正常的周期性变化,导致子宫内膜分泌反应不良,甚至表现为不同程度的增生,从而影响胚胎着床,导致妊娠率降低和流产率升高,患子宫内膜癌的风险增加[3-4]。应用胰岛素增敏剂是目前临床治疗PCOS-胰岛素抵抗的有效手段。过氧化物酶体增殖物激活受体(peroxisomal proliferator-activated receptors,PPARs)是胰岛素增敏剂噻唑烷二酮(thiazolidinedione,TZD)类药物的作用靶点,是一种核受体转录因子,包含3种亚型:PPARα、PPARβ、PPARγ。近年研究发现PPARs在人类生殖系统中表达,可调节卵泡的发生、排卵和黄体发育,参与胚胎发育及调节胎盘功能、维持妊娠等[5]。本文以PCOS-胰岛素抵抗大鼠模型为研究对象,探讨在子宫组织中PPARs异常表达与胰岛素抵抗之间的关系,为PPARs调节剂药物研发及安全有效地用于PCOS-胰岛素抵抗治疗提供理论基础和实验依据。
1 材料与方法
1.1 实验动物
选取SPF级6周龄雌性SD大鼠40只,体质量180~220 g,由大连医科大学动物中心[SCXK(辽)2013-0003]提供。每笼2只大鼠,于大连大学附属中山医院实验动物中心屏障环境[SYXK(辽)2018-0005]适应性饲养1周。室内安静,通风良好,温度为22~26℃,相对湿度为40%~70%,人工控制光照昼夜12 h/12 h,自由饮食,垫料1周更换2次。本研究通过大连大学附属中山医院实验动物福利伦理委员会审查(2019130),所有操作均符合实验动物伦理学要求。
1.2 主要试剂和仪器
人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)购自宁波人健药业集团股份有限公司;胰岛素注射液(商品名为诺和灵,规格10 mL:300 U)购自诺和诺德(中国)制药有限公司;ELISA试剂盒购自上海朗顿生物技术有限公司,罗氏活力型血糖仪购自德国罗氏诊断有限公司;免疫组织化学检测试剂盒购自北京中杉金桥生物技术有限公司;PPARα(兔单抗)、PPARβ(鼠单抗)、PPARγ(兔单抗)、胰岛素受体底物(insulin receptor substrate,IRS)(兔多抗)、葡萄糖转运蛋白4(glucose transporter 4,GLUT-4)(兔单抗)、胰岛素样生长因子-1(insulin like growth factor-1,IGF-1)(兔单抗)抗体购自北京博奥森生物技术有限公司,所有试剂盒的质控均符合要求。
1.3 动物分组及模型建立
40只雌性大鼠随机分为正常对照组和模型组,各20只。模型组采用胰岛素+hCG法造模[6]:于第1~21日颈背部皮下注射胰岛素2.0 U/d,生理盐水(即0.9%NaCl溶液)稀释至0.2 mL,每日1次。第11~21日,皮下注射hCG 3.0 U/d,每日2次,以5%葡萄糖溶液替代日常饮水。从用药第10日起,每日将大鼠进行阴道涂片检查,1%瑞特蓝染色后在显微镜下观察阴道脱落细胞形态。于实验第22天,大鼠失去动情周期超过7 d,且处死后显微镜下观察可见卵巢形态呈现多囊样改变,血睾酮及空腹胰岛素升高,即视为造模成功[6]。对照组大鼠每日皮下注射生理盐水0.2 mL,连续21 d。
1.4 标本采集
于实验第22天(禁饮食12 h后),全部大鼠经麻醉后称体质量。经大鼠尾静脉取血,用于检测空腹血糖。然后处死大鼠,于腹主动脉取血5~7 mL,离心后取上清液,-80℃冻存备用。取大鼠子宫组织,一部分用甲醛溶液固定,另一部分用于提取蛋白。
1.5 血清代谢指标检测
采用ELISA法测定空腹胰岛素水平,具体操作步骤按照ELISA试剂盒说明进行。然后结合空腹血糖值,计算稳态胰岛素评价指数(insulin resistance index,HOMA-IR)。HOMA-IR=空腹胰岛素×空腹血糖/22.5。
1.6 子宫组织相关检测
采用HE染色法观察大鼠子宫组织形态学变化,采用免疫组织化学法检测子宫组织中PPARs的表达,操作过程包括组织石蜡包埋、切片、脱蜡、抗原修复、血清封闭、免疫杂交及显色、脱水封固及ImagePro-Plus软件分析,具体操作按照试剂盒说明书进行。以平均吸光度值之比表示目的蛋白的相对表达水平。采用蛋白质印迹法检测PPARs、IRS、GLUT-4、IGF-1蛋白表达水平,以β-Actin为内参,操作过程包括蛋白质样品制备-蛋白质定量-SDS-PAGE电泳-转膜-免疫杂交反应及显影-凝胶成像分析系统,具体步骤参考试剂盒说明书。
1.7 统计学方法
2 结果
2.1 ELISA结果
与正常对照组相比,模型组大鼠空腹血清中胰岛素含量和稳态胰岛素评价指数均明显增高(P<0.05),而空腹血糖含量在两组间差异无统计学意义(P>0.05,表1)。
表1大鼠空腹胰岛素、空腹血糖及稳态胰岛素评价指数比较Table 1 Comparison of serum fasting insulin and fasting plasma glucose levels and insulin resistance index in rats(± s)

表1大鼠空腹胰岛素、空腹血糖及稳态胰岛素评价指数比较Table 1 Comparison of serum fasting insulin and fasting plasma glucose levels and insulin resistance index in rats(± s)
注:正常对照组注射等量生理盐水;模型组注射胰岛素+人绒毛膜促性腺激素,建立多囊卵巢综合征-胰岛素抵抗模型。
组别正常对照组模型组P值n 20 20空腹胰岛素/(mU·L-1)27.58±0.92 48.19±1.24 0.001空腹血糖/(mmol·L-1)4.05±0.12 4.22±0.25 0.100稳态胰岛素评价指数4.92±0.36 9.04±0.73 0.001
2.2 HE染色结果
正常对照组大鼠的子宫内膜腺腔大、腺体多且呈簇状排列;模型组大鼠的子宫内膜出现不同程度的增生性改变,腺腔变小,腺体数目减少,且排列松散(图1)。
2.3 免疫组织化学结果
PPARα、PPARβ及PPARγ3种亚型在大鼠子宫组织中均有表达。模型组大鼠PPARα、PPARγ在子宫组织中表达下调,与正常对照组大鼠相比的差异有统计学意义(P<0.05);PPARβ在两组之间的表达差异无统计学意义(P>0.05,图1,表2)。

图1 HE染色(×100)和免疫组织化学染色法(×200)分别检测大鼠子宫组织形态及PPAR蛋白表达情况Figure 1 HE staining(×100)and immunohistochemistry staining of rat uterine tissues(×200)
2.4 蛋白质印迹结果
模型组大鼠子宫组织中PPARα、PPARγ、IRS和GLUT-4表达下调,IGF-1表达上调,与正常对照组大鼠比较差异有统计学意义(P<0.05)。PPARβ的表达在两组之间无显著差异(P>0.05,图2)。
表2大鼠子宫组织过氧化物酶体增殖物激活受体(PPAR)平均吸光度值比较Table 2 Comparison of average absorbance value of peroxisome proliferators-activated receptors(PPAR)in rat uterinetissues(±s)

表2大鼠子宫组织过氧化物酶体增殖物激活受体(PPAR)平均吸光度值比较Table 2 Comparison of average absorbance value of peroxisome proliferators-activated receptors(PPAR)in rat uterinetissues(±s)
注:PPARα、PPARβ及PPARγ分别为过氧化物酶体增殖物激活受体的3种亚型。
组别正常对照组模型组P值n 20 20 PPARα 60.05±0.92 45.55±1.09 0.001 PPARβ 45.58±1.02 44.78±1.47 0.180 PPARγ 63.40±1.21 47.20±0.58 0.001
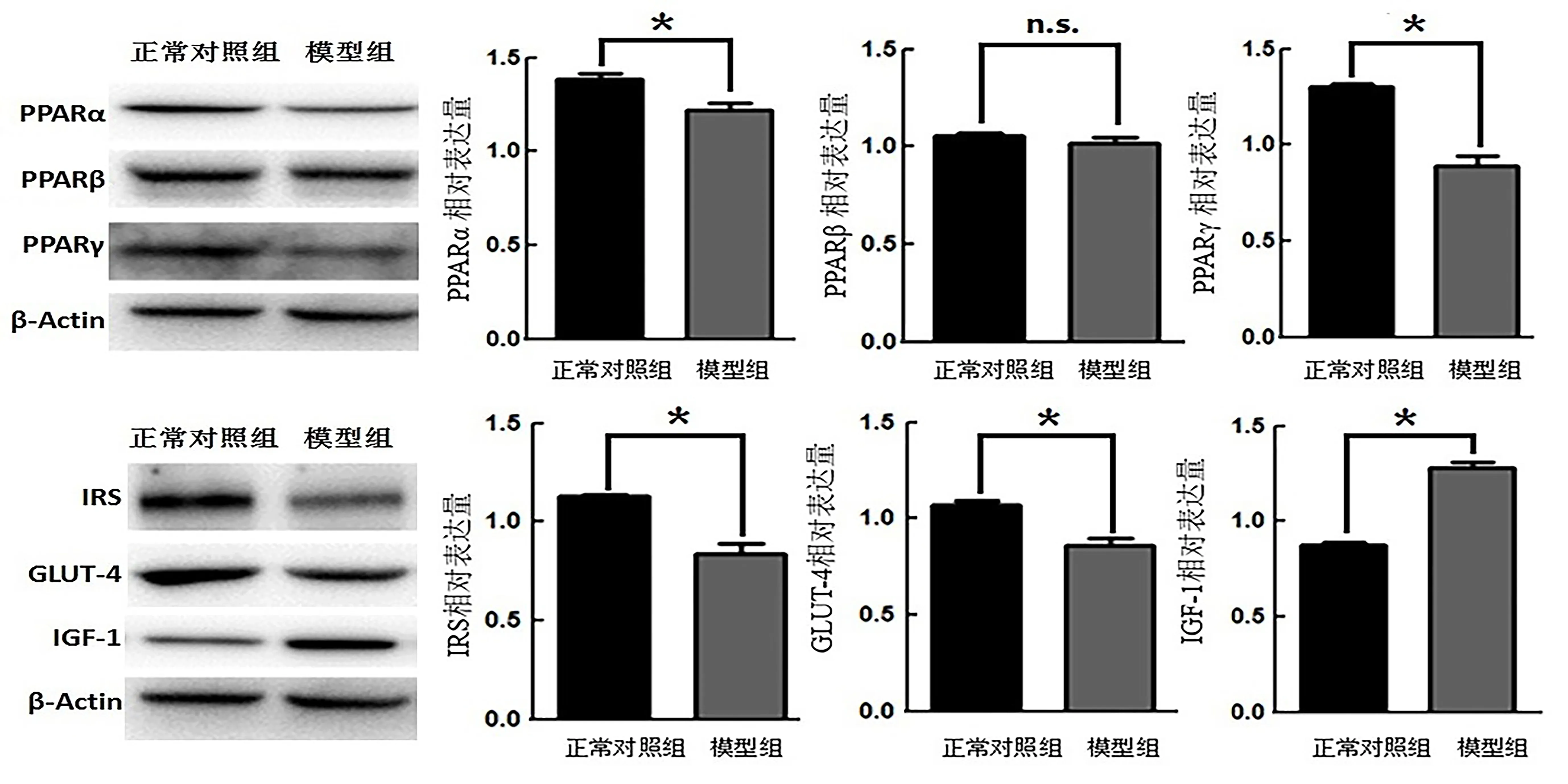
图2蛋白质印迹法检测大鼠子宫内膜组织中各蛋白相对表达Figure2 Comparison of relativeexpression of variousproteinsin rat uterinetissues
3 讨论
临床上针对PCOS以药物治疗为主,很少采用外科手术治疗,故PCOS患者的卵巢、子宫等组织取材比较困难,因此选用一种能准确反映PCOS病理生理特征的动物模型对于PCOS相关研究至关重要。目前,国内外建立PCOS-胰岛素抵抗动物模型的主要方法有:雄激素造模法、雌激素造模法、胰岛素联合hCG造模法、来曲唑造模法、孕激素联合hCG造模法、脱氢表雄酮联合胰岛素造模法、雄激素联合hCG造模法等[6-10]。以上这些造模方法大多采用人源性激素诱导,但原理不尽相同,各有优缺点[7-8]。其中胰岛素+hCG造模法(Poretsky造模法)是一种经典的造模方法。Poretsky等[9]和李轶等[10]均通过该方法成功诱导出PCOS-胰岛素抵抗动物模型,该模型具有卵巢多囊样改变、高雄激素血症、胰岛素抵抗、糖脂代谢异常等特点。本实验小组在前期研究中也发现该造模法为优选的PCOS-胰岛素抵抗造模方法[6],能很好模拟出PCOS的病理生理特点,动物模型与PCOS患者临床表现的吻合率比较好,且该方法造模成功率可达90%以上。故本研究采用胰岛素+hCG造模法诱导PCOS-胰岛素抵抗大鼠模型。
本研究中,模型组大鼠失去明显的动情周期,表现糖代谢异常;ELISA结果表明,模型组与对照组相比,大鼠血清中空腹胰岛素和稳态胰岛素评价指数均增高(P<0.05),说明模型组大鼠外周血存在胰岛素抵抗;HE染色显示,模型组大鼠子宫内膜腺体数目减少,为单个腺体松散排列,腺腔小而直;蛋白质印迹结果表明,模型组大鼠子宫组织中IRS、GLUT-4表达下调,而IGF-1表达上调,提示模型组大鼠在外周血及子宫组织存在胰岛素抵抗。
胰岛素抵抗是指外周组织对胰岛素的敏感性降低,对糖代谢的调节作用减弱,胰岛素代偿性分泌增加,形成高胰岛素血症。目前认为,胰岛素抵抗是PCOS主要的病理表现和发病机制,机体发生胰岛素抵抗后导致PCOS发生的主要原因包括,继发高胰岛素血症导致卵巢功能障碍、抑制排卵、雄激素分泌增加、引发高雄激素血症等[11]。而高雄激素血症是PCOS的特征性临床表现之一。PCOS患者的高雄激素血症与高胰岛素血症存在相互作用[12],高雄激素血症又可直接和间接诱导机体胰岛素抵抗[13]。本研究证实,PCOS-胰岛素抵抗大鼠的子宫组织存在胰岛素抵抗。Chang等[14]发现,胰岛素抵抗患者的着床率和临床妊娠率比非胰岛素抵抗患者低。另有研究表明,胰岛素抵抗及高胰岛素血症可促进子宫内膜增生及癌变,增加了非妊娠女性患子宫内膜癌的风险[15]。
应用胰岛素增敏剂改善胰岛素抵抗对PCOS患者的治疗效果明确[16-17]。胰岛素增敏剂可以调节糖脂代谢,降低高胰岛素水平,减少血清雄激素水平,并可促进正常卵泡的发育和成熟卵子的排出,改善子宫内膜容受性,增加妊娠率,降低自然流产发生率,从而改善PCOS患者的生殖功能[18-19]。
PPARs是一类由配体激活的核转录因子,属于核受体超家族,目前有3种亚型:PPARα、PPARβ、PPARγ[19]。PPARs是胰岛素增敏剂的作用靶点,在维持机体正常的生理功能中起重要作用,包括生长发育、新陈代谢、细胞分化等,与癌症、不育、肥胖、糖尿病等疾病的发生有关[20-21]。PPARs主要是通过与配体结合活化后,激活下游基因的转录水平,调节能量平衡和卵巢功能,包括卵母细胞成熟、排卵、黄体形成等[22]。
PPARs与生殖的关系密切。在卵巢层面,PPARα和PPARγ通过调控一些蛋白酶来参与排卵及黄体形成[19],而关于PPARβ在卵巢组织中的功能研究还尚无报告。PPARγ在动物及人类卵巢颗粒细胞、卵细胞中均有表达,参与性激素生成、卵巢各种细胞的分化和增殖[23]。有研究发现,PPARγ激动剂罗格列酮在饮食诱导的大鼠模型中可以明显提高卵巢功能[24]。另有实验发现,在小鼠卵巢组织中敲除PPARγ会导致生育能力下降[25]。在子宫层面,有研究发现将大鼠PPARα敲除,大鼠流产率明显增加[26];缺乏PPARβ的大鼠的胎盘发育出现缺陷[27];PPARγ在大鼠及人类胎盘中均有表达[28-29];PPARγ失活将导致胚胎滋养细胞分化缺陷、早期胚胎死亡,以及严重的胎盘发育损伤[30]。
此外,PPARs的异常表达与PCOS发病密切相关。有研究发现,PPARγ在PCOS大鼠脂肪组织基质细胞上的表达强度明显降低[31]。另有报道,PPARγ基因Pro12Ala多态性可能是PCOS多种发病机制中的重要因素之一,等位基因Ala的存在与胰岛素敏感性增高及PCOS-胰岛素抵抗减弱密切相关[32]。
本研究结果证实,PPARα、PPARβ及PPARγ在大鼠子宫组织中均有表达;免疫组织化学及蛋白质印迹结果一致,均显示模型组的PPARα、PPARγ表达水平均低于对照组,PPARβ表达与对照组无明显差异,说明PCOS大鼠子宫内膜中PPARα、PPARγ呈现低表达,其与胰岛素抵抗有一定的联系。之前也有研究发现,PCOS患者卵巢颗粒细胞中PPARγmRNA的表达水平明显低于正常人组[33],这与本研究结果相吻合。
在PPARs的3种亚型中,目前有关PPARγ的报告最多。PPARγ是胰岛素增敏剂噻唑烷二酮类药物的作用靶点,可通过激活胰岛素受体亚单位上的酪氨酸激酶,使酪氨酸磷酸化,从而改善胰岛素抵抗,降低血糖及胰岛素水平,提高PCOS患者的排卵率及妊娠率[34]。但长期服用PPARγ激动剂可引起肥胖、水肿,并增加罹患心肌梗死的风险,同时还会产生肝毒性等不良反应,因此不能大量及长期服用[35]。PPARα是贝特类药物的作用靶点,主要是通过调控脂肪酸代谢相关基因来调节脂类代谢,还能改善免疫应答,调节炎性反应,改善胰岛素的耐受性[36];此外,长期应用贝特类降血脂药物会增加患胆结石的风险,引起肌肉毒性等[37]。另有研究表明,PPARβ激动剂通过上调PPARγ辅激活子1α表达,增强线粒体β氧化和能量代谢能力,从而改善胰岛素敏感性[38]。本研究中并未发现PPARβ与胰岛素抵抗的确切关系。
综上所述,本研究发现在PCOS-胰岛素抵抗大鼠子宫组织中IRS、GLUT-4表达下调,而IGF-1表达上调,证实在子宫组织层面存在胰岛素抵抗,其机制可能与PCOS大鼠子宫组织PPARα、PPARγ表达下调相关。并且本研究证实,在子宫层面上不仅有PPARγ的表达,也有PPARα和PPARβ表达。已知PPARs单靶点药物存在缺陷,而PPARα/PPARγ双激动剂或PPARα/PPARβ/PPARγ泛调节剂的治疗效果好,弊端少,是后续进行胰岛素增敏剂开发的热点之一,也是未来治疗PCOS和胰岛素抵抗药物研究的一个重要方向。目前本研究小组相关的临床研究正在进行中,期待后续研究结果能为PPARs在PCOS-胰岛素抵抗疾病诊疗领域提供新的思路。
