瘦素与女性青春期发育关系的研究进展
2021-11-02郭羽佳周润雪魏莹
郭羽佳,周润雪,魏莹
(天津医科大学总医院儿科,天津 300052)
0 引言
瘦素(leptin)是16KDa(千道尔顿)的多肽,由167个氨基酸组成,主要来自脂肪组织,胃肠道粘膜、乳腺上皮细胞、胎盘、腺垂体、肌细胞、人精子、卵巢、淋巴组织、骨髓亦可少量分泌[1]。除影响下丘脑-垂体-生长激素轴、软骨生长、骨代谢、免疫、炎症和生殖功能[1],leptin亦是激活下丘脑-垂体-性腺轴(hypothalamus-pituitary-gonadal axis,HPG)的关键因子[1]。
青春期是性发育成熟的时期,亦是生殖功能的储备时期。GnRH神经元激活,下丘脑-垂体-性腺轴启动,青春期发育便开始,以女孩乳腺发育、男孩睾丸容积增大为首发表现。生后6-8周,有些婴儿进入“小青春期”,因源于母体的雌激素中断,性激素对下丘脑和垂体的负反馈抑制作用解除,HPG轴短暂激活。青春期前,性激素水平仍较低,负反馈抑制作用弱,GnRH神经元活动主要受中枢神经系统的抑制[2]。关于如何激活GnRH神经元启动青春期发育,目前存在诸多观点。
一项对中国青少年儿童性发育现状的调查表明肥胖加速青春期启动,甚至导致性早熟[3]。肥胖儿童的BMI、体脂含量及leptin较同龄正常体重儿童高,推测较高的leptin是青春期过早启动的原因之一。本文将围绕leptin在中枢(下丘脑-垂体)的信号传递及对外周组织(性腺、骨)的影响展开论述,描述其与青春期启动及对女性青春期发育的影响。
1 Leptin激活下丘脑-垂体启动青春期发育
Leptin与GnRH神经元上游的神经元交流,通过信号通路或经突触接触激活GnRH神经元,影响下丘脑-垂体轴的功能[4]。(1)Kiss1神经元介导leptin对GnRH神经元的作用。Iijima等人的研究表明超过90%的GnRH神经元上共表达kisspeptin内源性受体kiss1R;另外,超过40%的kiss1神经元上有编码功能性leptin受体 mRNA(LEPRmRNA)表达,提示kisspeptin-kiss1R可能直接参与leptin-LEPR对GnRH神经元的调控[5]。(2)下丘脑乳头体前腹侧核(premammillary nucleus, PMV)上有丰富的LEPR表达,可与leptin结合产生信号传递;且PMV可通过突触与GnRH神经元直接联系,或与kisspeptin协同激活GnRH神经元。(3)Leptin使神经肽Y(neuropeptide Y, NPY)和Agouti相 关 蛋 白(agouti-related protein,AgRP)分泌减少,解除了二者对GnRH神经元的抑制[1]。
此外,leptin可对促性腺细胞上促性腺激素释放激素受体基因(Gnrhr mRNA)进行转录后调控。Leptin受体特异性缺乏(LEPR-null)的促性腺细胞中Musashi(MSI)表达增加,后者是保守的RNA结合蛋白,可以与Gnrhr mRNA的3’-UTR末端结合抑制其翻译;Leptin可抑制MSI从而使GnRHR蛋白表达增加,解除MSI对Gnrhr mRNA翻译的抑制,减轻其对HPG轴的抑制作用[6-7](图1)。
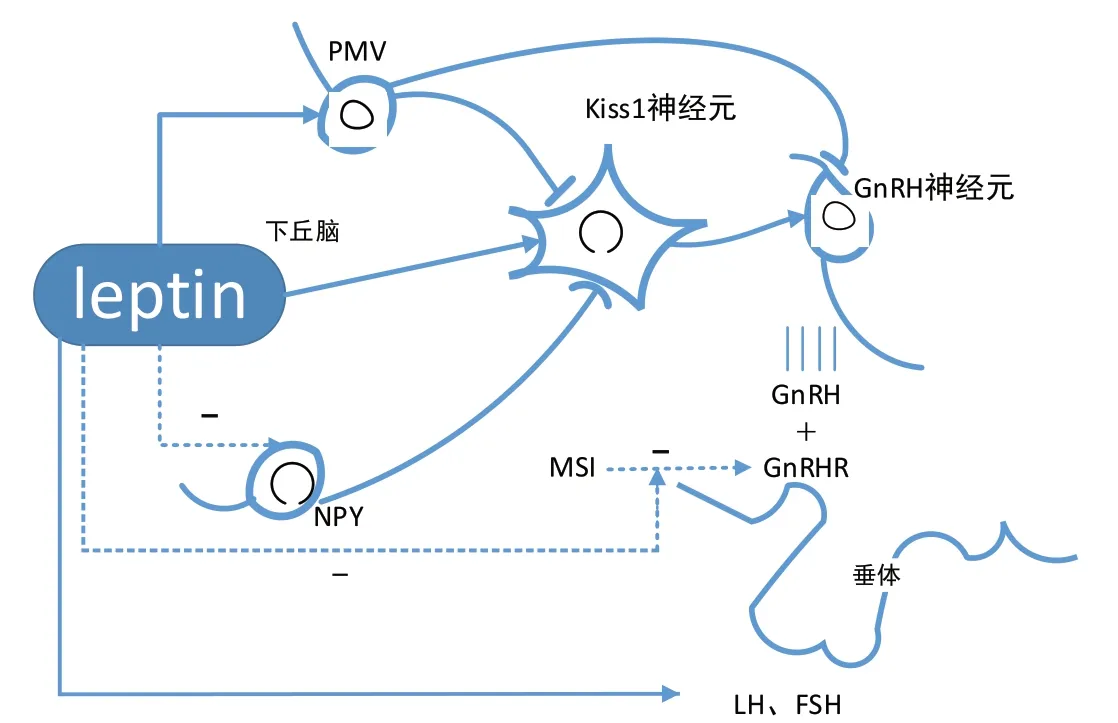
图1 Leptin在下丘脑内信号传递(虚线代表抑制性信号)
除了经下丘脑-垂体信号通路激活GnRH神经元,leptin浓度过高或过低都会影响青春期启动,甚至影响性腺功能。
Leptin基因缺陷小鼠(ob/obmouse)的leptin水平明显降低,出现不育、性器官萎缩,注射外源性重组leptin后生殖器官的生长和功能恢复正常;在人群中,leptin降低同样会导致性腺功能低下、青春期发育受抑制[8]。有研究示leptin浓度为10-12-10-10mol/L时促进 GnRH分泌,当浓度升至10-8mol/L时,促分泌效应消失,表明leptin对GnRH分泌的刺激需要维持合适的浓度范围[9]。肥胖儿童虽然存在高瘦素血症,但中枢神经系统内存在leptin抵抗,同样无法保证正常的青春期进展[10-11],有些肥胖儿童会出现性腺功能低下。总之,GnRH神经元的激活需要leptin突破某一阈值,浓度过高或过低都会阻碍青春期进程,甚至影响生殖功能。机体应保持适当的能量供应,以保证leptin处于合适的浓度范围。但引发青春期启动又不会带来负面效应的leptin范围目前仍无具体界值。大多研究表明leptin与BMI呈正相关,是否可认为控制BMI于合适范围即代表维持leptin于适当的浓度,需要日后进一步的实验证明。
GnRH神经元激活后促进垂体分泌FSH、LH。与我们通常认知的leptin激活下丘脑-垂体通路致FSH、LH同步分泌不同,在探究leptin是否直接作用于腺垂体影响FSH、LH分泌的动物实验中,注射外源leptin导致LH分泌增加,对FSH分泌无影响[12]。此外,FSH、LH对性腺的作用时间点不同:LH促进男童Leydig细胞分泌睾酮(T),在女性排卵时才发挥作用;FSH在女童促进卵泡形成和雌激素分泌,在男性直到遗精才发挥作用[13]。青春期前,leptin水平随年龄和体脂含量增长缓慢升高;进入青春期,女童体内leptin水平受雌激素(E2)影响不断升高,但男童leptin水平却降低,可能与体内睾酮水平升高对其产生抑制作用相关[10]。提示leptin的变化趋势存在性别差异,leptin与E2正相关,与高水平T负相关。
当青春期启动,FSH、LH、E2等激素水平均明显升高。当基础LH≥5.0U/L,可确定性腺轴启动;当基础值无法判断,行GnRH激发试验后出现LH≥5.0U/L和LH峰值/FSH峰值≥0.6,可诊断中枢性性早熟[14]。至此,我们尚无法确定动物实验中出现的leptin激活垂体功能后FSH、LH升高程度不一致在人群中是否同样存在,LHmax/FSHmax比值是否稳定、其与leptin水平是否相关,这些问题都有待进一步考证。leptin与性激素水平相关,leptin逐渐升高贯穿女童整个青春期,仅在男童青春期前期保持趋势一致。考虑是否受性激素影响,leptin会加速女童青春期后期发育进程,缩短男童从青春期启动至加速期的时间,继而影响青春期发育带来的体格发育第二高峰。判断对青春期总进展时间的影响需要长期随访追踪。
2 Leptin对子宫、卵巢、乳腺的影响
Leptin还可作用于外周组织,促进子宫、卵巢、乳腺的发育,调控性腺及生殖系统的功能。
Wen等人认为子宫内膜厚度改变对区分性早熟儿童和正常同龄儿童具有较高特异性[15]。在日常临床工作中辅助超声检查性早熟女童子宫的发育程度,子宫内膜的厚度受性激素的影响,随性发育分期进展逐渐增厚,正常女童或已使用促性腺激素释放激素类似物(GnRHa)抑制性发育的女童,子宫内膜通常显示不清或不显示,验证了Wen的结果。早期 RUBE'N RENE'GONZA'LEZ等 人 首 次 描 述 了leptin及LEPRb(leptin的长型受体)在成年女性的分泌期子宫内膜上皮和体外培养的子宫内膜上皮细胞中表达。子宫内膜不仅可以局部合成分泌leptin,以自分泌或旁分泌的形式发挥作用,也是循环中leptin作用的靶点[16]。因前述实验是以成年女性子宫内膜为标本证实存在leptin和LEPRb,二者是否从青春期启动前就在女童子宫上表达,是否直接结合促进子宫内膜成熟,有无中间转导通路等问题仍需加以探究。
除FSH、LH影响卵巢的发育及功能,leptin同样可以调节卵巢类固醇激素的合成及卵泡发育,反之,雌孕激素协同正反馈促进leptin分泌[17]。卵巢分泌的leptin是血液循环中不可忽略的一部分,它由卵巢组织旁分泌产生而非直接源自脂肪组织,明确的机制及leptin在卵巢中的信号传递尚不清[17]。此外,前述leptin对GnRH神经元的作用依赖信号传递和合适的浓度,leptin浓度过高同样可以影响卵巢功能。胰岛素样生长因子-1(insulin-like growth factor-1, IGF-1)本可协同FSH促进卵泡发育,当leptin浓度高于10 ng/mL时可抑制IGF-1的协同作用,并直接抑制FSH促卵泡发育的作用及对促性腺激素的应答[18]。
林叶等人[19]的实验表明小鼠乳腺上皮细胞系中存在leptin及LEPRb,二者在乳腺中表达部位相似,LEPRb是leptin的专一性配体,leptin对LEPRb表达有正向诱导作用。在青春期,leptin主要出现于乳腺脂肪细胞、导管上皮细胞及围绕导管的基膜,与LEPRb结合后调控乳腺上皮细胞生长、凋亡。据此推断乳腺局部过多的脂肪组织产生的leptin可作用于局部LEPRb受体促进乳腺发育。肥胖儿童青春期发育前,乳腺中实体组织占比少,乳房由大量脂肪垫填充。对此类儿童应注意区分脂肪堆积和真正乳腺发育。
以上我们谈到了leptin对子宫、卵巢、乳腺的作用,主要是与受体结合后促进组织发育及功能成熟。根据临床经验,子宫、卵巢、乳腺在性早熟女童中变化明显,如超声检查显示子宫内膜清晰且厚度增加,子宫长径增加;卵巢容积增大,其中大于4mm的卵泡数个;触诊于乳晕下方可及乳腺腺体结节,超声提示乳核提示乳腺发育。青春期亦是生殖功能的储备时期,脏器的正常结构及内部完整的信号传递通路是正常生理功能的基础。同时leptin作为调节机体能量代谢的信号,可将机体能量储备充足的信号传至中枢,继而完成对GnRH神经元的激活,启动青春期发育;也可直接作用于子宫、卵巢、乳腺在下游水平促进青春期发育。
3 Leptin影响骨骼生长
青春期是生长发育的第二高峰。青春期身高突增主要因性激素、生长激素(GH)、IGF-1共同作用[20]。Leptin同样是骨骼生长因子,进入青春期前leptin升高刺激骨骺生长中心IGF-1R基因表达和富集,诱导骨骺生长板软骨细胞增生和分化[20]。除了通过IGF-1R促进骨骼生长,MajdiMasarwi等人首次描述了leptin调节芳香化酶的表达影响生长板软骨细胞的发育。Leptin与LEPRb结合,激活MAPK、STAT3、PI3K信号传导通路使下游ERK1/2磷酸化,诱导芳香化酶的表达,睾酮经芳香化酶的作用转化为雌激素的量增加,加速生长板软骨细胞的衰老,导致生长板高度降低[21]。雌激素对骨骼的作用无性别差异。Leptin中枢性抵抗使下丘脑与生长板等组织对leptin的敏感度不同,因此肥胖儿童虽在青春期前表现生长加速,身高高于同龄儿童,但较早进入青春期,丧失了骨骼发育潜力,终导致矮身材[21]。
综上,leptin刺激骨骺IGF-1R的表达并协同GH/IGF-1轴促进机体生长,亦可通过LEPR信号通路影响生长板的发育。leptin对骨发育的正向作用亦依赖合适的浓度,肥胖儿童体内的高leptin、高雌激素水平会影响骨骼的生长潜力,机体线性生长速率较青春期前降低,骨骺提前闭合,难以达到理想成年身高,可能在性早熟儿童中表现更加明显。
4 Leptin与LEPR及信号传导
Leptin受体(LEPR)属于I类细胞因子家族,分为3种类型:长型(LEPRb)、可溶型(LEPRe)、短型(LEPRa、LEPRc、LEPRd、LEPRf)。除了LEPRe,余均由胞外结合域、跨膜区及胞内结合域组成。它们的分布及作用各异:短型受体主要分布于脑、肺等组织,如LEPRa、LEPRc主要协助leptin穿透细胞屏障;LEPRe是血液循环中主要的leptin结合蛋白,调控leptin生物学活性;LEPRb在下丘脑高度表达,是发挥信号传导作用的主要受体,与leptin结合后激活JAK激酶2(Janus kinase 2,JAK2),使LEPR胞内的酪氨酸残基(Tyr985、Tyr1077、Tyr1138)磷酸化,后者招募胞浆内下游的信号适配器,激活不同的信号通路:JAK-STAT、IRS1/2-PI3K-Akt、SHP2-ERK等,信号通路也处于SOCS3等负向调控因子和SH2B1的正向调控中[22-23]。在leptin突变(ob/ob)、LEPR基因突变(db/db)或LEPR信号传导异常的病例中,会出现饮食过度、病态肥胖、无青春期生长高峰、无第二性征发育等表现[24]。总之,正常的信号传导通路是leptin发挥生物学效应的分子结构基础。
5 总结
本文论述了leptin对女性青春期启动及在青春期发育中的作用,正常的信号传导通路与正常的浓度范围是其发挥生物学效应的关键。Leptin可从下丘脑、垂体等中枢水平进行调控,同时影响子宫、卵巢、乳腺、骨等外周组织的成熟及功能。目前对leptin在中枢的信号传递的研究不断出现新进展,对外周组织的影响机制还需深入研究。Leptin水平异常不仅导致能量代谢失衡,同时影响青春期进展和未来的生殖功能。如今儿童肥胖是全球重大的公共健康问题,肥胖引起leptin升高促使儿童更早进入青春期,削弱生长潜力。作为肥胖基因(ob gene)的产物,leptin是导致青春期过早启动及影响进展的重要神经内分泌因子。维持leptin在何种浓度范围,避免对青春期进程产生不良影响,及leptin与女性青春期发育之间的关系仍有待进一步探究。
