SBPase基因超表达对烟草生长的影响
2021-11-02韩平安孙瑞芬唐宽刚梁亚晖聂利珍吴新荣李晓东
韩平安,孙瑞芬,唐宽刚,常 悦,梁亚晖,聂利珍,吴新荣,李晓东
全球气候变暖、自然灾害频发导致农作物产量降低,已严重威胁人类的生存。针对这一问题,科研工作者发现通过调节植物的光合作用增加农作物产量是确保粮食安全的有效途径[1-2]。绿色植物中卡尔文循环是光合作用的第一个途径,它将大气中的二氧化碳吸收为有机化合物的骨架,是有机大分子的前体,是植物生长发育的基础[3-4]。景天庚酮糖-1,7-二磷酸酶(SBPase)是植物光合作用卡尔文循环过程中的关键酶,SBPase 催化的反应位于卡尔文循环中同化阶段和再生阶段的分支点,对于控制该循环过程中碳源的流通具有十分重要的意义[5]。
核酮糖-1,5-二磷酸(RuBP)是光合碳固定的关键酶。研究发现,烟草中SBPase 减少,CO2受体分子RuBP 再生能力呈线性减少[6];杨树SBPase 活性提高,CO2受体分子RuBP 再生能力呈线性增加[7];转基因番茄的光合速率和抗寒性随着SBPase 活性的增强而提高[8];水稻的SBPase 3′端单核苷酸替换严重影响了植物的生长和产量[9]。研究证实,SBPase 是光合作用中RuBP 形成及维持碳循环平衡的关键酶[10-11]。LEFEBVRE 等[12]研究发现,在烟草中过表达SBPase 基因,酶含量和碳固定呈线性表达关系。因此,SBPase 基因具有调节RuBP 再生与促进碳化合物形成的作用,从而促进植物生长发育[7]。SBPase 基因的超表达研究对探索植物生长具有重要意义。
研究证实,通过对SBPase 基因功能的调节具有提高光合性能的作用,植物光合作用的主要生理活动是在绿色组织中完成的,大量相关基因的表达具有很强的组织特异性[12]。启动子包含基因表达的核心调控信息,决定了基因转录的起始、效率及时空特异性。应用合适的启动子准确控制相关基因在植物体内的表达强度和部位,不仅可能增加同化产物的积累,还可避免可能带来的植物代谢紊乱[13]。本研究采用甜菜分子育种课题组前期构建的拟南芥RBCS 启动子驱动SBPase 基因的植物表达载体,通过在烟草中过量表达SBPase,探究SBPase 基因对烟草农艺性状与光合特性的影响,以期为加强SBPase 基因在作物高产育种上的利用提供理论依据。
1 材料和方法
1.1 试验材料
本氏烟草(Nicotiana benthamiana)无菌苗,载体[pBWA(V)K-AtRBCS-SBPase]由甜菜分子育种课题组前期构建保存,启动子为RBCS 启动子,载体筛选基因为新霉素磷酸转移酶基因(NPTII),启动子为35S。通过Primer premier 5.0 设计SBPase 基因的特异引物,RNR2 检测引物参照王盛等[14]的方法。引物由南京市金斯瑞公司合成,引物序列见表1。
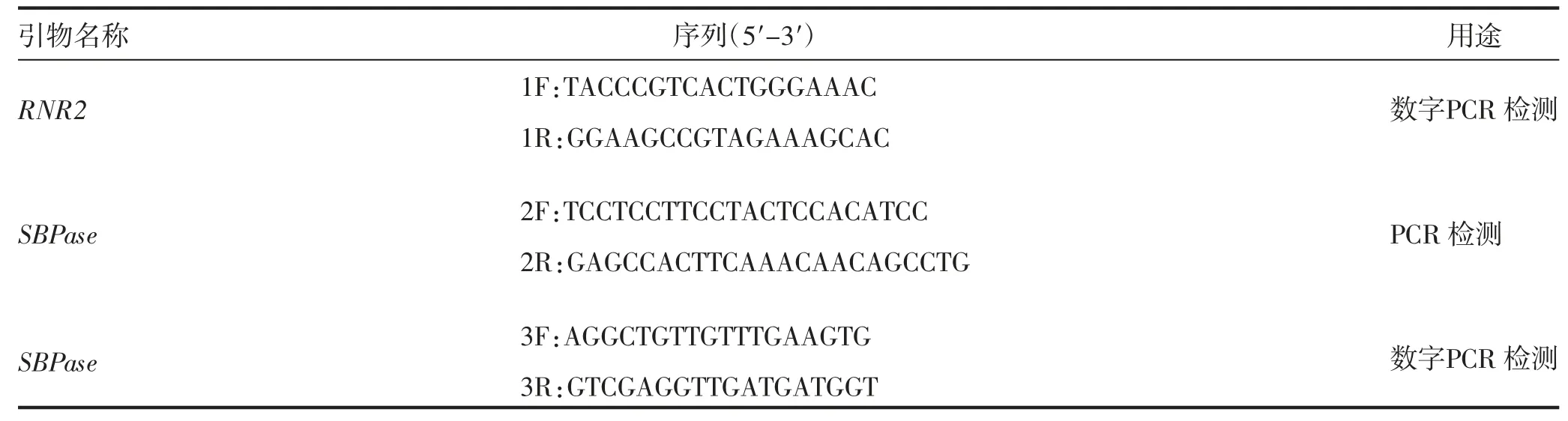
表1 引物信息
1.2 烟草的遗传转化
剪取烟草无菌苗幼叶,切成1 cm×1 cm 的小叶盘,并在每个叶盘上制造伤口,切取100 个叶盘备用。将切好的叶盘转入灭菌的小烧杯,加入活化的农杆菌EHA105 菌液(菌液浓度OD 值为0.5~0.6),避光条件下侵染10 min。将侵染后的叶盘放在灭菌滤纸上吸去多余菌液并迅速将其转入共培养培养基(MS 4.4 g/L、蔗糖30.0 g/L、6-BA 1.0 mg/L、琼脂7.0 g/L,pH 值为5.8)上,25 ℃暗培养3 d。将其培养3 d 的叶盘转入筛选培养基(MS 4.4 g/L、蔗糖30.0 g/L、6-BA 1.0 mg/L、头孢250.0 mg/L、Kan 50.0 mg/L、琼脂7.0 g/L,pH 值为5.8)中诱导不定芽产生。待丛生芽长到1~2 cm 时从叶盘上切下移入生根培养基(MS 2.2 g/L、蔗糖15.0 g/L、Kan 50.0 mg/L、头孢250.0 mg/L、琼脂7.0 g/L,pH 值为5.8)中诱导生根。
1.3 转基因植株的获得及分子检测
1.3.1 转基因植株PCR 检测 切取卡那抗性植株幼叶,利用高通量核酸提取仪(KingFisher Flex,Thermo Fisher)提取基因组DNA,具体步骤按磁珠法植物DNA 提取试剂盒说明书进行。通过琼脂糖凝胶电泳检测DNA 质量,并利用超微量生物检测仪测定其浓度(NanoDrop onec,Themo)。以DNA 为模板,用特异引物2F 和2R(表1)进行目的基因SBPase 扩增。PCR 反应体系(15.0 μL):DNA 模板1.0 μL,2×Taq Master Mix 7.5 μL,正、反向引物(10 μmol/L)各0.3 μL,RNase-Free water 5.9 μL。PCR 反应程序:94 ℃3 min;94 ℃45 s,58 ℃45 s,72 ℃1 min,32 个循环;72 ℃10 min,4 ℃保存。
1.3.2 目的基因SBPase 拷贝数检测 利用微滴式数字PCR(droplet digital,ddPCR) 技术,首先对SBPase 基因的扩增引物(3F/3R)和内参基因RNR2的扩增引物(1F/1R)的特异性进行检测。之后用特异引物3F 和3R(表1)对PCR 检测阳性植株进行SBPase 基因插入拷贝数检测。ddPCR 扩增体系(25.0 μL):模板2.0 μL,2×PerfeCTa Qpcr ToughMix UNG 5.0 μL,Alexa FluorTM647 1.0 μL,EvaGreen 20×in water 2.0 μL,上、下游引物各0.4 μL,ddH2O 14.2 μL。将25.0 μL 反应液加入芯片,利用数字PCR 仪(Naica,Stilla Techn Logieso,France)进行扩增反应。内参基因为烟草核糖核酸酶基因(RNR2),在烟草中拷贝数为1。数字PCR 扩增程序为94 ℃5 min;95 ℃30 s,60 ℃30 s,72 ℃30 s,40 个循环;72 ℃5 min,每个样品进行3 次平行重复试验。扩增反应完毕后,将芯片放入微滴读取仪依据荧光信号的有无对阳性微滴和阴性微滴进行判定读值。利用软件Crystal Reader 对数据进行分析,得到核酸绝对定量结果。外源基因拷贝数的计算方法:外源基因拷贝数=外源基因浓度/内参基因浓度。
1.4 转基因烟草农艺性状及光合特性测定
将低拷贝转基因烟草植株移栽至花盆中,收获T0代种子。随机将3 个株系的T0代种子播种在花盆里获得T1代植株。分离的T1代植株经PCR 检测后获得阳性植株,每个株系选择生长良好、长势一致的同一时期阳性植株各10 株进行移栽。移栽后的植株放入步入式培养箱(Percival PR-1218)继续生长,培养箱温度为25 ℃,光照18 h/d,相对湿度60%。幼苗生长到45 d 时,测定株高、茎围、叶长、叶宽和叶片数农艺性状,具体测定方法参照烟草农艺性状调查测量标准方法[15]。同时,利用光合仪(LI-COR6800,USA)测定植株的光合特性,测定时间为10:00—11:00,光源为红蓝光源,光强为1 000 μmol(/m2·s),CO2浓度为400 μmol/mol,温度为25 ℃。选取生长状况一致、叶片完全展开且叶位大致相同的成熟叶片,测定净光合指标,每个样品重复测定3 次。
1.5 数据处理
利用Microsoft Excel 2020 软件进行试验数据处理并作图,借助SPSS 22.0 软件进行差异显著性分析。
2 结果与分析
2.1 抗性烟草植株的获得
采用农杆菌介导叶盘法转化烟草(图1),通过卡纳霉素(50 mg/L)筛选获得抗性丛生芽,待丛生芽长到1~2 cm 时,从叶盘上切下移入生根培养基进行生根培养,获得抗性烟草植株。

图1 烟草的遗传转化
2.2 转基因烟草的PCR 检测
随机选取35 株卡那霉素抗性植株进行目的基因SBPase 的PCR 扩增,扩增产物经1%琼脂糖凝胶电泳检测,均获得预期大小片段(图2),初步判断目的基因已整合到烟草染色体基因组中,获得转基因植株32 株。
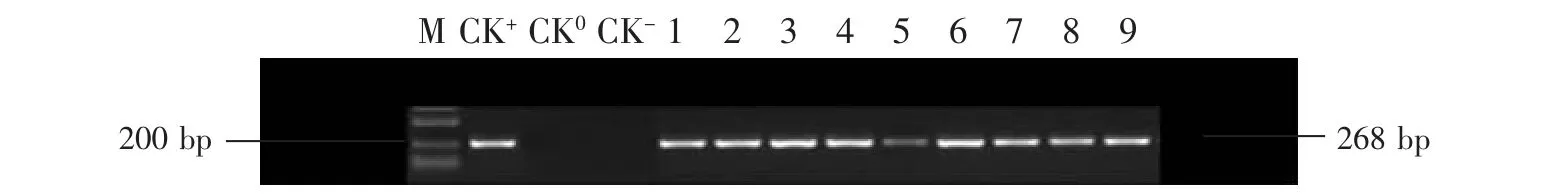
图2 部分转基因烟草的PCR 检测
2.3 目的基因拷贝数检测
利用ddPCR 技术对32 株阳性植株进行插入拷贝数检测。首先以烟草RNR2 为内参基因,对目的基因SBPase 扩增引物(3F/3R)的特异性进行检测。由图3 可知,2 个基因对应引物的阳性微滴(蓝色带)与阴性微滴(黑色带)都能明显区分开。图3中蓝色信号点代表发生PCR 扩增的微滴,系统判读为阳性信号;黑色信号点代表未发生PCR 扩增的微滴,系统判读为阴性信号。结果表明,目的基因SBPase 引物的特异性较好。其次,对ddPCR 的重复性进行分析,所有样品SBPase 和RNR2 基因的有效微滴总数为24 310~27 094(表2),满足微滴式数字PCR 微滴的分析要求,生成微滴的相对标准偏差(relative standard deviation,RSD)为2%~5%(表2),小于25%,符合欧盟核酸定量检测的要求,说明建立的微滴式数字PCR 体系微滴生成稳定,重复性良好,数据可靠性高。本研究对32 株转基因植株进行拷贝数分析,共获得低拷贝转基因植株15 株,部分数据见表3,SBPase 基因的插入拷贝数均在0.5~1.5。

图3 ddPCR 引物特异性检测
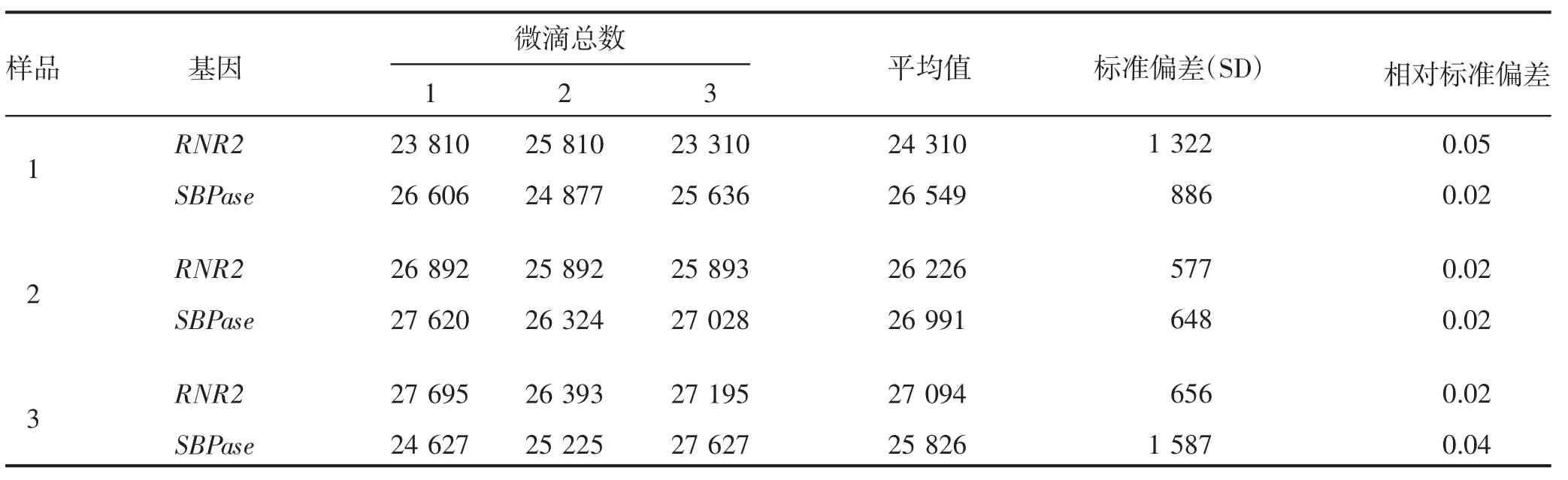
表2 ddPCR 重复性分析
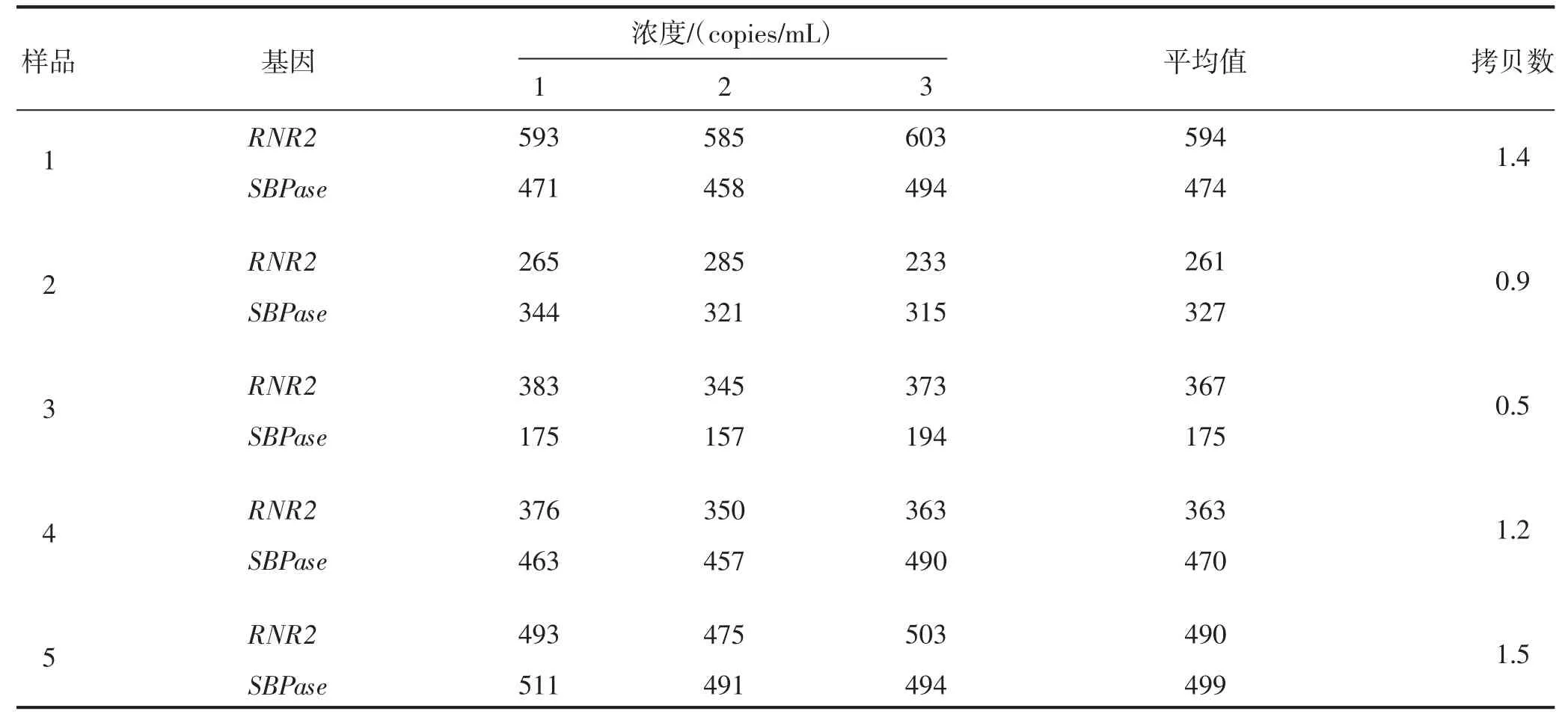
表3 部分植株ddPCR SBPase 基因拷贝数分析
2.4 转基因烟草植株的农艺性状测定
为了观察鉴定转基因烟草植株表型(图4),随机选取3 个低拷贝株系的植株,与野生型烟草进行农艺性状测定。由表4 可知,转基因烟草3 个株系的茎围、叶长均显著高于野生型烟草(P<0.05),L1、L2、L3 株系茎围比野生型烟草WT 分别增加了52.47%、21.34%和49.17%;叶长分别增加了30.77%、25.96%和39.10%。L1、L2、L3 转基因烟草株系的叶宽与野生型烟草WT 差异达到了极显著水平(P<0.01),分别高于野生型烟草WT 55.48%、53.82%和65.39%;叶片数、株高均高于野生型烟草WT,但差异未达到显著水平(P>0.05),表明SBPase在烟草中超表达,提高了烟草的各项农艺性状指标水平。

图4 烟草植物表型
2.5 烟草植株的光合特性测定
选取以上3 个低拷贝烟草植株完全展开的成熟叶片,以野生型烟草植株为对照,测定其叶片的光合特性。结果表明,3 个转基因烟草株系(L1、L2、L3)植株的净光合速率分别为5.651、4.312 和3.389 μmol/(m2·s)(图5Ⅰ),分别比野生型植株提高了88.2%、43.6%和27.1%(P<0.05);株系蒸腾速率、气孔导度均略高于野生型烟草(图5Ⅱ、图5Ⅳ),但未达到显著差异水平(P>0.05);胞间CO2浓度与野生型烟草达到显著水平(P<0.05),分别高于野生型烟草13.0%、4.4%和4.3%(图5Ⅲ),表明在烟草中超表达SBPase 基因可以增强光合特性。

表4 烟草农艺性状测定结果
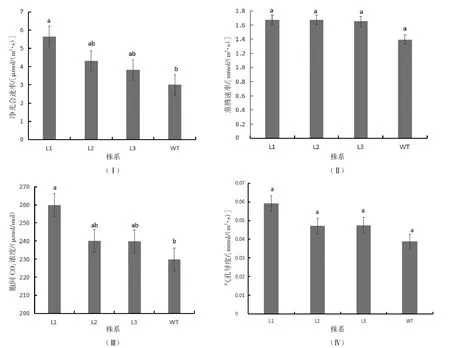
图5 烟草光合特性分析
3 讨论和结论
光合作用强弱严重影响植物的生长发育[16],植物对碳固定能力的提高会显著促进自身生长发育[17-18]。有研究表明,SBPase 基因表达量提高,对植株的生长有促进作用,植株的生物量和光合性能也随之增加。超表达SBPase 基因对拟南芥生长发育有明显促进作用,转基因拟南芥的叶面积和根长明显优于野生型拟南芥[8]。在衣藻(Chlamydomonas reinhardtii)中超表达SBPase,显著增强过表达植株的光合速率[19]。二穗短柄草(Brachypodium distachyon)中SBPase 基因在小麦中转化表达,温室条件下,高表达SBPase转基因植株叶片光合作用增强,总生物量和干种子产量增加[20]。超表达SBPase 基因显著增加拟南芥净光合速率,叶片中的淀粉、可溶性糖含量及植株干物质量增加[21]。在烟草上研究发现,通过增加SBPase活性的转基因烟草表现出较高水平的蔗糖和淀粉积累,且叶面积和生物量显著增加[22]。利用Rubisco 小亚基启动子驱动的SBPase 反义表达载体对烟草进行遗传转化,发现转基因烟草的SBPase 活性明显降低,植株的花期和开花数量受到严重影响[23]。本研究与前人获得了一致性研究结果,在烟草上超表达SBPase 基因后,农艺性状有较明显的优良表现,转基因烟草茎围、叶长、叶宽显著提高,叶片数和株高也表现出不同程度的提高。转SBPase 基因后,烟草光合性能大幅度提高,净光合速率和胞间CO2浓度显著提高,蒸腾速率和气孔导度均高于野生型烟草,确保其能维持较高的光合速率和积累更多的光合作用产物促进自身生长发育[24]。
启动子已被广泛应用于植物遗传转化,如35S、Actin 和Ubiquitin 具有强度高、非组织特异和不易受转化基因的影响等特点[25]。现有的研究结果证明,通过对光合作用相关基因进行调节可以提高光合速率,但许多与主要农艺性状相关基因的组成型过量表达明显带来负面效应,因为大量表达外源基因会增加植物的代谢负担,导致营养消耗,从而干扰植株的生长发育[13]。目前,甜菜分子育种课题组正尝试改造(弱化)拟南芥RBCS 启动子,微量增加转基因烟草植株中外源SBPase 的表达,能否获得更高光合速率和生物量有待验证。
