小儿荆杏止咳颗粒对幼龄大鼠发育毒性的研究
2021-11-01陈琼芳张宗利新药药效与安全性评价湖南省重点实验室长沙410331
陈琼芳,张宗利(新药药效与安全性评价湖南省重点实验室,长沙 410331)
小儿荆杏止咳颗粒由荆芥、矮地茶、杏仁、炙麻黄等中药组成,具有疏风散寒、宣肺清热、祛痰止咳的功效,主要用于治疗小儿外感咳嗽风寒化热证,即小儿急性气管-支气管炎引起的咳嗽、咯痰、痰黄、眼部红肿、发热等症。小儿急性气管-支气管炎是儿科常见、多发的肺系病证,50%~60%由病毒感染引起,主要有流感病毒、副流感病毒、柯萨奇病毒、呼吸道合胞病毒、鼻病毒、腺病毒等[1]。目前针对中药儿科产品临床前幼龄动物毒性研究不完整,无法针对性地反映产品对儿童生长发育的影响。美国FDA、欧洲 EMA及中国NMPA均针对儿科用药的非临床安全性评价颁布了相应的指导原则[2-4]。本研究通过观察幼龄SD大鼠的体质量、生长发育指标、神经系统指标、免疫系统指标、骨骼系统指标,系统评价小儿荆杏止咳颗粒的发育毒性,为其临床安全用药提供参考。
1 材料
1.1 动物
购入出生1 d(PND1)的幼年SD大鼠260只,体质量13.3~22.2 g,共26窝,每窝10只,雌雄各半,每窝附带母鼠1只[实验动物生产许可证号:SCXK(湘)2013-0004,实验动物质量合格证号:43004700029756];按照国标(GB14925-2010)SPF级实验动物环境条件要求饲养于湖南省药物安全评价研究中心屏障环境A区,动物检疫和适应环境饲养5 d,实验动物使用许可证号:SYXK(湘)2015-0016。实验期间环境温度20~26℃,相对湿度:40%~70%。
1.2 试药
小儿荆杏止咳颗粒[以下简称JXZKG,湖南方盛制药股份有限公司,批号:161201,含量:4.23 g生药/g干膏,临床用量:6岁以下一次0.5袋(每袋含生药18.33 g)tid],给药前以蒸馏水配制成所需浓度。
甲紫溶液(批号:20160502,卫辉市康宝生化科技有限公司);戊巴比妥钠(批号:20160218,德国Merck);免疫细胞检测相关试剂盒(批号:201702,武汉Bio-Swamp)等。
1.3 仪器
AUY型分析天平(日本岛津公司);PL2002型电子天平[梅特勒-托利多仪器(上海)有限公司];Digbehv 型动物行为分析系统(上海吉量软件科技有限公司);R_mCT2型微型CT(日本Rigaku Yamanashi公司);MR-96A型酶标仪(深圳迈瑞生物医疗电子股份有限公司);BX43型生物显微镜+MD50型数码成像系统(日本奥林巴斯公司);ASP200S型全自动组织脱水机、EG1150H+C型组织包埋机、AutoStainer XL自动载玻片染色机+CV5030自动盖片机(德国Leica)等。
2 方法
2.1 裂窝分组及剂量设计
PND1幼龄SD大鼠适应饲养 5 d后,于首次给药前2日(PND6),随机选取检疫合格的24只母鼠及240只仔鼠随机分为4个临时小组,每组6只母鼠及60只仔鼠,分别为空白对照组,JXZKG低、中、高剂量组。将母鼠放入新的大鼠笼具中,分别按顺序编号为1-1,1-2,1-3……4-6;小组内部每窝动物抽取窝内编号为F01的雌性仔鼠和窝内编号为M01雄性仔鼠(共8只),交由组内母鼠编号为1的母鼠进行抚养;再自每窝其余动物中抽取窝内编号为F02的雌性仔鼠和窝内编号为M02雄性仔鼠(共8只),交由组内母鼠编号为2的母鼠进行抚养;以此类推直至将每窝中的仔鼠均匀分布至小组中各只母鼠抚养。
由于药物溶解度的限制,药物可顺利给予幼龄动物的最大质量浓度为2.54 g干膏·mL-1,故依此设计高、中、低剂量组药物质量浓度分别为2.54、1.27、0.63 g干膏·mL-1,对 应25.4、12.7、6.3 g生药·kg-1,分别相当于儿童临床剂量按公斤折算的10.2倍、5.1倍、2.5倍(按照6岁儿童平均体质量22 kg,每日用药55 g生药计)。于PND8开始按10 mL·kg-1的体积灌胃给予对应药物,每日1次,连续给药14周。
2.2 检测指标
2.2.1 一般状态观察 每日给药后肉眼观察动物外观、精神状态、粪便情况、饮食及饮水情况等。
2.2.2 体质量 断乳之前(PND8~PND21)每日称体质量1次,PND22~PND35每周称2次,PND36~PND133每周称1次,根据每次称重调整给药量。每日称量摄水量和饲料加料量,每周计算平均摄食量和摄水量。
2.2.3 生长发育指标检测 于PND8~PND42分别观察动物各项标志性特征(幼鼠下门齿萌出、睁眼、张耳、睾丸下降、包皮分离、阴道张开)是否发育完成。
2.2.4 神经反射、行为学指标检测 于PND10~PND21分别检测动物负向趋地性反射、听觉惊愕反射及空中翻正反射是否形成[4-7];分别于给药后第4、9、14周检测不同发育阶段[各组间随机选取10只动物,雌雄各半,检测自主活动指标(活动时间、活动次数和活动距离)及转棒(跌落次数)]是否存在差异。
2.2.5 肝药酶、血清球蛋白及激素指标检测 分别于给药期第4、9、14周末,采用Elisa法检测肝组织细胞色素CYP2E1、CYP1A2含量和大鼠血清免疫指标(IgG、IgA、IgM、IgE)、生长激素(E)、甲状腺激素T3、甲状腺激素T4、促皮质激素(ACTH)、雄激素(androgen)、雌激素(GH)及孕激素(PROG)含量。
2.2.6 胫骨长度检测 分别于给药期第9、14周末、恢复期第4周末用游标卡尺检测动物右侧胫骨长度(近端关节面与远端关节面的直线距离)。
2.2.7 骨密度检测 分别于给药期第4、9、14周末、恢复期第4周末,解剖时取右侧股骨,纱布包裹加入适量冷生理盐水后冻存,进行小动物微型CT骨密度检测。
2.2.8 病理解剖 于给药后4、9周末每组雌雄分别解剖 5 只,给药后14周末每组雌雄各解剖10 只,对空白对照组、高剂量组及尸检异常动物进行病理检查,如高剂量组动物某一组织出现与药物相关病变,需要对其他剂量组动物的相同组织进行组织病理学检查。
2.3 统计学方法
采用 SPSS 17.0进行统计分析,计量资料采用均数±标准差(±s)表示,用单因素方差分析(ANOVA)和非参数检验进行统计分析。评价时考虑统计学差异和生物学意义,其中P<0.05表示有统计学意义。发育检查及神经反射检查以达标时间为统计指标,按计量资料进行正态性和方差齐性检验。
3 结果
3.1 大鼠一般状态
与空白对照组比较,JXZKG高、中剂量组大鼠分别在给药第3~12日、第3~6日出现不同程度的腹泻现象,这一现象在给药第3周完全消失。JXZKG低剂量组大鼠一般状态没有异常,综合本中心进行的其他幼龄动物试验临床观察现象,认为是幼龄大鼠灌胃给予高浓度药液之后的正常反应。
3.2 哺乳期幼鼠和断乳后大鼠体质量变化情况
如图1A所示,在给药后,哺乳期内与同期空白对照组比较,JXZKG高剂量组幼鼠体质量明显降低(P<0.01);JXZKG中、高剂量组未见明显差异。如图1B所示,断乳后与同期空白对照组比较,JXZKG各剂量组动物体质量未见明显差异。
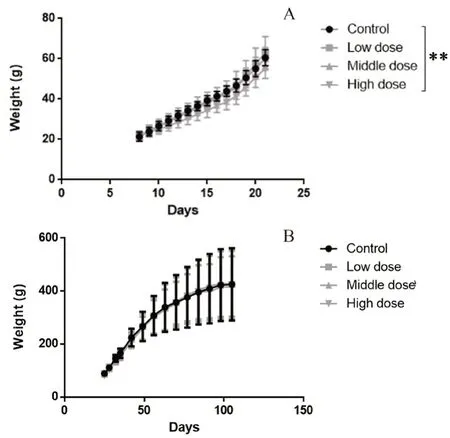
图1 小儿荆杏止咳颗粒对哺乳期(A)和对断乳(B)大鼠体质量的影响Fig 1 Effect of JXZKG on the body weight of lactation rats(A)and weaned rats(B)
由结果可知幼龄SD大鼠经口灌胃给予JXZKG,哺乳期及断乳前期高剂量组动物体质量与同期空白对照组比较有一定下降,但下降幅度不大(未超过同期空白对照组体质量的10%),且此期间内动物体质量增长速度相比同期空白对照组无明显差异,结合组织病理学检查未见毒性意义的病理改变,认为哺乳期及断乳前期高剂量组动物体质量下降是灌胃给予高浓度的药液产生的影响,无明显毒理学意义。
3.3 大鼠平均摄食量、摄水量
实验期间JXZKG各给药组平均摄食量和摄水量与同期空白对照组比较,差异均无统计学意义,具体数据未列出。
3.4 大鼠生长发育指标情况
如表1所示,JXZKG各剂量组动物生理发育标志性事件发生时间与空白对照组比较,差异均无统计学意义。
表1 小儿荆杏止咳颗粒对大鼠发育指标结果统计(±s,n=30)Tab 1 Effect of JXZKG on the development index of rats (x± s,n=30)
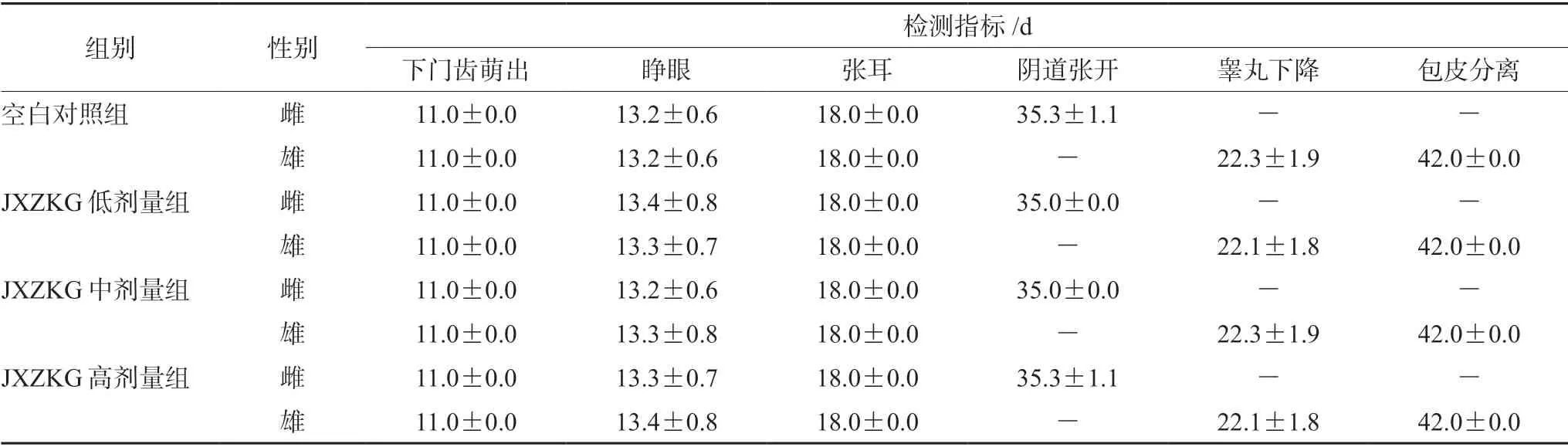
表1 小儿荆杏止咳颗粒对大鼠发育指标结果统计(±s,n=30)Tab 1 Effect of JXZKG on the development index of rats (x± s,n=30)
组别 性别 检测指标/d下门齿萌出 睁眼 张耳 阴道张开 睾丸下降 包皮分离空白对照组 雌 11.0±0.0 13.2±0.6 18.0±0.0 35.3±1.1 - -雄11.0±0.0 13.2±0.6 18.0±0.0 - 22.3±1.9 42.0±0.0 JXZKG低剂量组 雌 11.0±0.0 13.4±0.8 18.0±0.0 35.0±0.0 - -雄11.0±0.0 13.3±0.7 18.0±0.0 - 22.1±1.8 42.0±0.0 JXZKG中剂量组 雌 11.0±0.0 13.2±0.6 18.0±0.0 35.0±0.0 - -雄11.0±0.0 13.3±0.8 18.0±0.0 - 22.3±1.9 42.0±0.0 JXZKG高剂量组 雌 11.0±0.0 13.3±0.7 18.0±0.0 35.3±1.1 - -雄11.0±0.0 13.4±0.8 18.0±0.0 - 22.1±1.8 42.0±0.0
3.5 大鼠神经反射功能情况
如表2所示,JXZKG中剂量组空中翻正反射达标时间略高于空白对照组(P<0.05),但未表现出明显的剂量关系,且相差不大,认为是个体差异所致,且幼龄SD大鼠空中翻正反射常在PND16~PND19发育完成,各组动物均在PND16~PND19发育完成,故认为该变化没有毒理学意义;其他指标差异均无统计学意义。
表2 小儿荆杏止咳颗粒对动物反射指标结果统计(±s,n=60)Tab 2 Effect of JXZKG on the reflection index of rats (x± s,n=60)
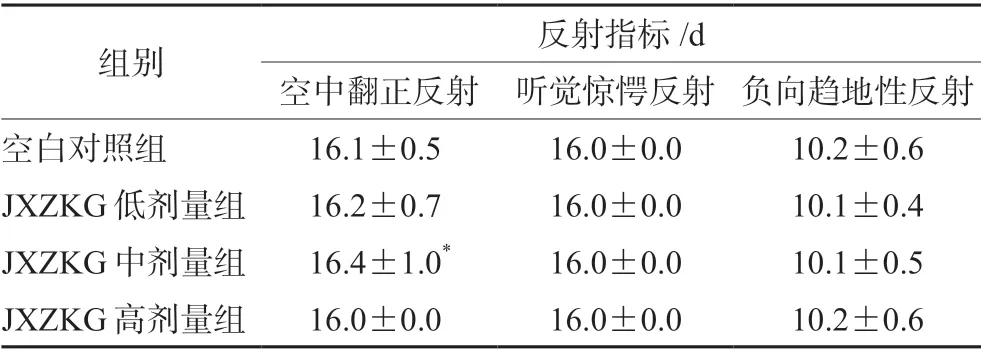
表2 小儿荆杏止咳颗粒对动物反射指标结果统计(±s,n=60)Tab 2 Effect of JXZKG on the reflection index of rats (x± s,n=60)
注(Note):与空白对照组比较,*P <0.05(vs the blank control group,*P<0.05)。
组别 反射指标/d空中翻正反射 听觉惊愕反射 负向趋地性反射空白对照组 16.1±0.5 16.0±0.0 10.2±0.6 JXZKG低剂量组 16.2±0.7 16.0±0.0 10.1±0.4 JXZKG中剂量组 16.4±1.0* 16.0±0.0 10.1±0.5 JXZKG高剂量组 16.0±0.0 16.0±0.0 10.2±0.6
3.6 大鼠行为学指标情况
如表3~4所示,给药中期,JXZKG中、高剂量组活动距离明显低于同期空白对照组(P<0.01);高剂量组活动时间明显低于同期空白对照组(P<0.05),活动次数明显高于同期空白对照组(P<0.05)。各给药组动物转棒跌落次数与空白对照组相比,差异无统计学意义。
表3 小儿荆杏止咳颗粒对动物自主活动检测结果统计(±s,n=10)Tab 3 Effect of JXZKG on the autonomic activity index of rats (±s,n=10)
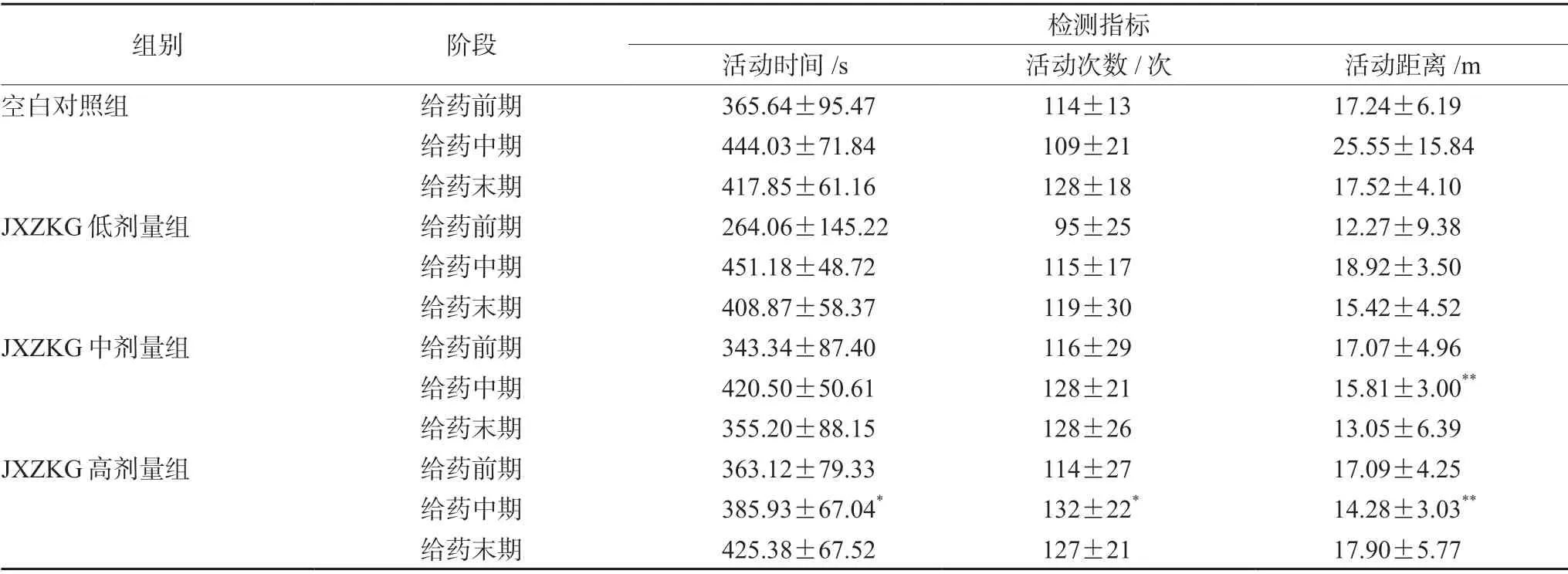
表3 小儿荆杏止咳颗粒对动物自主活动检测结果统计(±s,n=10)Tab 3 Effect of JXZKG on the autonomic activity index of rats (±s,n=10)
注(Note):与空白对照组比较,*P <0.05,**P<0.01(vs the blank control group,*P<0.05,**P<0.01)。
组别 阶段 检测指标活动时间/s 活动次数/次 活动距离/m空白对照组 给药前期 365.64±95.47 114±13 17.24±6.19给药中期 444.03±71.84 109±21 25.55±15.84给药末期 417.85±61.16 128±18 17.52±4.10 JXZKG低剂量组 给药前期 264.06±145.22 95±25 12.27±9.38给药中期 451.18±48.72 115±17 18.92±3.50给药末期 408.87±58.37 119±30 15.42±4.52 JXZKG中剂量组 给药前期 343.34±87.40 116±29 17.07±4.96给药中期 420.50±50.61 128±21 15.81±3.00**给药末期 355.20±88.15 128±26 13.05±6.39 JXZKG高剂量组 给药前期 363.12±79.33 114±27 17.09±4.25给药中期 385.93±67.04* 132±22* 14.28±3.03**给药末期 425.38±67.52 127±21 17.90±5.77
表4 小儿荆杏止咳颗粒对动物转棒检测结果统计(±s,n=10)Tab 4 Effect of JXZKG on rotating stick index of rats (x± s,n=10)
表4 小儿荆杏止咳颗粒对动物转棒检测结果统计(±s,n=10)Tab 4 Effect of JXZKG on rotating stick index of rats (x± s,n=10)
组别 跌落次数/次给药前期 给药中期 给药末期空白对照组 3±3 2±1 1±2 JXZKG低剂量组 4±4 2±2 1±2 JXZKG中剂量组 2±2 2±3 2±2 JXZKG高剂量组 2±1 2±2 2±2
3.7 胫骨长度及骨密度指标情况
如图2所示,整个试验期间各给药组胫骨长度及骨密度分别与同期空白对照组相比,差异均无统计学意义。
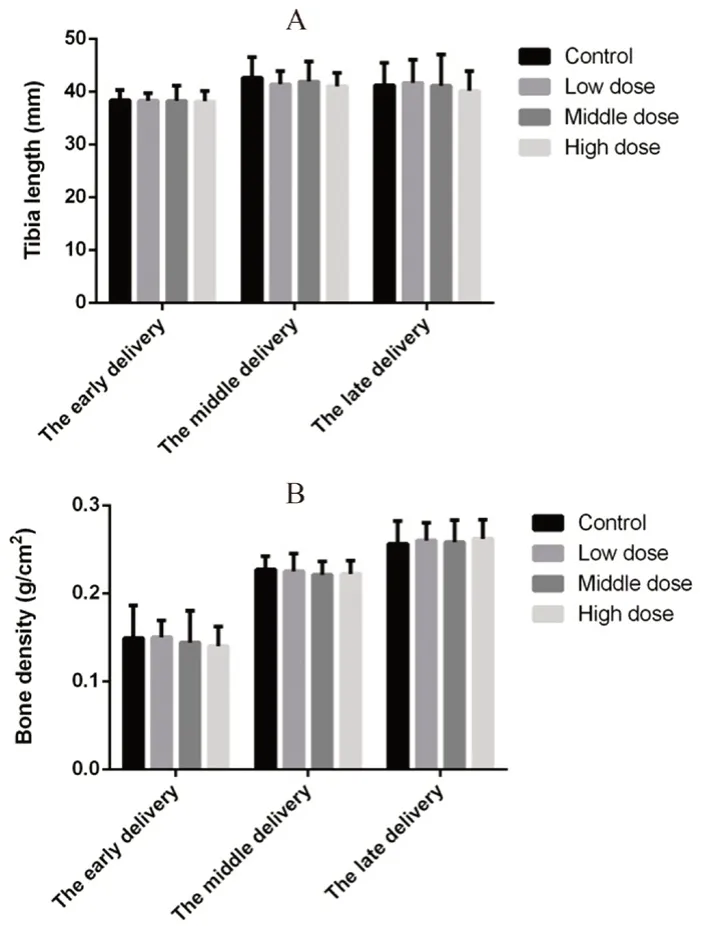
图2 小儿荆杏止咳颗粒对动物胫骨长度(A)和骨密度(B)的影响Fig 2 Effect of JXZKG on the tibia length(A)and the bone density(B)of rats
3.8 大鼠肝药酶检查结果
如表5所示,给药末期,JXZKG低剂量组CYP1A2明显低于同期空白对照组(P<0.05),其他时期各剂量组差异均无统计学意义。
表5 小儿荆杏止咳颗粒对大鼠肝药酶指标的影响(±s)Tab 5 Effect of JXZKG on the liver drug metabolizing enzym (x± s)

表5 小儿荆杏止咳颗粒对大鼠肝药酶指标的影响(±s)Tab 5 Effect of JXZKG on the liver drug metabolizing enzym (x± s)
注(Note):与空白对照组比较,*P <0.05(vs the blank control group,*P<0.05)。
组别 阶段 动物数/只 肝药酶指标/(μmol·mL-1)CYP1A2 CPY2E1空白对照组 给药前期 20 5.21±0.81 35.51±5.02给药中期 10 3.83±0.89 22.35±4.20给药末期 20给药前期 20给药中期 10给药末期 20给药前期 20 4.33±1.06 28.13±6.90 JXZKG低剂量组 4.70±0.96 32.63±4.55 4.00±1.23 23.09±5.50 3.94±0.86* 32.04±11.38 JXZKG中剂量组 4.65±0.90 34.39±5.13给药中期 10 3.62±0.79 24.60±5.27给药末期 20 3.65±0.92 29.34±7.87 JXZKG高剂量组 给药前期 20 4.70±1.03 34.73±4.09给药中期 10 3.78±0.80 25.50±7.79给药末期 20 4.25±1.16 26.13±8.35
3.9 大鼠血清激素指标检查结果
如表6所示,给药前期,JXZKG高剂量组甲状腺激素T3、T4明显高于同期空白对照组(P<0.01或P<0.05),其他时期各剂量组差异均无统计学意义。
表6 小儿荆杏止咳颗粒对大鼠血清激素指标的影响(±s)Tab 6 Effect of JXZKG on the serum hormone index of rats (±s)

表6 小儿荆杏止咳颗粒对大鼠血清激素指标的影响(±s)Tab 6 Effect of JXZKG on the serum hormone index of rats (±s)
注(Note):与空白对照组比较,*P <0.05,**P<0.01(vs the blank control group,*P<0.05,**P<0.01)。
血清激素指标/(μmol·mL-1)PROG GH E Androgen ACTH 甲状腺激素 T3甲状腺激素T4空白对照组 给药前期 20 17.73±4.45 202.65±94.38 74.36±30.58 4.19±1.07 5.39±2.10 50.49±16.88 36.80±12.85给药中期 10 16.73±1.40 156.04±57.54 63.39±1.31 4.09±0.61 4.75±0.36 62.50±9.85 32.99±3.20给药末期 20 17.41±1.49 225.91±85.82 59.78±2.51 3.67±1.09 4.51±1.13 59.89±13.03 34.68±8.59 JXZKG低剂量组 给药前期 20 20.10±6.63 192.06±102.42 70.59±22.04 3.96±1.04 4.67±1.28 46.37±17.45 46.63±19.99给药中期 10 16.11±1.55 132.30±33.55 64.13±2.00 4.28±0.85 4.95±0.61 68.90±8.97 35.67±3.60给药末期 20 17.37±1.96 234.49±73.92 59.49±2.39 3.91±1.02 4.87±1.10 51.68±12.43 35.15±9.20 JXZKG中剂量组 给药前期 20 19.51±4.76 186.17±60.03 75.34±24.52 3.56±0.80 4.56±1.87 61.17±32.73 43.06±19.22给药中期 10 15.94±1.52 149.94±35.45 63.81±2.09 4.22±0.60 4.68±0.32 67.81±13.43 31.73±3.03给药末期 20 16.79±1.72 247.30±54.53 60.86±4.27 3.25±0.57 5.02±0.97 57.87±11.31 34.87±5.94 JXZKG高剂量组 给药前期 20 21.34±3.87 177.60±76.55 83.92±20.34 4.12±0.82 4.72±1.97 74.98±35.22* 56.06±20.23**给药中期 10 15.87±0.87 130.74±40.29 63.81±2.00 4.22±0.44 4.79±0.66 65.74±7.54 36.10±4.59给药末期 20 18.09±1.75 269.47±64.34 59.60±2.97 3.47±1.01 4.87±1.23 59.66±19.66 35.49±10.66组别 阶段 动物数/只
3.10 大鼠免疫指标检查结果
如表7所示,给药前期,JXZKG高剂量组免疫球蛋白IgA高于同期空白对照组(P<0.05),其他时期各剂量组差异均无统计学意义。
表7 小儿荆杏止咳颗粒对大鼠免疫指标的影响(±s)Tab 7 Effect of JXZKG on the immune index of rats (±s)
表7 小儿荆杏止咳颗粒对大鼠免疫指标的影响(±s)Tab 7 Effect of JXZKG on the immune index of rats (±s)
注(Note):与空白对照组比较,*P <0.05(vs the blank control group,*P<0.05)。
组别 阶段 动物数/只 免疫指标/(μmol·mL-1)IgA IgM IgG IgE空白对照组 给药前期 20 7.07±1.54 7.40±3.19 6.34±4.30 77.21±45.52给药中期 10给药末期 20给药前期 20 7.28±1.12 7.93±1.99 8.75±2.57 111.56±17.40 7.67±1.26 6.39±1.47 7.19±2.73 101.09±25.07 JXZKG低剂量组 7.45±1.70 6.56±1.96 5.63±2.00 83.20±31.37给药中期 10 7.77±1.14 8.82±1.28 10.33±2.91 113.13±23.23给药末期 20 7.50±1.20 6.90±1.78 7.68±2.78 107.53±24.03 JXZKG中剂量组 给药前期 20 7.83±2.53 6.66±1.45 5.46±2.67 80.58±36.00给药中期 10 7.21±0.83 7.79±1.30 8.31±2.67 118.62±23.32给药末期 20 7.92±1.60 6.85±1.55 9.05±4.43 114.17±29.44 JXZKG高剂量组 给药前期 20 8.93±2.42* 6.75±2.01 6.34±2.84 90.68±34.33给药中期 10 7.98±0.79 8.18±1.84 7.12±1.86 111.06±24.10给药末期 20 7.75±1.66 6.82±1.54 8.59±2.94 118.42±26.26
3.11 组织病理学检查结果
给药前期、给药中期和给药末期及恢复期解剖的空白对照组及各剂量组动物组织器官大小、颜色及质地均未见明显异常。给药前期、给药中期和给药末期及恢复期组织病理学检查均未发现JXZKG对幼龄SD大鼠脑、脊髓、垂体、胸腺、食管、气管、甲状腺/甲状旁腺、唾液腺、胃肠道、胰腺、肝脏、肾脏、肾上腺、脾脏、肺脏、心脏、膀胱、睾丸、附睾、前列腺、精囊腺、卵巢和输卵管、子宫和子宫颈、阴道、乳腺、哈氏腺、眼等组织有毒性意义的病理改变。
4 讨论
4.1 JXZKG对一般评价指标的影响
体质量和体质量变化是毒性的敏感指标,幼龄动物出生后早期增长相对快速,故10周龄前的体质量每周至少称量2次,以观察体质量的细微变化,并有助于更准确地计算给药量,更大限度地暴露药物毒性[8-11]。且幼龄大鼠耳廓分离、睁眼和牙齿萌出等离乳前身体发育指标与体质量有明确的正相关,通过这些指标可观察和判断受试药物是否导致发育延迟。本实验结果显示,仅哺乳期及断乳前期25.4 g生药·kg-1组幼龄大鼠的体质量与空白对照组比较有显著性降低,相当于临床剂量(按体质量计)的 10.2倍,但体质量下降幅度不大(未超过同期空白对照组体质量的10%),且此期间内动物体质量增长速度相比同期空白对照组无明显差异;6.3和12.7生药·kg-1均对幼龄大鼠的体质量增长无明显影响;虽给予高剂量JXZKG会导致动物体质量下降,但并不会对动物产生系统损伤,故认为哺乳期及断乳前期高剂量组动物体质量下降是灌胃给予高浓度的药液产生的影响,无明显毒理学意义。3个剂量均对幼龄大鼠的身体发育指标无明显影响。以上结果表明,JXZKG对幼龄大鼠生长发育无明显影响。
4.2 JXZKG对特殊系统指标的影响
特殊系统指标主要包括中枢神经系统、性发育和骨骼系统、免疫系统等[12-13]。本实验对性成熟评估和神经行为测试、骨密度检测以及对肝药酶、血清球蛋白及激素指标进行检测。性发育包括雄性睾丸下降、包皮分离和雌性阴道张开,检测发现雄性大鼠睾丸下降发生在大鼠出生后22 d左右、包皮分离发生在42 d左右,阴道口张开发生在35 d左右,JXZKG低、中、高剂量均未引起其性发育时间点的改变,故JXZKG对幼龄大鼠性发育无明显影响。中枢神经系统的发育评估应包括个体发育反射、感觉运动功能、学习和记忆功能等[13]。由结果分析,JXZKG低、中、高剂量空中对翻正反射、听觉惊愕反射和负向趋地性反射等神经反射功能及协调性和自主活动等学习记忆能力没有明显的影响,则JXZKG对幼龄大鼠神经系统发育无明显影响。本实验通过检测胫骨长度和骨密度评价JXZKG对骨骼系统发育的影响。由结果分析,JXZKG低、中、高剂量与空白对照组比较骨密度和胫骨长度均未见明显差异,则JXZKG对幼龄大鼠骨骼系统发育无明显影响。本实验通过检测血清球蛋白IgG、IgA、IgE、IgM评估对免疫系统发育的影响。由结果分析,JXZKG低、中、高剂量与空白对照组比较血清球蛋白IgG、IgA、IgE、IgM未见规律性差异,则JXZKG对幼龄大鼠免疫系统发育无明显影响。
综上所述,JXZKG对幼龄大鼠身体发育、神经系统、骨骼系统和免疫系统发育均无明显影响。JXZKG对幼龄大鼠无发育毒性剂量为25.4 g生药·kg-1,为临床剂量(按体质量计)的10.2倍。
