四物汤防治动脉粥样硬化分子机制的网络药理学研究及实验验证
2021-11-01张盟孙丽萍高文雅赵丕文北京中医药大学生命科学学院北京0488北京中医药大学中医学院北京0488
张盟,孙丽萍,高文雅,赵丕文*(. 北京中医药大学 生命科学学院,北京 0488;. 北京中医药大学 中医学院,北京 0488)
根据世界卫生组织的相关统计,心血管疾病(cardiovascular diseases,CVDs)在近几十年内已发展成为导致人类死亡的主要原因之一。动脉粥样硬化(atherosclerosis,AS)是心肌梗死及脑卒中等心血管疾病的根本原因,典型特征是动脉壁上的AS斑块,在冠状动脉网络、脑、外周动脉有不同程度的临床表现,是心血管疾病发生的基础[1]。
四物汤由熟地、当归、白芍、川芎四味中药组成[2]。中医学既往并无AS对应病名记载,依据致病特点及临床表现。AS归属于中医学“脉痹、眩晕、胸痹心痛、中风、头痛”等病症范畴,主要证候为痰瘀互结证、气虚血瘀证等,针对不同证型AS的主要治疗药物中,多数都包括了四物汤中的几味药物[3]。
为了能够更加深入、全面地探讨四物汤防治AS作用的分子机制,本研究首先采用网络药理学结合GEO数据库挖掘,对其可能发挥作用的途径和靶点进行探究;在此基础上,应用血管平滑肌细胞(vascular smooth muscle cells,VSMCs)进行四物汤防治AS相关分子机制的体外实验验证。
1 方法
1.1 网络药理分析方法
1.1.1 四物汤中主要活性化合物的筛选与对应靶点的收集 采用TCMSP平台(http://lsp.nwu.edu.cn/tcmsp.php)以类药性(drug-like property,DL)>0.18,口服生物利用度(oral bioavailability,OB)≥30%为条件筛选主要活性化合物[4]。在Pubchem(https://pubchem.ncbi.nlm.nih.gov)网站中获取目标化合物SDF结构图,将该结构图导入Swisstarget平台(http://swisstargetprediction.ch/)[5-6],对目标化合物相关靶点进行预测,以可能性Probability>0.2筛选靶点,通过Cytoscape 3.8.0构建“四物汤-单味药-化合物-靶点”的网络[7]。
1.1.2 AS相关靶点的收集 以AS为关键词,在DrugBank(https://www.drugbank.com/)与OMIM数据库(https://www.omim.org/)中搜索该疾病相关靶点。在GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)中搜索AS疾病相关基因表达数据集;筛选目标数据集所测样本有>10个样本数量的AS斑块组织,同时具有>10个样本数量的正常血管组织作为对照。从选定的基因表达数据集中使用GEO2R工具分析,得到各基因的表达水平情况,生成样本的基因火山图;以P-value<0.05和∣log2(fold change)∣>1为标准筛选具有统计学意义的差异表达基因(differential expressed genes,DEGs),选取上升和下降最显著的前20个基因绘制热图。
1.1.3 四物汤防治AS的靶点收集 将“1.1.2”项下获得的AS相关基因取合集,与“1.1.1”项下获四物汤主要活性化合物对应靶点同步导入Cytoscape 3.7.0中,取两部分的交集,预测四物汤防治AS的靶点,并构建“化合物-靶点”的网络。
1.1.4 GO与KEGG通路富集分析 将“1.1.3”中预测的四物汤防治AS的靶点导入David数据库,进行基因本体论(GO)富集分析,分析四物汤对细胞生物过程(biological process,BP)、细胞成分(cellular component,CC)和分子功能(MF)三个分类的作用[8];对靶点进行京都基因百科全书(KEGG)富集分析,以P-value<0.05为标准进行筛选。
1.1.5 PPI网络构建与分析 将得到的四物汤防治AS的靶点输入String数据库(https://stringdb.org),检索“互作基因/蛋白质”,限定研究物种为智人,进行蛋白-蛋白相互作用网络(protein-protein interaction,PPI)的构建,以PPI评分阈值>0.4进行预测[9]。导入Cytoscape 3.8.0软件对PPI结果进行可视化。
1.2 体外实验方法
1.2.1 实验材料 大鼠胸大动脉平滑肌A7R5细胞(上海中科院细胞库);熟地、当归、白芍、川芎(经北京中医药大学刘启福教授鉴定为正品,北京同仁堂药店);氧化低密度脂蛋白(广东奕源生物);DMEM 细胞培养液、胎牛血清、0.25%胰酶、青/链霉素(赛默飞世尔生物化学制品);一氧化氮试剂盒(北京百瑞极生物);TRITC荧光标记二抗(中杉金桥);子α-平滑肌肌动蛋白(α-SMA)抗体、ERα抗体(Abcam);eNOS抗体、GADPH抗体、山羊抗兔二抗(proteintech)。
1.2.2 制备四物汤冻干粉 精密称取熟地30 g,当归18 g,白芍18 g,川芎12 g(共78 g药物),用8倍体积水浸泡30 min,煎煮2次,每次1 h,过滤后合并滤液,将溶液浓缩至约200 mL,12 000 r·min-1离心10 min后取上清液,置于圆底烧瓶装至冻干机,以-80℃冻干过夜。制得中药冻干粉40 g,每1 g冻干粉含有四物汤生药1.95 g。
1.2.3 VSMCs培养 使用含有10%胎牛血清与1%青霉素/链霉素的DMEM培养基,在37℃,5%CO2,100%湿度的培养箱中培养A7R5细胞。
1.2.4 VSMCs细胞的鉴定 免疫荧光检测平滑肌细胞特异性标记分子α-SMA;将正常生长至70%密度以上的VSMCs细胞用4%多聚甲醛固定30 min,封闭后使用α-SMA抗体进行4℃孵育过夜;第二日,使用荧光标记二抗在室温下避光孵育1 h,激光共聚焦显微镜(Olympus FV3000,Tokyo,Japan)下获取图像。
1.2.5 细胞增殖能力测定 将VSMCs以每孔8×104个细胞的密度接种于96孔板,培养24 h后进行处理;在四物汤对VSMCs增殖能力的影响实验中,设置空白对照组与四物汤组(培养基稀释药物质量浓度分别为0、25、50、75、100、250、500、750、1000、1250、1500 μg·mL-1),空白对照组仅做基础培养。在四物汤对ox-LDL诱导的VSMCs增殖能力影响实验中,设置空白对照组(基础培养基)、模型组、四物汤低剂量组、四物汤中剂量组和四物汤高剂量组;根据文献中所用剂量[10],模型组与四物汤组加入氧化低密度脂蛋白(ox-LDL)100 μg·mL-1进行诱导增殖,构建细胞AS模型,四物汤组同时加入100、500、1000 μg·mL-1四物汤,处理24 h后,加入CCK8试剂,37℃孵育2~3 h,使用酶标仪在450 nm处测定吸光度值,计算细胞增殖率。
1.2.6 一氧化氮含量测定 VSMCs按每孔3×105个细胞的密度接种至6孔板,培养24 h后进行处理,分组设置与处理同“1.2.5”中细胞增殖实验。37℃ 5% CO2培养箱中孵育48 h后,收集细胞上清液,4℃,3000 r·min-1离心15 min去除上清中漂浮细胞。按一氧化氮(NO)检测试剂盒说明书,制作NO含量标准曲线,根据吸光度值计算细胞上清中NO含量。
1.2.7 Western blot法检测蛋白表达量 根据网络药理分析结果,选择四物汤防治AS的关键靶点进行实验验证。VSMCs按每孔6×105个细胞的密度接种至T25培养瓶,培养24 h后进行处理,分组设置与处理同“1.2.5”项下,给药48 h后,低温下提取细胞总蛋白。蛋白样品在SDS-PAGE凝胶上进行电泳,后将蛋白从凝胶转电转到PVDF膜,封闭后置于一抗中在4℃冰箱孵育过夜,将二抗在室温摇床上孵育1 h,于凝胶成像仪(BIORAD化学发光凝胶成像系统)成像。
1.2.8 统计学方法 采用SPSS 18.0统计学软件对数据进行分析处理。计量资料数据用均数±标准差表示,实验数据分析均采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 网络药理分析结果
2.1.1 四物汤中主要活性化合物 从TCMSP数据库中检索到四物汤中共含有475个化合物,包括白芍85个、川芎189个、熟地76个、当归125个,排除重复化合物得到438个,根据“1.1.1”项下所述OB与DL值筛选得到20个主要活性化合物(见表1)。

表1 四物汤中药物所含主要活性化合物Tab 1 Main active compounds in SWT
2.1.2 四物汤中主要活性化合物对应靶点 在TCMSP与Swiss target数据库中分别获取20个化合物潜在作用靶点,TCMSP数据库中获得14个化合物对应的192个潜在靶点,Swiss target数据库中获得14个化合物对应的143个潜在靶点,有6个化合物在两个数据库中均未获得预测靶点;所有潜在靶点去掉重复项后取合集,共得到203个潜在作用靶点。主要活性化合物与预测靶点关系网(见图1),其中黄色为中药名称缩写,橙色为主要活性化合物,绿色为预测靶点。
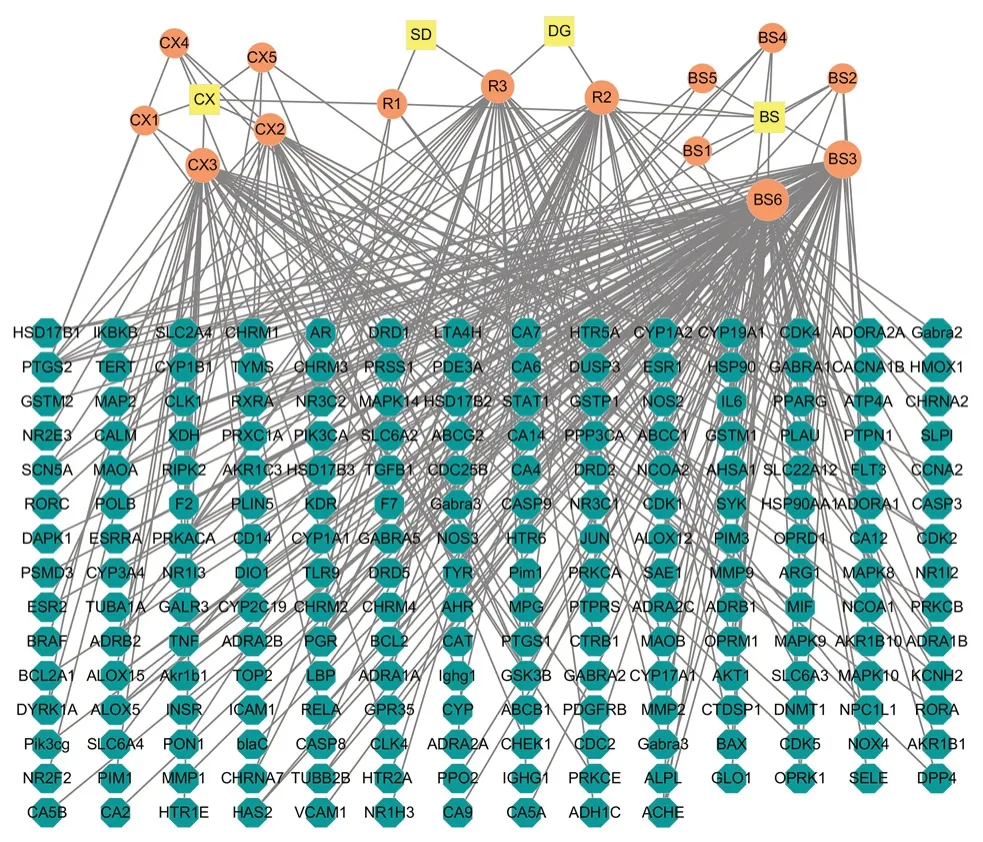
图1 主要活性化合物-靶点网络Fig 1 Major active compounds-target network
2.1.3 AS疾病相关基因 以AS为关键词,在OMIM和Drugbank数据库中进行检索查询,分别得到270个、62个靶点。在GEO数据库中选取GSE100927数据集,其中包括69个AS斑块样本和35个正常动脉组织的基因组信息,以鉴定AS和健康动脉外周动脉之间的DEGs[11]。使用GEO2R工具进行基因表达差异分析,共得到54 674个基因的表达信息,其中表达上调基因27 237个,下调基因27 437个,生成样本的基因火山图见图2:零点右侧(log2FC>0)为表达水平上调基因,零点左侧(log2FC<0)为表达水平下调基因,显著上调的基因多于显著下调的基因;红色和绿色分别代表上调基因(log2FC>1)和下调基因(log2FC<1),即相比较于正常组织的表达水平,部分基因的表达水平高于或低于正常水平2倍,灰色表示差异不显著。根据P<0.05和∣log2(fold change)∣>1标准筛选全部基因表达信息,共得到552个AS组织与正常动脉组织的DEGs。选取正常与AS动脉组织各20组样本,与∣log2(fold change)∣>1的基因中上调和下调最显著的前20个基因绘制热图(见图3)。将上述DEGs与Drugbank和OMIM数据库中筛选的AS相关基因取合集,去除重复项,得到848个AS相关的基因。

图2 GSE100927数据集中基因分布火山图(P<0.05)Fig 2 Volcano map of gene distribution in GSE100927 dataset(P<0.05)

图3 GSE100927数据集中差异表达基因聚类热图Fig 3 Heat map clustering of DEGs in GSE100927 dataset
2.1.4 四物汤防治AS的靶点 将所得四物汤主要活性化合物对应靶点与得到的AS相关基因取交集,得到四物汤防治AS的靶点共37个。山柰酚、儿茶酸、杨梅酮、川芎哚、β-谷甾醇、豆甾醇分别与22个、8个、8个、8个、7个、6个靶点相关。与四物汤主要活性化合物关系最密切的靶点是PTGS1、PTGS2、ALOX5、RXRA、F2和ESR1(见图4)。
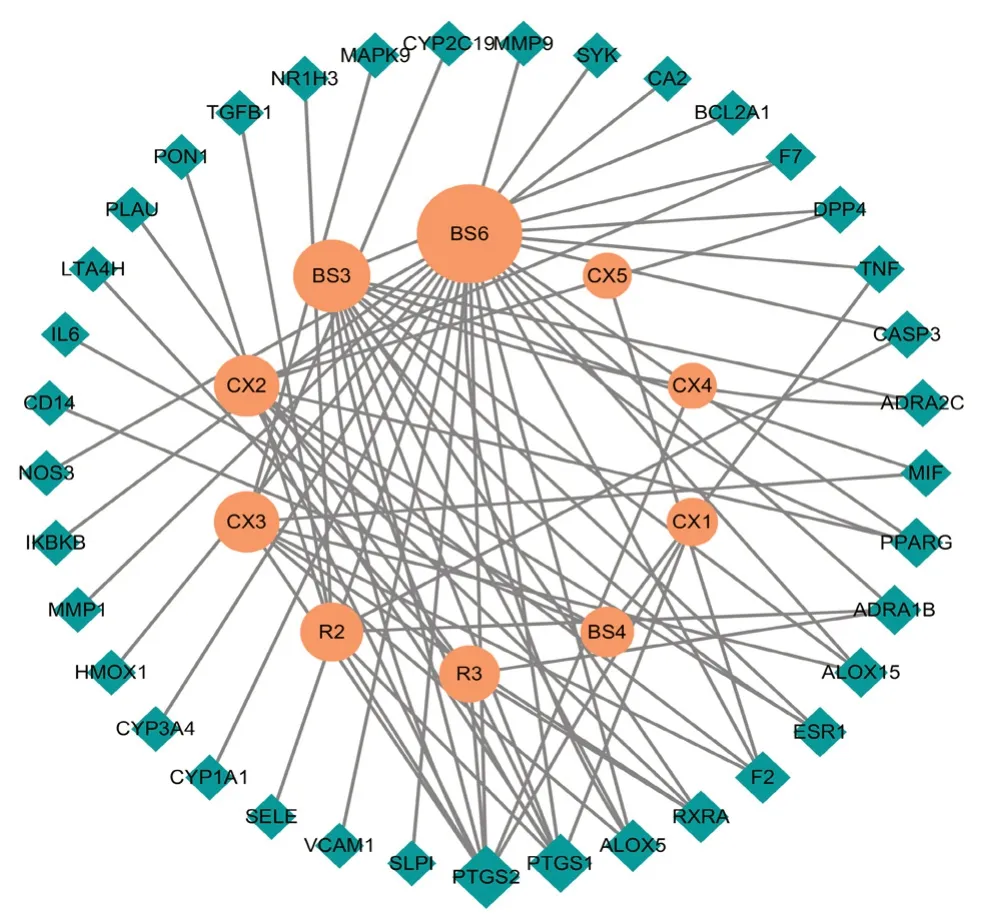
图4 预测靶点与对应的主要活性化合物Fig 4 The predicted targets and corresponding main active compounds
2.1.5 GO及KEGG通路富集分析 GO富集分析结果显示,四物汤防治AS的靶点参与影响176个BP,19个CC与33个MF,选择GO分析各部分前10条绘制柱状图(见图5);其中四物汤对BP影响主要涉及炎症反应、对血压调节、对雌激素反应等方面;对CC影响主要涉及质膜、细胞外空间和细胞外区域等方面;对MF影响主要涉及蛋白质绑定、酶绑定、蛋白质同源二聚化活动、锌离子结合、血红素结合等方面。KEGG富集分析结果显示,四物汤防治AS的靶点共涉及到51条信号通路,将KEGG富集分析的前10条通路绘制成气泡图见图6;P值从大到小在图上显示为气泡颜色从绿色到红色;气泡面积大小与通路涉及的基因数量正相关;横轴表示该条通路涉及基因占总体输入基因的比例。四物汤防治AS的靶点所参与的通路主要集中在肿瘤坏死因子(TNF)、NF-κB、非酒精性脂肪肝(NAFLD)、乙型肝炎(HBV)等通路。

图5 预测靶点的GO功能富集分析Fig 5 GO enrichment analysis of the predicted targets

图6 预测靶点的KEGG富集分析Fig 6 KEGG enrichment analysis of the predicted targets
2.1.6 PPI网络构建及分析 PPI网络共有37个节点和186个相互作用的边(见图7),网络中节点(圆形)表示由基因编码的蛋白质,边线表示两个节点间的相互作用。对于每对节点间的关联强度的评价有多维度指标(如基因融合、共表达与大规模实验的支持等),将多个维度指标计算整合形成综合评分,可以提高对节点间关联强度评价的可信度(在PPI网路图中,边线约宽,节点间关联强度约高)[12]。从图7中可以得出,根据Degree值排序,网络中最重要的5个节点分别为IL-6、TNF、PTGS2、MMP9与NOS3等。

图7 预测靶点的PPI 网络Fig 7 PPI network of the predicted targets
IL-6、TNF、PTGS2与MMP9基因编码产生蛋白均为可作为炎性标志物,提示炎症水平。NOS3基因编码产生蛋白是内皮型一氧化氮合酶(eNOS),可以调节血管张力和局部血流,抑制VSMCs细胞增殖以及调节白细胞-内皮相互作用等多种作用[13];精氨酸在eNOS催化下合成NO,NO具有多种抗AS作用,包括抑制低密度脂蛋白氧化、防止白细胞黏附血管内皮,抑制血管平滑肌细胞增殖等[14];并且NO还被认为是一种抗炎分子,其抗炎作用主要是通过抑制NF-κB 活性来抑制AS的形成[15]。根据综合评分,在以NOS3为中心的PPI网络中与NOS3节点关联强度最高的节点为ESR1,编码产生蛋白是雌激素受体α(ERα)(见图8)。为了验证四物汤对VSMCs更广泛的抗AS作用,后续验证实验对四物汤处理的VSMCs进行NO水平检测,并采用Western blot法对VSMCs的eNOS与ERα表达量进行检测。
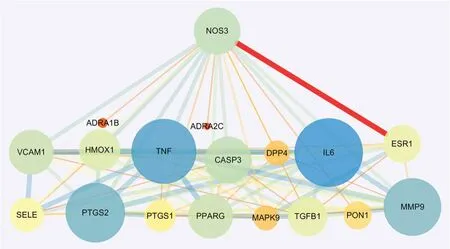
图8 以NOS3为中心的PPI网络Fig 8 A NOS3-centric PPI network
2.2 体外实验结果
2.2.1 VSMCs生长形态与表型的鉴定 光学显微镜下观察显示,VSMCs形状为梭形,平行排列,细胞生长呈“谷峰状”(见图9)。免疫荧光实验染色显示,TRITC标记的α-SMA呈红色,胞质内存在大量平行于细胞长轴的红色细丝(见图10),表明该细胞具有VSMCs的表型特征。

图9 光学显微镜下VSMCs形态与分布(20×)Fig 9 Morphology and distribution of VSMCs under light microscope(20×)

图10 α-SMA免疫荧光染色(100×)Fig 10 α-SMA immunofluorescence staining(100×)
2.2.2 四物汤冻干粉对VSMCs增殖能力的影响通过CCK8法测试了不同质量浓度的四物汤(25~1500 μg·mL-1)对VSMCs活力的影响,如图11所示,四物汤作用24 h后,对细胞增殖率无明显影响,推测在这一质量浓度范围内四物汤的处理对VSMCs生长无细胞毒性,故本实验挑选其中具有一定质量浓度差的高、中、低3个剂量(分别为1000、500、100 μg·mL-1)进行后续实验。
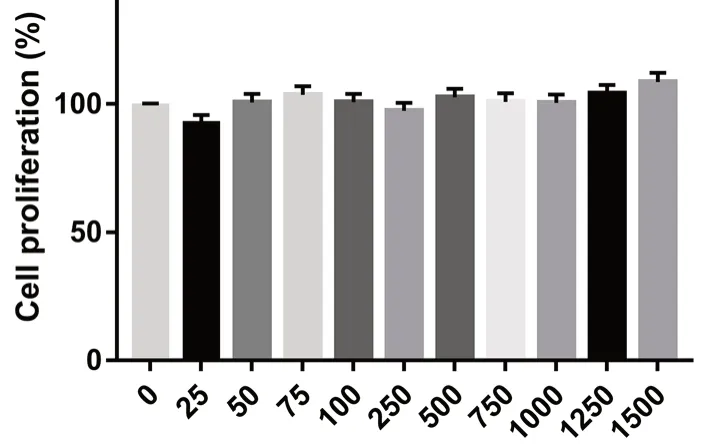
图11 四物汤对VSMCs增殖率影响(±s,n=3)Fig 11 Effect of different concentrations of Siwu decoction on VSMCs proliferation rate(±s,n=3)
2.2.3 四物汤冻干粉对ox-LDL诱导VSMCs增殖能力的影响 如图12 所示,与空白对照组相比,模型组VSMCs的增殖率显著提高(P<0.01);与模型组相比,四物汤组细胞增殖率均降低(P<0.05),对ox-LDL诱导的增殖有一定抑制作用,但三组间差异无统计学意义。

图12 四物汤对ox-LDL诱导的VSMCs增殖率的影响(x± s,n=3)Fig 12 Effect of different concentrations of Siwu decoction on ox-LDLinduced VSMCs proliferation rate(x ±s,n=3)
2.2.4 四物汤冻干粉对ox-LDL诱导VSMCs的NO水平的影响 如图13所示,与空白对照组相比,ox-LDL处理的VSMCs的NO产生水平下降(P<0.05),而高剂量与中剂量的四物汤处理VSMCs,均可明显提升ox-LDL诱导的NO水平的下降(P<0.01),并且呈现一定的浓度依赖性。

图13 四物汤对ox-LDL诱导的VSMCs中NO水平的影响(±s,n=3)Fig 13 Effect of Siwu decoction on nitric oxide levels in ox-LDLinduced VSMCs(x ±s,n=3)
2.2.5 四物汤冻干粉对ox-LDL诱导VSMCs的eNOS与ERα蛋白表达的影响 根据网络药理学分析结果,为了进一步验证四物汤对VSMCs作用的具体分子机制,通过Western blot法观察四物汤对eNOS和ERα在VSMCs中表达量的影响。如图14所示,与对照组相比,ox-LDL可以明显降低ERα、eNOS的表达量(P<0.05),这一作用在加入四物汤的处理后被逆转,并且均在四物汤剂量为500 μg·mL-1组效果最为明显。

图14 Western blot法检测VSMCs的ERα、eNOS的表达水平(±s,n=3)Fig 14 Expression level of ERα and eNOS analyzed by Western blot(±s,n=3)
3 讨论
药用植物抗AS活性主要表现为抗炎、抗氧化、降压、降脂、抗血栓等多种作用。此外,大多数药用植物的特点是其多效抗AS作用。此外,药用植物衍生的化合物具有相对安全、副作用少的特点,因此可作为抗AS的一类有效药物[16]。本研究也证实了四物汤的主要活性化合物具有此类作用。
3.1 四物汤防治AS可能涉及的主要活性化合物
通过TCMSP和GEO数据库获得四物汤干预AS的37个靶点,靶点对应的四物汤中主要活性化合物按重要程度排序为:山柰酚、儿茶酸、杨梅酮、川芎哚、β-谷甾醇、豆甾醇。其中山柰酚是一种天然类黄酮,其抗炎、抗氧化和抗肿瘤的功效已被报道用于治疗多种疾病[17];在血管内皮细胞中,还可激活血红素氧合酶1(HO-1)的表达,激活过氧化氢酶 (CAT)、超氧化物歧化酶(SOD)、谷胱甘肽 (GSH-Px)等,保护血管免受氧化应激和炎症诱导的损伤[18]。儿茶素是常见于茶类中的一种黄酮类化合物,其摄入量与减少心血管疾病成正相关[19-21];儿茶素可激活eNOS酶产生NO,以改善血管内皮功能障碍[22-23];并且儿茶素可通过抑制基质金属蛋白酶-2的表达,抑制凝血酶诱导的VSMCs的增殖[24]。杨梅酮具有良好的抗氧化及抗肿瘤等活性[25-27],并且对氧化应激诱导的血管内皮细胞凋亡有保护作用[28]。川芎哚是中药川芎、党参中的活性物质之一,川芎哚及其类似物具有一定程度的抗凝血、减少红细胞聚集、抗血栓与改善血液流变学的作用[29-31]。β-谷甾醇存在于多种中药的甾体类化合物,富含β-谷甾醇的药物在巨噬细胞中通过影响NO与活性氧(ROS)明显减少小鼠的主动脉根部AS病变面积,并且阻止人单核细胞THP-1与VSMCs的黏附[32]。
3.2 四物汤防治AS预测靶点的富集分析
对四物汤防治AS的靶点进行GO富集分析发现,主要参与的BP为对炎症反应、缺氧反应、血压调节、雌激素反应、细胞因子分泌的正调控。众多临床与基础实验都已经证实AS是一种慢性血管炎症反应,而近年来的研究也进一步证实机体免疫细胞的反应是AS斑块形成的第一步,更是动脉粥样斑块不稳定的主要原因之一[33];高血压作为AS的重要风险因素,血压升高状态下对内皮细胞损伤与促进VSMCs过度增殖在形成AS的过程中也是必不可少的[34];KEGG富集分析得到TNF、NF-κB、NAFLD、乙型肝炎、癌症转录调控失调等信号通路。对于AS进展过程中分泌的众多细胞因子的调节,也对AS的治疗有非常重要的意义。细胞因子都是通过其所在信号通路来发挥作用[35],其中TNF-α是最重要的促炎症因子之一,可以诱导ROS的产生,使内皮功能出现障碍,并转换VSMCs的细胞表型[36];同样在一个炎性因子主导的通路中,NF-κB参与激活内皮细胞黏附分子如E-选择素、血管细胞黏附分子-1(VCAM-1)等与单核细胞的黏附作用,并且转换VSMCs表型,同时巨噬细胞的黏附增多,促进AS斑块的发生[37]。
3.3 四物汤防治AS预测靶点的PPI网络
在PPI网络中,根据Degree值排序最重要的5个节点分别为IL-6、TNF、PTGS2、MMP9与NOS3等。除IL-6、TNF、PTGS2与MMP9均可编码产生炎性标志物分子外;NOS3基因编码产生的eNOS分子不仅有调节血管张力和局部血流等作用,其催化产生的NO可通过诱导和稳定NF-κB的抑制因子IκB而抑制 NF-κB的激活,从而控制黏附分子与炎症介质的表达,对AS的病理发展起到抑制作用[38]。根据对蛋白互作强度的综合评分(由基因融合、共表达与大规模实验的支持等因素综合计算),在以NOS3为中心的PPI网络中与NOS3节点关联强度最高的节点为ESR1(编码产生ERα);雌激素可以一种ERα依赖的方式快速激活MAPK通路,进而激活eNOS;并且雌激素与雌激素受体(ERs)结合,通过刺激热休克蛋白90(HSP90)和AKT/蛋白激酶B(PKB)依赖的机制激活eNOS[39]。
3.4 四物汤对ox-LDL诱导的VSMCs细胞的作用
在动物模型和人类研究中,VSMCs的增殖导致血管内膜和动脉中层斑块的生长,过度的VSMCs增殖已被证明在AS发生过程中非常重要[40]。CCK8实验发现四物汤对未经处理的VSMCs增殖无明显作用,但是在经过ox-LDL处理后,四物汤可抑制诱导后的VSMCs过度增殖,对AS的防治产生积极作用。四物汤可明显提高经ox-LDL诱导的VSMCs的NO水平,而四物汤对VSMCs增殖的抑制作用可能通过对NO水平的调节来发挥。eNOS具有抗AS的作用,eNOS表达量的升高也提示了四物汤对防治AS的积极作用;课题组前期研究提示四物汤在多个维度显示出了雌激素样作用;研究显示,雌激素和类雌激素化合物除了对eNOS作用的长期影响外,还存在对NO生物利用度的短期影响,雌激素可能通过经典雌激素核受体介导以调节eNOS的表达[41];关于四物汤是否发挥雌激素样作用调节eNOS水平,需要进一步的实验探究。由于雌激素对心血管系统具有保护作用,雌激素替代疗法已经作为临床上防治女性绝经后AS的一种方案,但是由于其伴随着妇科肿瘤发病风险的提高而一直备受争议;本研究结果提示四物汤可能作为一种雌激素样药物对AS进行防治,为药物的临床应用提供了部分实验依据。
