基于迁移芯片木蝴蝶总黄酮类对肝癌细胞迁移的影响研究
2021-11-01李楠楠包永睿郑义博王鹤辰孟宪生辽宁中医药大学药学院辽宁大连6600辽宁省组分中药工程技术研究中心辽宁大连6600辽宁省现代中药研究工程实验室辽宁大连6600辽宁中医药大学安捷伦现代中医药多组学研究合作实验室辽宁大连6600
李楠楠,包永睿,2,3,4,郑义博,王鹤辰,孟宪生,2,3,4*(. 辽宁中医药大学药学院,辽宁 大连6600;2. 辽宁省组分中药工程技术研究中心,辽宁 大连 6600;3. 辽宁省现代中药研究工程实验室,辽宁 大连6600;4. 辽宁中医药大学-安捷伦现代中医药多组学研究合作实验室,辽宁 大连 6600)
木蝴蝶为紫葳科植物木蝴蝶Orozylum indicum(L.)Vent.的干燥成熟种子,具有清肺利咽,疏肝和胃的功效[1]。黄酮是木蝴蝶的主要成分,具有抗炎、抗氧化、抗肿瘤等多种药理作用[2-4]。微流控芯片(microfluidic chip)具有微量化、超高通量化、集成化等优点,广泛应用于生命科学、疾病诊断与治疗、药物筛选等领域[5-7]。本研究应用微流控芯片技术研究木蝴蝶总黄酮类成分在体外对肝癌细胞转移的抑制作用,不仅为木蝴蝶作为抗肝癌药物的研究奠定基础,也为中药抗肿瘤药物的体外药理学研究提供新的方法。
1 材料
1.1 仪器
TG-2U型光刻机(北京中科同志科技有限公司);LSP04-1A精密注射泵(保定兰格公司);ECLIPSE-TI 倒置荧光显微镜(日本NIKON 公司);RT-PCR(Piko Thermol公司);通用电泳仪(美国BD公司);直拉单晶抛光硅片(哈尔滨特博科技有限公司)。
1.2 试药
木蝴蝶药材购自大连同仁堂药房,经辽宁中医药大学翟延君教授鉴定为Orozylum indicum(L.)Vent.的干燥成熟种子;木蝴蝶总黄酮(由本实验室制备,经紫外分光光度计测定纯度大于90%)。10%胎牛血清、1%青链霉素、DMEM培养基(美国GIBCO公 司);TRlzol Reagent(美国Life公司);RIPA裂解液(美国ambion公司);RT-PCR试剂盒、PMSF蛋白酶抑制剂、磷酸酶抑制剂(北京全式金生物技术有限公司);SDS-PAGE凝胶快速配置试剂盒、飞克特超敏ECL发光液(大连美仑生物科技有限公司);抗体Anti-p38 MAPK phosphor(Thr180/Tyr182)(美国Arigo公司);抗体p38 MAPK、β-actin(美国Proteintech公司)。
1.3 细胞株
人肝癌细胞HepG2,由中国科学院典型培养物保藏委员会细胞库提供。
2 方法
2.1 细胞培养
按常规贴壁细胞培养法接种于含体积分数为10%胎牛血清、1%青链霉素的DMEM培养基中,在37℃、5%CO2、饱和湿度的条件下常规培养。隔日换液、传代,取对数生长期细胞做后续实验。
2.2 药品的配制
取适量木蝴蝶总黄酮,用DMEM培养液溶解,配制成1.0 mg·mL-1含药培养液,过 0.22µm 微孔滤膜,4℃保存,备用。
2.3 芯片的设计及制作
基于实验室较为成熟的芯片制作工艺,采用软光刻法[8-9]制作阳模,采用浇注法[10]将弹性材料聚二甲基硅氧烷(PDMS)浇注于阳模上形成芯片的阀层及通道层,最后采用氧等离子不可逆键合的方法[11]将PDMS结构与载玻片键合在一起形成PDMS-玻璃复合型芯片即“迁移芯片”。该芯片由上至下分别为阀控层、通道层和玻璃层,包括3个培养液入口,3个阀控液体入口,2个细胞入口,8个废液流出口。
2.4 芯片中细胞培养及给药
取对数生长期的人肝癌HepG2细胞,用0.25%的胰酶消化后,用100 μL培养液制成单细胞悬液。先通入阀控液体,再通过微量注射器将细胞从芯片的细胞注入口注入,37℃培养箱中静态培养,待细胞贴壁。培养12 h后使用精密注射泵以0.2 µL·min-1的流速向芯片中通入培养液,继续流动培养24 h。将液阀关闭,使用精密注射泵以0.2 µL·min-1的流速向芯片中通入药物,给药作用48 h,用显微镜在迁移区域拍照,用IPP软件进行细胞计数[12],按照下面公式计算相对迁移率并进行统计学分析。相对迁移率(%)=(实验组迁移细胞数/空白组迁移细胞数)×100%。
2.5 孔板划痕实验
取对数生长期的人肝癌HepG2细胞,PBS清洗,0.25%的胰酶消化,调整细胞浓度为5×104个·mL-1,接种于6孔培养板,每孔1 mL,继续培养24 h待细胞贴壁完全。使用1 mL枪头在每组孔底部划出“一”字形划痕,然后弃去细胞培养液,使用PBS清洗3次,设空白对照组(加细胞,但不加药物)、木蝴蝶总黄酮组(TF组,药物干预48 h),用显微镜在迁移区域拍照。
2.6 PT-PCR法实验
将处于对数生长期的人肝癌HepG2细胞接种于6孔板中,木蝴蝶总黄酮干预48 h 后消化收集细胞,TRIzol法提取总RNA[13]。应用RT-①PCR试剂盒明书操作,将总RNA逆转录成第一链cDNA并合成目的基因。引物序列如下:①β-actin:F 5'-TGCTGTCCCTGTATGCCTCT-3',R 5'-TTTGATGTCACGCACGATTT-3'; ②p38:F 5'-CGGCACACTGATGACGAAAT-3',R 5'-CAACGTTCTTCCGGTCAACA-3'。
2.7 Western blot实验
取对数生长期人肝癌HepG2细胞接种于6孔板中,木蝴蝶总黄酮干预48 h后消化收集细胞,加入RIPM、PMSF、磷酸酶抑制剂裂解提取总蛋白。采用NanoDrop 5000 BSA法测定蛋白浓度,PBS缓冲液调整使各组蛋白终浓度相同。采用SDS-PAGE法,5%浓缩胶和8%分离胶,在100 V电压下浓缩30 min,调节电压120 V电泳分离蛋白质,在160 V电压下转膜1 h,取出PVDF膜用BSA溶液室温摇床封闭2 h。封闭结束后,将PVDF膜在一抗(5%BSA按照1∶500进行稀释)、二抗(5%BSA按照1∶5000进行稀释)中孵育,TBST摇床清洗,ECL法进行显色,采用Image J软件分析条带灰度值[14],计算各组蛋白质的相对表达量。
2.8 统计学分析
应用SPSS 19.0和GraphPad Prism 5软件进行统计学处理,实验结果以±s表示,多样本均数间比较采用单因素方差分析,P<0.05说明差异具有统计学意义。
3 结果
3.1 迁移芯片
根据实验需求,本课题组设计一种用于研究药物对细胞迁移影响的芯片——PDMS-玻璃复合芯片,设计图及芯片实物图见图1。该芯片包括三层:PDMS阀层,通入液体作为液阀,可控制通道的开合,调节细胞和液体的流向;PDMS通道层,可作为细胞或液体的通道;玻璃层,用于细胞贴壁。采用氧等离子不可逆键合而成,其中细胞注入口、药物注入口、废液口等位置如图1所示。

图1 迁移芯片的结构示意图(A)和实物图(B)Fig 1 Schematic diagram(A)and physicalmap(B)of the microfluidic chip
3.2 基于迁移芯片木蝴蝶总黄酮类对人肝癌细胞HepG2迁移的影响
如图2所示,关闭液阀前,即给药0 h时,HepG2细胞在细胞培养通道呈贴壁生长,细胞形态呈梭形,胞质透明,生长状态良好;关闭液阀后,细胞培养腔与相邻通道相通,继续培养24 h后,空白组细胞向相邻通道生长,木蝴蝶总黄酮也有少量细胞向相邻通道迁移生长,但是迁移率较低。木蝴蝶总黄酮组24 h、48 h相对迁移率分别为16.59%、8.06%,与空白组比较差异均有统计学意义(P<0.01)。说明木蝴蝶总黄酮能很好地抑制肿瘤细胞迁移。

图2 HepG2细胞在芯片中的迁移状态(A,100×)和迁移统计结果(B)Fig 2 Migration of HepG2 cells in the chip(A,100×)and statistical data of the cell migration(B)
3.3 基于划痕实验木蝴蝶总黄酮类对人肝癌细胞HepG2迁移的影响
如图3所示,给药0 h时,各组HepG2细胞在孔板底部呈贴壁生长,细胞形态呈梭形,胞质透明,生长状态良好。培养24 h后,空白组细胞向划痕空白处迁移生长,划痕“伤口”变小;木蝴蝶总黄酮组部分发生皱缩,细胞变圆,但是并未向划痕空白处迁移生长,划痕“伤口”无变化。培养48 h后,空白组划痕空白密布肝癌细胞,“伤口”几乎愈合;TF组细胞大部分发生皱缩、变圆,部分细胞已死亡、悬浮于培养液中,但是并未向划痕空白处迁移生长,划痕“伤口”无变化。说明木蝴蝶总黄酮具有显著抑制肿瘤细胞迁移的作用。

图3 划痕实验各组HepG2细胞迁移状态图(100×)Fig 3 Migration of HepG2 in each group of scratch test(100×)
3.4 木蝴蝶总黄酮对相关基因和蛋白质表达的影响
采用RT-PCR法和Western blot法检测相关基因和蛋白质的变化,由图4可知,木蝴蝶总黄酮能降低p38 mRNA和蛋白质的表达(P<0.05),能降低p-p38蛋白质的表达(P<0.01)。
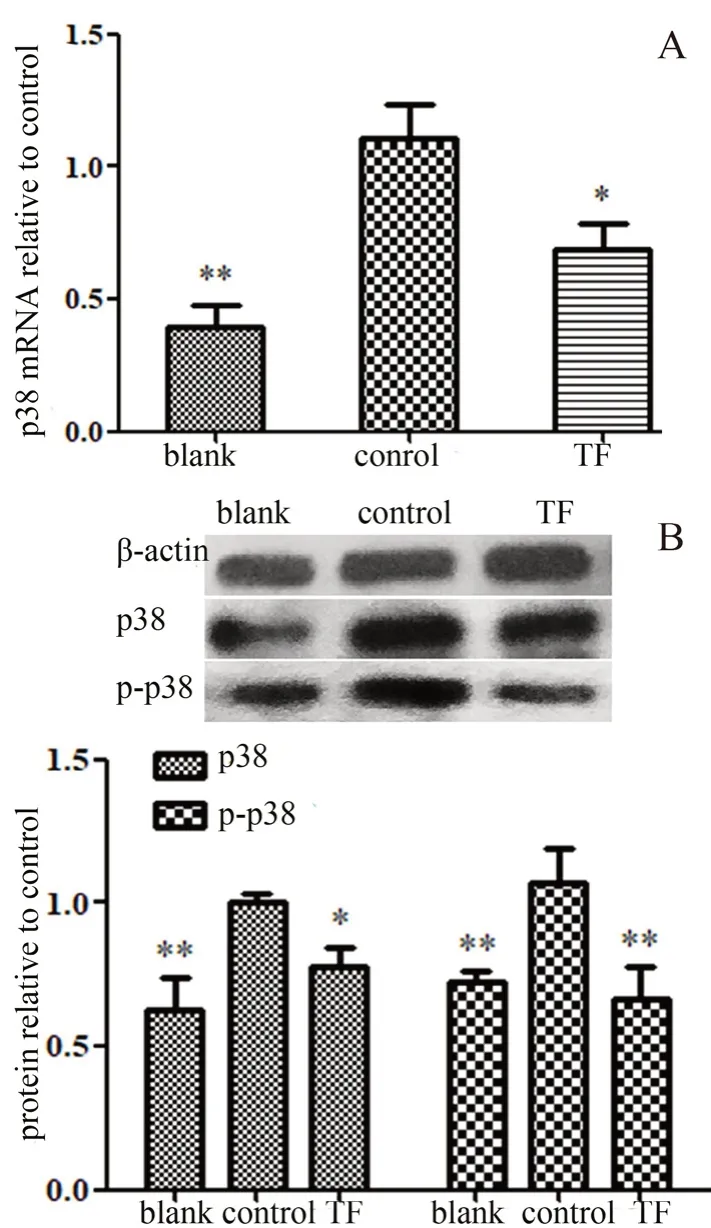
图4 木蝴蝶总黄酮对HepG2细胞中p38 mRNA(A)和p38蛋白质(B)相对表达量的影响(n=3,±s)Fig 4 Effect of TF on p38 mRNA expression(A)and protein expression(B)of HepG2 cells(n=3,±s)
4 讨论
本研究基于实验室成熟的芯片制作工艺,设计并制作了用于研究细胞迁移的微流控芯片,即迁移芯片。该芯片由阀层、通道层、玻璃层组成,阀层和通道层上下对应,是模拟传统孔板划痕迁移实验。当上层阀层中通入液体后,由于压力的作用,PDMS会发生弹性形变,通入液体的通道将下压,与下层通道层中对应的通道重合,将其与通道层中细胞流入通道阻断,即造成“划痕”,向通道层中细胞通道通入细胞悬液,待细胞贴壁后,将液阀关闭,此时细胞与相邻的通道相连接,细胞则可向空白通道处迁移生长。为防止使用时通道塌陷,本课题组在芯片中间加入长椭圆形的支撑结构,使该芯片可重复多次使用。该芯片通过阀控装置来模拟“划痕”,并且这种划痕不会对细胞造成机械性损伤,更接近癌细胞在体内的转移过程。为了验证该芯片的适用性,本研究同时使用传统的划痕法进行验证。划痕法实验结果与微流控芯片结果均说明木蝴蝶总黄酮具有很好的抑制肿瘤细胞迁移的作用,具有进一步研究的价值。同时也说明微流控芯片法可以替代孔板内进行的迁移研究实验,并存在简单、快捷的优势。
MAPK即丝裂原活化蛋白激酶(mitogenactivated protein kinase)是一系列与肿瘤发生和发展相关的细胞过程的调节者,包括细胞的增殖、转移、分化、凋亡、存活和耐药性等[15-16]。p38是MAPK激酶中的一种,与癌症具有很大的相关性[17]。Dalasanur等[18]的研究表明,在乳腺癌中激活的p38可以促进癌细胞的增殖和转移。本研究结果表明木蝴蝶总黄酮能降低p-p38蛋白质的表达,即减少p38的活化,说明木蝴蝶总黄酮能抑制p38活化,抑制细胞增殖和转移,从而发挥抗肝癌作用。
综上所述,本研究结果表明木蝴蝶总黄酮具有明显的体外抑制肿瘤细胞迁移的作用,其发挥作用的机制可能与抑制p-p38蛋白质的表达,减少p38的活化有关。
