IOOSR评价实验室稳定性的应用
2021-11-01张丽君马路萍冯德杰刘晨鸣刘晓凡
张丽君, 石 岩, 马路萍, 冯德杰, 刘晨鸣, 刘晓凡
(兰州生物制品研究所有限责任公司质量保证部,兰州 730046)
0 引 言
检测结果超出可接受标准(Out of specification,OOS)概念最早源于1992 年美国食品和药物管理局(US Food and Drug Administration,FDA)对美国基因公司BAAR提出的诉讼[1],FDA指控该公司实验室采用了不合理检验以达到放行产品的目的。随后美国对此类现象进行了更深入研究,包括标准制定,警戒线的制定等。在2006 年,美国FDA 发布了《药品生产企业OOS调查指导原则》[2],指导OOS 结果的调查流程以及所有检测结果的最终评价。在2010 年,世界卫生组织(World Health Organization ,WHO)发布了《药品质量控制实验室良好操作规范》[3],提到质量管理部应建立OOS的操作规程。同年,中国修订的《药品生产质量管理规范》[4]中也引入了OOS概念。国外的专家和学者一直致力于深入系统地研究OOS 以及OOT(Out of tend,OOT)和OOE(Out of Expectation,OOE)问题[5-6]。这也被广泛应用于国外医药企业和国家监管机构(National Regulation Administration,NRA),成为医药企业质量控制必不可少的一环。在2016 年,FDA发布的《质量量度指南》[7]中要求医药企业提交无效的OOS 率(Invalidated Out of Specification Rate,IOOSR),以此用来衡量质量控制(Quality control,QC)实验室的稳定可靠性,从而达到监管放行产品质量的目的。FDA对医药企业实施检查时,会对IOOSR高的企业进行警告。2017 年FDA 发布的警告信中就包含了对印度2 家制药商的警告,IOOSR分别高达75%和72%。我国虽然在2010 年就引入了OOS 概念,但各地方的医药企业的OOS 管理和调查水平不平衡[8]。随着2015 年数据可靠性在国内医药行业掀起了热潮,NRA和医药企业对OOS 的关注度在近几年也得到大幅提高,但大部分停留在常见的OOS问题分析和调查流程的研究[9-11]。近年也有学者探究OOS 标准的制定[12-13]以及如何降低OOS 的发生[14],但对于质量控制实验室的稳定性以及IOOSR 的研究和应用还处于空白阶段。本文应用IOOSR 分析质量控制实验室OOS数据,并探索出了IOOSR评价实验室稳定性的实际运用方法。
1 实验方法
(1)资料来源。数据收集于兰州某医药公司。收集了该企业QC实验室在2018 ~2020 年(统计数据至2020 年11 月2 日)发生的所有OOS报告数据。
(2)分析方法。将所有OOS报告数据进行甄别分析,统计范围为FDA《质量量度指南》(2016 版)[7]中要求的批放行检验OOS 数据和长期稳定性试验检测OOS数据。根据每例OOS 报告数据调查结论和处理结果按以下方法进行分类:有效OOS (validated Out of Specification,VOOS);QC 实验室无过失,以不合格结果发出报告,进入生产过程调查;无效OOS(Invalidated Out of Specification,IOOS);因QC 实验室检验过程(包括检验设施)过失判定不合格结果无效。
(3)IOOSR 计算公式。IOOSR =[IOOS 例数/(VOOS例数+IOOS例数)]× 100%。
(4)OOS报告流程。①实验室结果为OOS ;②实验员和QC负责人对实验过程进行评估,有明显过失,判为IOOS;无明显过失,进入实验室初步调查;③实验室初步调查发现实验室过失,判为IOOS;未发现实验室过失,进入实验室深入调查;实验室初步调查确认实验室无过失,判为VOOS;④实验室深入调查发现实验室过失,判为IOOS;未发现实验室过失,进入生产过程调查;实验室深入调查确认实验室无过失,判为VOOS;⑤生产过程调查发现过失,判为VOOS;未发现过失,进入实验室全面调查;⑥实验室全面调查发现过失,判为IOOS;未发现过失,判为VOOS。
(5)IOOS原因分类。设备IOOS 包括由检测设备和检测用计算机系统故障或异常引起的IOOS;操作IOOS包括由人员操作和操作流程不合理引起的IOOS;耗材IOOS包括由检测用一次性耗材和检测用物料引起的IOOS;异常IOOS 包括由停电和环境发生的突发情况引起的IOOS。
2 结 果
2.1 2018 ~2020 年间OOS例数统计分析
2018 年批次放行检验项目中,共19 例OOS报告,其中IOOS 有4 例,VOOS 有15 例。2019 年批次放行检验项目中,IOOS有13 例,VOOS有10 例,共23 例。2020 年批次放行检验项目中,IOOS 有14 例,VOOS 有11例,共25 例(见表1)。OOS 报告逐年平稳增加,其中2019 年和2020 年,相较于2018 年,IOOS报告显著增加,VOOS报告成减少趋势(见图1)。

表1 2018 ~2020 年QC实验室的OOS报告情况
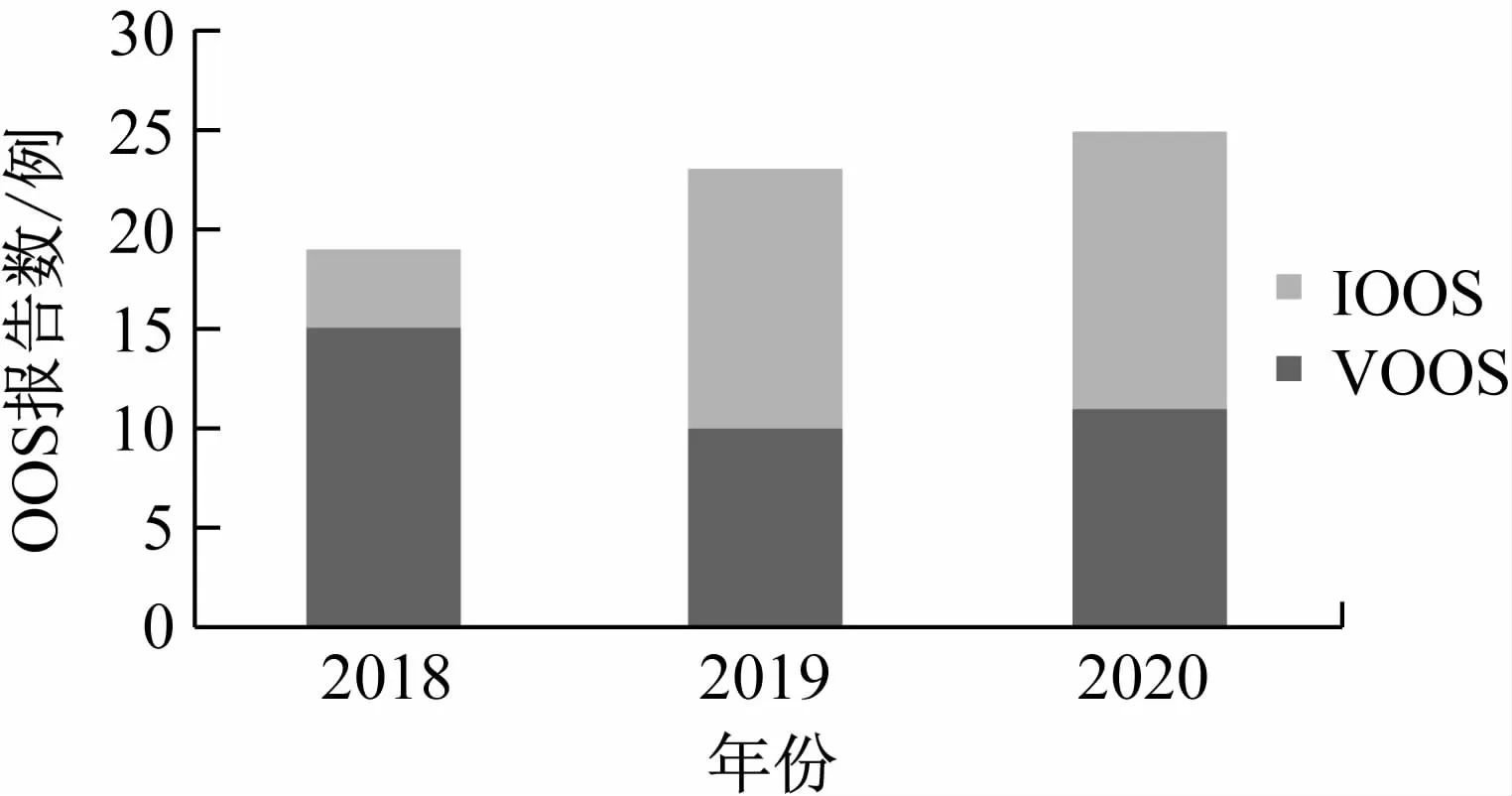
图1 2018 ~2020年QC实验室的IOOS和VOOS情况
2.2 2018 ~2020 年IOOSR
根据2018 ~2020 年的OOS 例数统计结果,计算出2018 年的IOOSR 为21.05%,2019 年的IOOSR 为56.52%,2020 年的IOOSR 为56.00%。2019 年的IOOSR较2018 年显著提高,2020 年IOOSR与2019 年相对持平(见图2)。
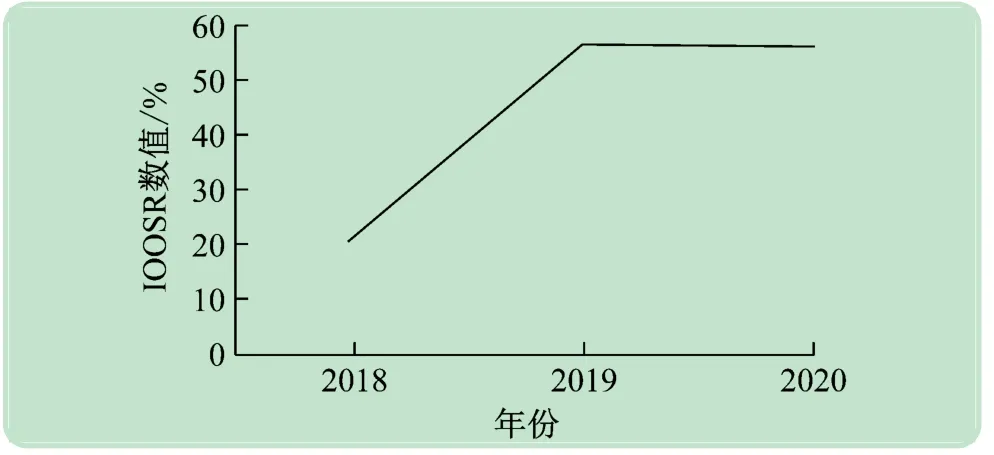
图2 2018 ~2020年QC实验室IOOSR变化
2.3 IOOS原因分布
2018 年有1 例设备IOOS,2019 年有7 例设备IOOS,2020 年有6 例设备IOOS。2018 年和2019 年有3 例操作IOOS,2020 年有4 例操作IOOS。2019 年有1例耗材IOOS和2 例异常情况IOOS。2020 年有3 例耗材IOOS和1 例异常情况IOOS,见表2。由图3 可见,操作IOOS在2018 ~2020 年基本持平。设备IOOS 和耗材IOOS在2019 年激增,2020 年依然处于高报告水平。2019 年和2020 年相较于2018 年,还增加了异常情况IOOS。可以看出2019 年和2020 年相较于2018年,QC 实验室的设备耗材处于不稳定状态。3 年来QC实验室操作处于稳定状态。
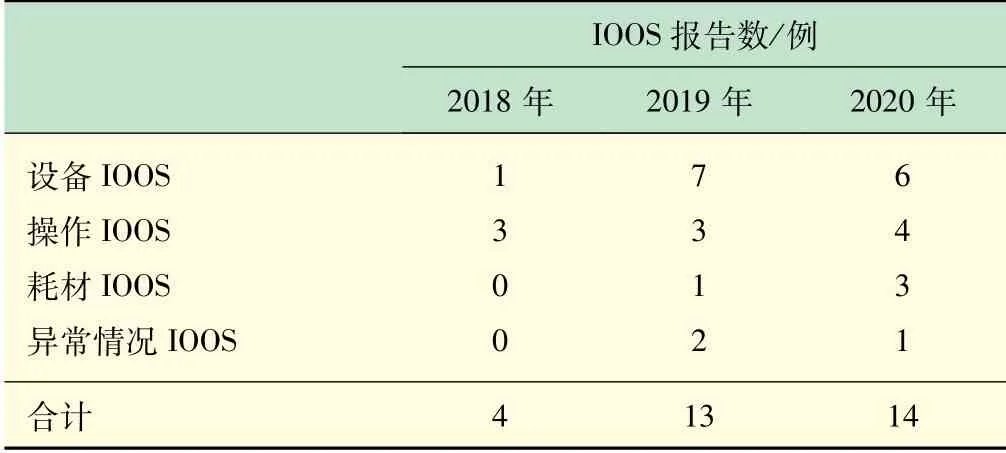
表2 2018-2020 年QC实验室的IOOS报告情况
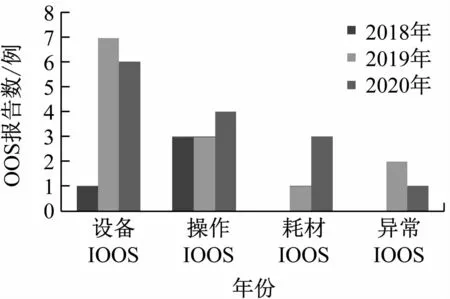
图3 2018-2020年间QC实验室IOOS变化
3 讨 论
由以上结果可以看出,2019 年和2020 年的设备IOOS是造成实验室不稳定的主要原因。设备IOOS报告例数的激增主要是因为在2018 年大多设备故障或异常是不报告OOS 处理,而是按照偏差进行处理的。按照IOOSR的计算方法,设备故障或异常按偏差流程报告的做法无疑规避了对实验室检测设备的评估,这对QC实验室的整体评估是不全面的。FDA《质量量度指南》(2016 版)[7]中明确规定了IOOS是包括由实验设施引起的OOS,这种统计方法也将实验室的评估工作进一步科学化和宏观化,使管理者不仅需要对人员操作进行关注,也需要更多地关注实验室的各个要素,其中就包括非常重要的实验室要素——检测设备的状态。2019 年和2020 年造成设备IOOS 增加主要原因有部件老化,清洗不到位造成的部件堵塞,设备电压不稳,部件效能下降,新设备部件异常等。针对这些造成IOOSR高的问题,应进行关注和改进。实验室具体改进的方法可结合PDCA 循环,例如持续提高对检测设备的核查频率和核查强度,规范和纸质化设备清洁和保养工作,采购外部电力装置保证设备正常运行,延长设备验证周期等。
耗材IOOS 也是造成实验室高IOOSR 的原因之一。实验耗材种类繁多,用量不大,价格低,且大多为一次性产品。对实验类耗材质量的控制往往不会像对生产用耗材质量控制那么严格。而如何对实验类耗材进行质量控制,这在国内外也是一个空白领域。实际上,对实验类耗材的质量控制也有着非常多的困难。①大多耗材是国外生产商,通过国内经销商进行采购,采购数量少且总价值低,对国外的生产商进行供应商审计是不太现实的。②有些检测耗材是具有指定的供应商,且为唯一供应商,这种情况下就会使实验室非常被动地接受该耗材带来的所有不稳定性。③大多一次性耗材是无法用外观检查来判断其是否可以满足实验要求的。综上,消除或减少耗材IOOS 为实验室带来的不稳定性是有一定困难的,希望可以有更多的研究和行业指南来指导如何减少耗材IOOS 的产生。
2019 年和2020 年的高IOOSR,还因为增加了对异常情况IOOS的统计。在2018 年,实验室检测异常情况,包括停电、客观环境等异常情况,基本上都是按偏差进行处理。在2019 年以后,将已经开始检测流程的异常情况基本全部按照OOS进行处理,这也就无形中增加了IOOS。这与检测设备IOOS 情况不同,因为有些异常情况并不是实验室不稳定引起。偏差和OOS之间因没有明确的界限而引发了很多讨论,实际上OOS也是偏差的一种[15-16]。但如果将IOOSR 作为评价QC实验室的一个关键指标的话,那么异常情况OOS应该进行详细划分,例如停电事件,如果是全公司停电或者大范围停电,应该按照偏差进行处理,可以发起一例偏差,涵盖本次停电引发的所有异常情况,包括QC检测异常;也可以由QC 发起一例偏差,涵盖本次停电引发的所有检测异常情况。如果仅是QC 实验室或者QC 实验室某一检测间的停电事件,应按照OOS进行调查,甄别分析为IOOS,用以计算IOOSR 准确反映QC 实验室整体包括电路等硬件设备的稳定性。
4 结 语
本文将IOOSR 应用到实际工作中,可以看出IOOSR确实是衡量实验室稳定性的一个有效指标,并且可以持续助力实验室各要素的优化。其中对偏差和OOS界限的规范划分是准确计算IOOSR 的前提。并且值得注意的是IOOSR是有计算范围的,仅包括批放行检验和长期稳定性试验OOS 数据,而不包括科研、验证和加速稳定性试验类OOS[7]。阶段性的计算分析实验室的IOOSR,可清晰反映实验室当前实际情况,并为实验室下一阶段的持续改进提供依据和方向。
