血清分泌型丝氨酸蛋白酶抑制剂Kazal 1型对浸润性肺腺癌的诊断价值
2021-11-01林帅东续力云陆畅畅石邈黄燕燕乐涵波
林帅东 续力云 陆畅畅 石邈 黄燕燕 乐涵波
分泌型丝氨酸蛋白酶型抑制剂Kazal 1(serine protease inhibitor kazal type 1,SPINK1)是一种大小为6.2 KDa的丝氨酸蛋白酶分泌抑制剂,最初分离于卵巢癌患者尿液,又名肿瘤相关组织抑制剂(tumor associated tissue inhibitor,TATI)[1]。此后,SPINK1 被发现过表达于多种肿瘤,如乳腺癌、卵巢癌、前列腺癌等[2-3]。SPINK1的结构与表皮生长因子(epidermal growth factor,EGF)相似,可通过激活EGFR/MAPK信号通路刺激肿瘤细胞增殖从而影响肿瘤进展,还可促进上皮-间充质转换(epithelial-mesenchymal transition,EMT)参与肿瘤转移[4-8]。
目前有多项研究对血清、肿瘤组织以及尿液进行了分析,发现了SPINK1作为生物标志物的潜在价值[3]。然而,SPINK1在肺腺癌患者血液中的表达情况如何尚不清楚。因此,笔者通过测定肺腺癌患者血清SPINK1浓度,分析其与癌组织SPINK1蛋白表达水平的相关性以及其与临床病理特征之间的关系,探讨其作为血清标志物对浸润性肺腺癌的潜在诊断价值,现报道如下。
1 对象和方法
1.1 对象 收集2014年1月至2019年12月在浙江大学舟山医院接受肺叶切除手术或肺楔形切除手术的153例肺腺癌患者的术前血液样本及手术标本,患者男55例,女98例,平均年龄56.2岁;其中原位腺癌38例,微浸润性腺癌39例,浸润性肺腺癌76例。选择同期本院健康志愿者28例血液样本,志愿者男10例,女18例,平均年龄55.7岁。两组受试者性别、年龄比较差异均无统计学意义(均P>0.05)。本研究经本院医学伦理委员会批准,所有对象均知情同意。
1.2 方法 两组受试者均采集清晨空腹血2 ml。采血后立即离心,分离血清,保存于-80°C冰箱备用。
1.3 血清SPINK1浓度的检测 采用ELISA法。按ELISA试剂盒(Human SPINK1 Duoset,R&D system,USA)说明书操作。将所有稀释的样品和标准品加入孔中,室温下孵育2 h,弃上清液,用洗涤缓冲液洗小孔3次,洗涤完毕后加入已稀释的SPINK1抗体,室温孵育2 h。再次用洗涤缓冲液洗3次,每孔加入100 μl稀释的辣根过氧化物酶,室温孵育20 min。用洗涤缓冲液洗3次后每孔中加入100 μl底物,室温避光孵育20 min,加反应终止液终止反应,上机检测450 nm处吸光度,根据标准曲线公式计算每个小孔中的SPINK1浓度。所有检测的血清样本以及标准样本和空白对照均重复检测3次。
1.4 肺腺癌患者癌组织及癌旁组织中SPINK1 mRNA的检测 采用荧光定量PCR法。将肺组织放入研磨器中,按照重量体积1∶9的比例加入1×PBS缓冲液,充分研磨后按4℃、3 000r/min、15 min离心,弃上清液,加入1 ml Trizol液并充分混匀后提取RNA。以提取的RNA为模板进行反转录,产物即cDNA,放于-20℃备用。采用SYBR Green Realtime PCR Master Mix(Applied Biosystems)进行 qRT-PCR,并在 ABI 7500(Thermo,Waltham,MA) 按以下条件下运行:95 ℃10 min,然后在95℃ 15 s变性,60℃ 1 min退火,72℃ 15延伸的40个循环中运行。末次循环后行熔解曲线检测反应产物单一性。SPINK1引物序列如下,上游引物:5'-ATATGACCCTGTCTGTGGGAC-3',下游引物:5'-CAGCAAGGCCCAGATTTTTGA-3',扩增的基因片段长度为114 bp。以GAPDH为内参,采用2-ΔΔCT法计算SPINK1 mRNA的表达水平。
1.5 肺腺癌患者癌组织及癌旁组织SPINK1蛋白表达检测 采用免疫组织化学染色法。每个手术切除的组织样本经多聚甲醛溶液固定、石蜡包埋,连续切取4个4 μm厚切片。经如下步骤:脱蜡、封闭、抗原修复,滴加小鼠抗人SPINK1单克隆抗体(Abcam)、冲洗、滴加生物素二抗、冲洗、显色。在染色过程中,以磷酸盐缓冲液代替原代抗体的切片作为阴性对照。由2位病理科副主任医师评价免疫反应染色强度(stainingintensity,si)和阳性细胞百分比(positivepercent,pp),并对染色结果进行评分。si评分:0分为未见阳性细胞,1分为细胞阳性染色最强处呈现弱阳性,2分为阳性,3分为可见强阳性染色的细胞。pp评分:0分为无染色阳性区域,1分为阳性染色区域≤10%,2分为阳性染色区域11%~50%,3分为阳性染色区域51%~80%,4分为阳性染色区域>80%。免疫组化染色得分=si分值×pp分值。最后按照得分分为高表达组(7~12分)与低表达组(0~6分)。
1.6 统计学处理 采用SPSS 18.0统计软件。计量资料以表示,组间比较采用两独立样本t检验。计数资料组间比较采用χ2检验。血清SPINK1浓度与癌组织SPINK1 mRNA表达水平的关系分析采用Pearson相关;浸润性肺腺癌的预测因素分析采用单因素及多因素logistic回归;通过绘制血清SPINK1以及癌胚抗原(CEA)的ROC曲线,评价血清SPINK1对浸润性肺腺癌的诊断价值。P<0.05为差异有统计学意义。
2 结果
2.1 肺腺癌患者与健康志愿者血清SPINK1浓度的比较 浸润性肺腺癌患者血清SPINK1浓度为(1 868±105.5)pg/ml明显高于健康志愿者的(842.0±70.36)pg/ml、原位腺癌的(966.2±75.18)pg/ml、微浸润性腺癌的(1 076±60.40)pg/ml,差异均有统计学意义(均 P<0.01);而原位腺癌、微浸润性腺癌患者与健康志愿者间比较差异均无统计学意义(均P>0.05)。
2.2 血清SPINK1浓度与肺腺癌组织SPINK1 mRNA水平的相关性分析 血清SPINK1浓度与癌组织SPINK1 mRNA表达水平呈正相关(r=0.277,P=0.014),见图1。以肺腺癌患者血清SPINK1浓度的平均值1 419 pg/ml为临界值,分为血清SPINK1高浓度组71例和低浓度组82例,对比两组患者癌组织SPINK1蛋白表达水平,结果发现,血清SPINK1低浓度组在SPINK1蛋白低表达组中上占29%,高浓度组在SPINK1蛋白低表达组中上占17%,血清SPINK1低浓度组在SPINK1蛋白高表达组中上占13%,高浓度组在SPINK1蛋白高表达组中上占41%,差异有统计学意义(P<0.05),见图2。典型患者肺腺癌组织和相应癌旁组织SPINK1蛋白表达见图3。
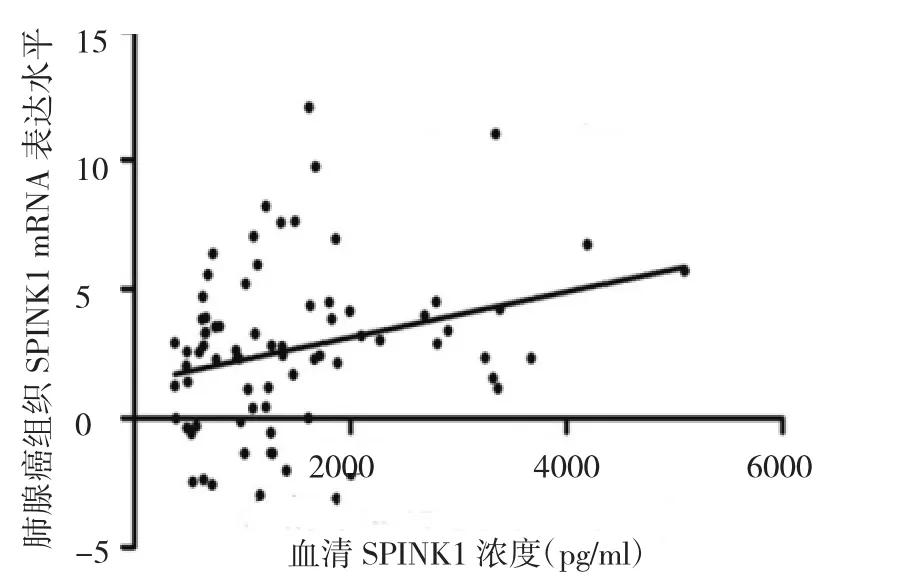
图1 血清分泌型丝氨酸蛋白酶型抑制剂Kazal 1(SPINK1)浓度与癌组织SPINK1 mRNA表达水平的散点图
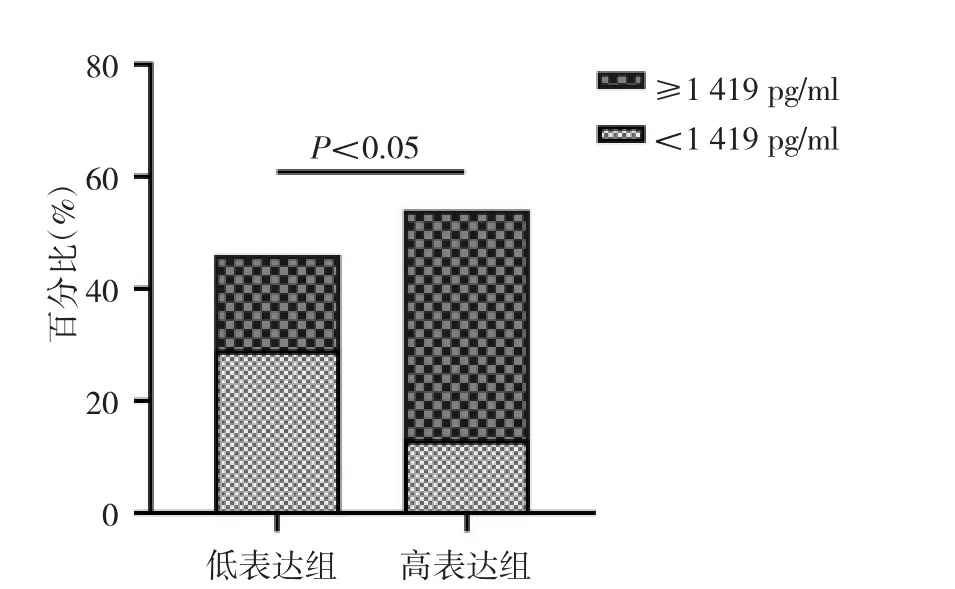
图2 血清分泌型丝氨酸蛋白酶型抑制剂Kazal 1(SPINK1)高浓度组与低浓度组患者癌组织SPINK1蛋白表达水平比较

图3 典型患者免疫组织化学染色病理检查图(a:肺腺癌组织;b:相应癌旁组织;×200)
2.3 肺腺癌患者血清SPINK1浓度与临床病理特征的关系 高浓度组与低浓度组患者在性别、年龄、吸烟史、淋巴结转移和胸膜侵犯间比较差异均无统计学意义(均P>0.05),而在病理类型、肿瘤大小以及 TNM分期间比较差异均有统计学意义(均P<0.05),见表2。
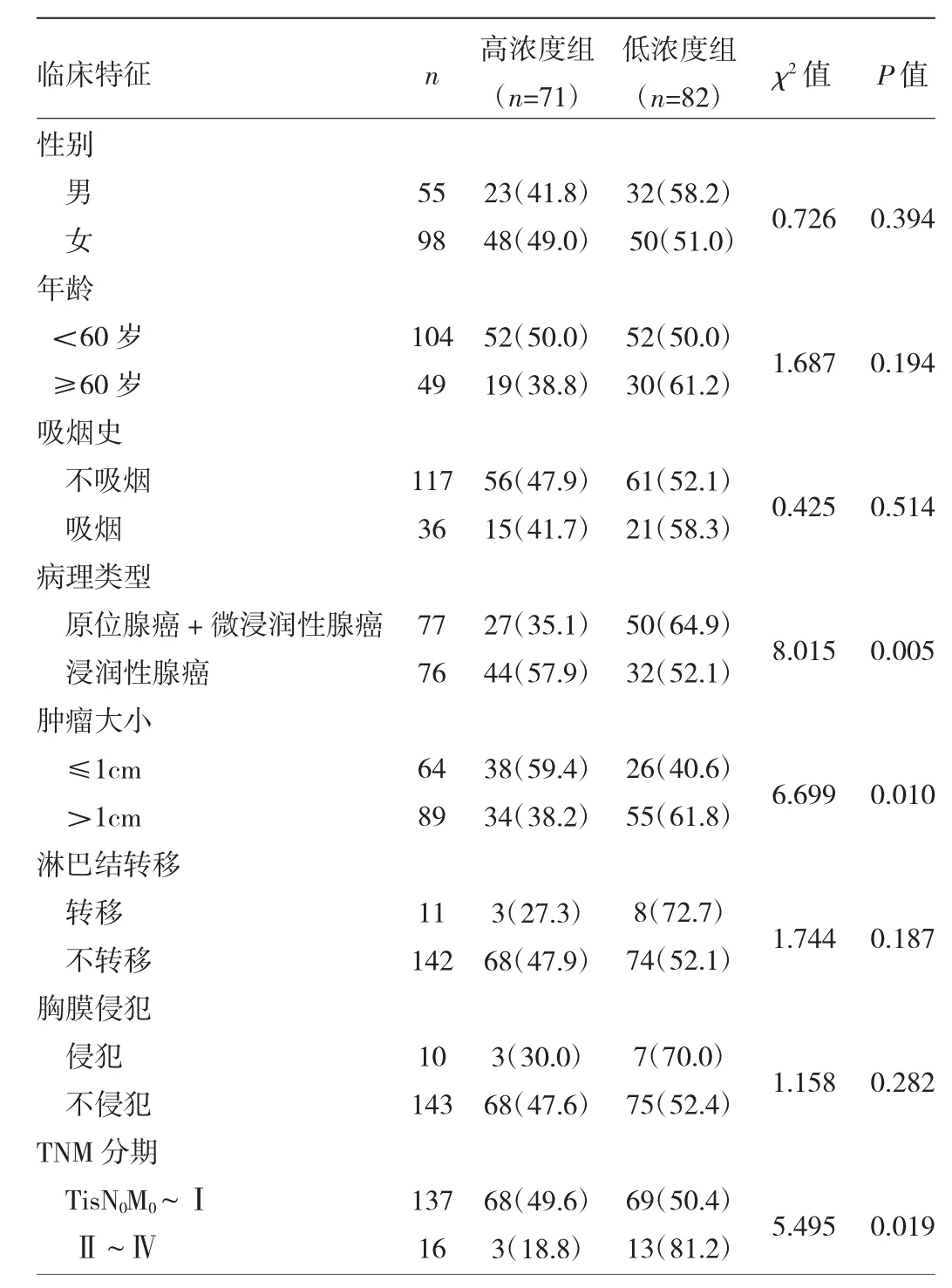
表2 肺腺癌患者血清SPINK1浓度与临床病理特征的关系[例(%)]
2.4 浸润性肺腺癌预测因素分析 单因素分析发现,血清SPINK1浓度、CEA和肿瘤大小与浸润性肺腺癌发生的风险有关。进一步多因素分析显示,血清SPINK1浓度、CEA和肿瘤大小是浸润性肺腺癌的独立预测因素。见表3。
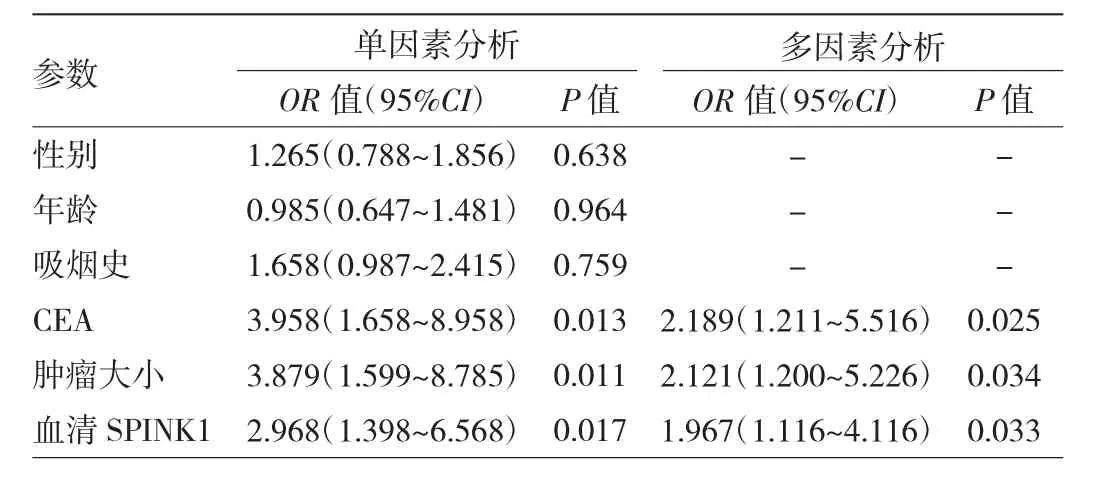
表3 浸润性肺腺癌预测因素分析
2.5 血清SPINK1浓度、CEA对浸润性肺腺癌的诊断价值 血清SPINK1浓度诊断的AUC为0.83,最佳截断值为1 288.5729 pg/ml,灵敏度为0.743,特异度为0.827。而CEA诊断的AUC为0.73,最佳截断值为1.975pg/ml,灵敏度为0.586,特异度为0.800。见图4。
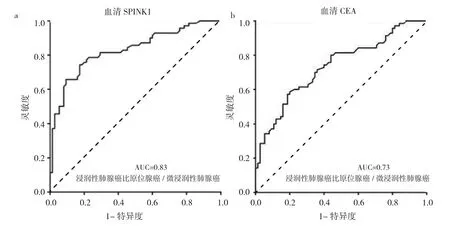
图4 血清分泌型丝氨酸蛋白酶抑制剂Kazal 1(SPINK1)浓度和癌胚抗原(CEA)诊断浸润性肺腺癌的ROC曲线(a:血清SPINK1浓度;b:CEA)
3 讨论
研究发现SPINK1的氨基酸序列与表皮生长因子(EGF)相似[9]。因此,SPINK1被认为可能是一种自分泌或旁分泌生长因子。有研究证实,SPINK1在多种恶性肿瘤血液中可被检测到,但在肺腺癌血液中的研究还鲜有报道[10-11]。本研究前期发现,SPINK1在肺癌组织高表达并与预后相关,在此基础上进一步探讨了肺腺癌血清SPINK1浓度及其在组织中表达水平的关系以及与临床病理特征的关系,以及其作为浸润性肺腺癌诊断的潜在标志物的可行性。
已有研究发现,大多数胰腺癌患者SPINK1血清浓度明显升高[10]。另一项研究也发现,肝癌患者血浆SPINK1浓度亦显著升高[11]。在50%的结直肠癌患者中亦观察到血清SPINK1浓度升高并且与预后相关[12]。本研究发现,与健康志愿者相比,肺腺癌患者血清SPINK1表达上调,与目前的研究结果相一致。前期研究发现,与癌旁组织相比,肺腺癌组织SPINK1表达上调。在此基础上,笔者进一步分析了血清SPINK1浓度与癌组织SPINK1表达水平的相关性,结果发现血清SPINK1浓度与癌组织SPINK1 mRNA表达水平呈正相关,与癌组织SPINK1蛋白表达水平亦呈正相关,提示血清SPINK1浓度随着癌组织SPINK1表达水平变化而变化,提示血清浓度可反映癌组织SPINK1表达水平,具有作为血清诊断标志物的潜力。
本研究进一步分析了肺腺癌患者血清SPINK1浓度与临床病理特征的关系,结果发现,高浓度组与低浓度组患者在不同病理类型、肿瘤大小以及TNM分期比较差异均有统计学意义。本研究发现,与原位腺癌与微浸性肺腺癌组相比,浸润性肺腺癌相血清SPINK1高浓度者占比较高。2011年公布的肺腺癌新分类标准中指出,原位腺癌与微浸性肺腺癌,这两类患者若接受根治性手术,则其疾病特异性生存率分别为100%或接近100%,而浸润性肺腺癌生存率相对较低。因此,原位腺癌与微浸润腺癌被认为是早期腺癌阶段,而浸润性肺腺癌恶性程度较高。笔者发现,与肿瘤大小≤1 cm组相比,>1 cm组肺腺癌血清SPINK1高浓度者占比较高;与TisN0M0~Ⅰ组相比,Ⅱ~Ⅳ分期组血清SPINK1高表达者占比亦较高。以上结果提示,血清SPINK1可能是恶性程度较高肺腺癌诊断的标志物。笔者进一步探讨了SPINK1对浸润性肺腺癌的诊断效能,结果显示,AUC可达0.83,灵敏度为0.743,特异度为0.827,表明血清SPINK1对浸润性肺腺癌具有良好的诊断效能。因此,本研究认为血清SPINK1可作为浸润性肺腺癌的血清生物标志物。然而,血清SPINK1的确切来源,具体是由哪些类型的细胞分泌而来的尚无直接证据。现有研究报道以及本研究结果提示,血清SPINK1可能是部分肿瘤细胞分泌而来。然而,发表于Nature Communication的一项研究证实,肿瘤微环境基质细胞能够分泌SPINK1[13]。因此,笔者推测部分血清SPINK1是由肿瘤基质细胞分泌的。分泌的SPINK1在肺腺癌发生、发展中的作用,目前尚不清楚,有待进一步研究。
本研究尚有不足之处。首先,纳入的肺腺癌患者尚无5年生存数据,因此,不能分析血清SPINK1与患者预后关系。其次,样本例数相对较少,需要进一步扩大样本量。本研究探索的SPINK1作为浸润性肺腺癌患者血清诊断标志物的可行性,将为肺腺癌的诊断提供新的靶点。
