银杏内酯B对癫痫模型大鼠学习记忆能力和海马神经元病变的影响
2021-11-01鲁光辉李新峰冯亮罗玲王海华
鲁光辉 李新峰 冯亮 罗玲 王海华
癫痫是一种慢性神经系统疾病,目前我国约有900万癫痫患者,是仅次于脑血管疾病的第二大脑部疾病[1]。研究发现30%~40%的癫痫患者存在不同程度认知功能障碍,主要表现为学习记忆能力降低,其中以视觉空间记忆能力、短时记忆能力损伤最为严重,严重影响癫痫患者的生活质量[2]。海马是参与空间学习记忆的重要脑区,癫痫发病过程中大脑神经元过度兴奋和异常同步放电导致活性氧自由基(reactive oxygen species,ROS)、炎症细胞因子大量生成,引发海马神经元损伤是癫痫所致认知功能障碍的重要机制[3-5]。银杏内酯B(ginkgolide B,GB)是从银杏叶中提取的一种倍半萜内酯化合物,具有良好的抗氧化和抗炎活性[6-7];但GB能否通过抑制氧化应激反应和炎症反应改善癫痫所致认知功能障碍的报道少见。笔者通过研究GB对癫痫模型大鼠氧化应激、炎症反应的影响,探讨GB对癫痫模型大鼠学习记忆能力和海马神经元病变的影响及其机制,现将结果报道如下。
1 材料和方法
1.1 试剂与仪器 试剂:GB粉末(美国Sigma公司,批号:BN90418);丙戊酸钠粉针剂(sodium valproate,VPA,成都诺迪康生物制药有限公司,规格:0.4 g/瓶,批号:20190716);丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)试剂盒(南京建成生物工程研究所,批号:190704、190811、190724);TNF-α、IL-1β、IL-6 ELISA试剂盒(北京索莱宝生物技术有限公司,批号:SEKR-0009、SEKR-0002、SEKR-0005)。仪器:WMT-100 型Morris水迷宫及视频分析系统(四川成都仪器厂);Synergy-HT型多功能酶标仪(美国 BioTck公司);RM2125型石蜡切片机(德国Leica公司);TDK-BMB型石蜡包埋机(孝感泰康达医疗设备公司);SZ-1型组织匀浆器(江苏金坛市晶玻实验仪器厂)。
1.2 实验动物与分组 清洁级雄性SD大鼠180只,体重220~250 g,由河北省实验动物中心提供 [许可证号:SCXK(冀)2018-004],适应性饲养 7 d。按照随机数字表法分为空白对照组、模型组、GB低、中、高剂量组(2.5、5、10 mg/kg)[8]和 VPA(300 mg/kg)组[9],每组 30 只。
1.3 造模与给药方法 除空白对照组外,其余各组大鼠均参照陈姝璇等[10]报道的氯化锂-匹罗卡品法诱导制备癫痫大鼠模型:腹腔注射氯化锂溶液127 mg/kg,20 h后背部皮下注射匹罗卡品溶液15 mg/kg。药物配制:精确称量GB粉末200 mg,加入10 ml二甲基亚砜溶解后,加入适量0.9%氯化钠注射液制备浓度2 mg/ml的GB溶液,然后依次用0.9%氯化钠注射液稀释制备浓度1 mg/ml、0.5 mg/ml的GB溶液;取VPA粉针剂加入适量0.9%氯化钠注射液制备浓度60 mg/ml的VPA溶液。给药方法:GB低、中、高剂量组分别在注射匹罗卡品前30 min腹腔注射浓度为0.5、1、2 mg/ml的GB溶液(注射量为5 ml/kg);VPA组在注射匹罗卡品前30 min腹腔注射浓度为60mg/ml的VPA溶液(注射量为5 ml/kg);模型组和空白对照组腹腔注射0.9%氯化钠注射液(注射量为 5 ml/kg)。
1.4 大鼠行为学观察 注射匹罗卡品后2 h内观察各组大鼠行为学变化,记录癫痫发作潜伏期和癫痫发作持续时间,参照Racine分级标准对各组大鼠癫痫发作程度进行分级[11]:无发作为0级;须动及口周、面部肌肉抽搐为Ⅰ级;点头或湿狗样频繁抖动为Ⅱ级;前肢局限性阵挛为Ⅲ级;前肢局限性阵挛伴后肢站立的全身强直性发作为Ⅳ级;伴有站立并摔倒、翻滚的全身强直阵挛发作为Ⅴ级。
1.5 大鼠学习记忆能力测定 采用Morris水迷宫实验。Morris水迷宫平台固定于第Ⅲ象限,水温设置为(25±1)℃,注射匹罗卡品24 h后,各组按照随机数字表法取10只大鼠,实验前适应性训练3 d,每天训练4次,分别于第Ⅰ、Ⅱ、Ⅲ、Ⅳ象限面朝池壁轻轻放入水中,训练过程中诱导大鼠找到第Ⅲ象限平台。
1.5.1 大鼠学习能力测定 采用定位航行实验。将每只大鼠分别在第Ⅰ、Ⅱ、Ⅳ象限面朝器壁方向放入水中,记录每只大鼠找到平台的时间,120 s内未能找到平台则按120 s计算,各组大鼠取平均值,即逃避潜伏期。
1.5.2 大鼠记忆能力测定 采用空间探索实验。撤除第Ⅲ象限平台,每只大鼠于第Ⅰ象限面朝器壁方向放入水中,记录120 s内穿越平台次数。
1.6 大脑海马神经元病理学检查 注射匹罗卡品24 h后,在各组剩余的20只大鼠中按随机数字表法再取10只大鼠,腹腔注射10%水合氯醛溶液3 ml/kg进行麻醉后开胸、暴露心脏,由左心室-右心耳通路依次灌注0.9%氯化钠溶液300 ml、4%多聚甲醛溶液300 ml,断头取脑,置于4%多聚甲醛溶液固定72 h后,行石蜡包埋、4 μm厚度切片、透明和脱蜡后行常规HE染色,中性树脂封片后通过光学显微镜观察大脑海马神经元病理学改变。
1.7 大脑海马组织生化指标检测 注射匹罗卡品24 h后,取各组剩余的10只大鼠,腹腔注射10%水合氯醛溶液3 ml/kg进行麻醉后予颈椎脱臼处死,断头取脑并剥离海马,加入9倍量冷裂解液后研磨匀浆,4℃离心(r=10 cm、3 000 r/min、10 min)取上清液,然后采用黄嘌呤氧化法和钼酸铵法分别检测SOD、CAT活性,硫代巴比妥酸法检测MDA水平;并采用ELISA法检测海马组织 TNF-α、IL-1β、IL-6水平。
1.8 统计学处理 采用SPSS 15.0统计软件。正态分布的计量资料以表示,多组间比较采用单因素方差分析,两两比较方差齐者采用LSD-t检验,方差不齐者采用Tamhane's T2法;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Wilcoxon秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠行为学指标的比较 空白对照组大鼠行为正常,未出现癫痫发作,癫痫发作程度为0级。与模型组比较,GB中、高剂量组和VPA组大鼠癫痫发作潜伏期延长、发作持续时间缩短、发作程度降低,差异均有统计学意义(均P<0.01)。与VPA组比较,GB高剂量组大鼠癫痫发作潜伏期延长、发作持续时间缩短、发作程度降低,差异均有统计学意义(P<0.05或0.01)。见表1。
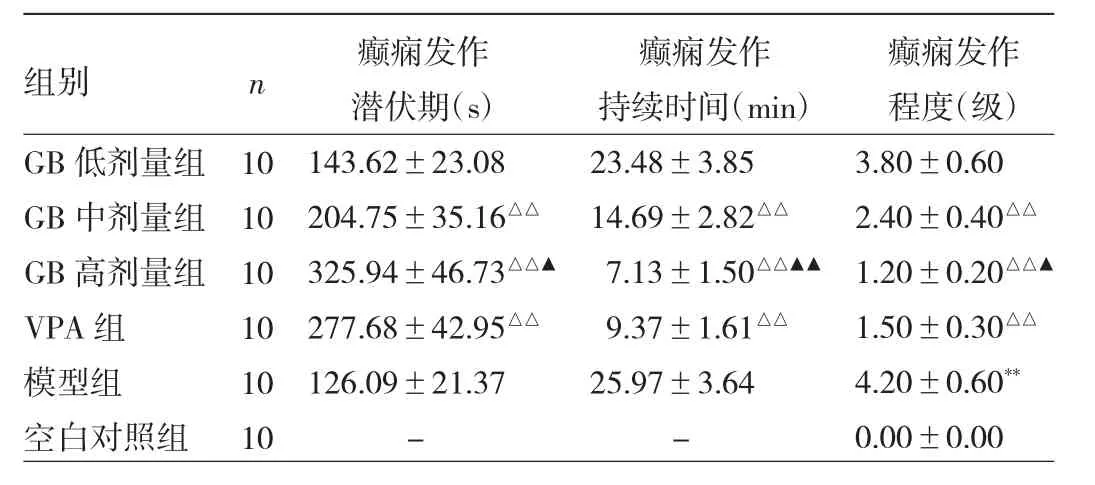
表1 各组大鼠行为学指标比较
2.2 各组大鼠学习记忆能力的比较 与空白对照组比较,模型组大鼠逃避潜伏期延长、穿越平台次数降低,差异均有统计学意义(均P<0.01);与模型组比较,GB中、高剂量组和VPA组逃避潜伏期缩短、穿越平台次数增多,差异均有统计学意义(P<0.05或0.01);与VPA组比较,GB高剂量组逃避潜伏期缩短且穿越平台次数增多(P<0.05或 0.01)。见图 1(插页)、表 2。
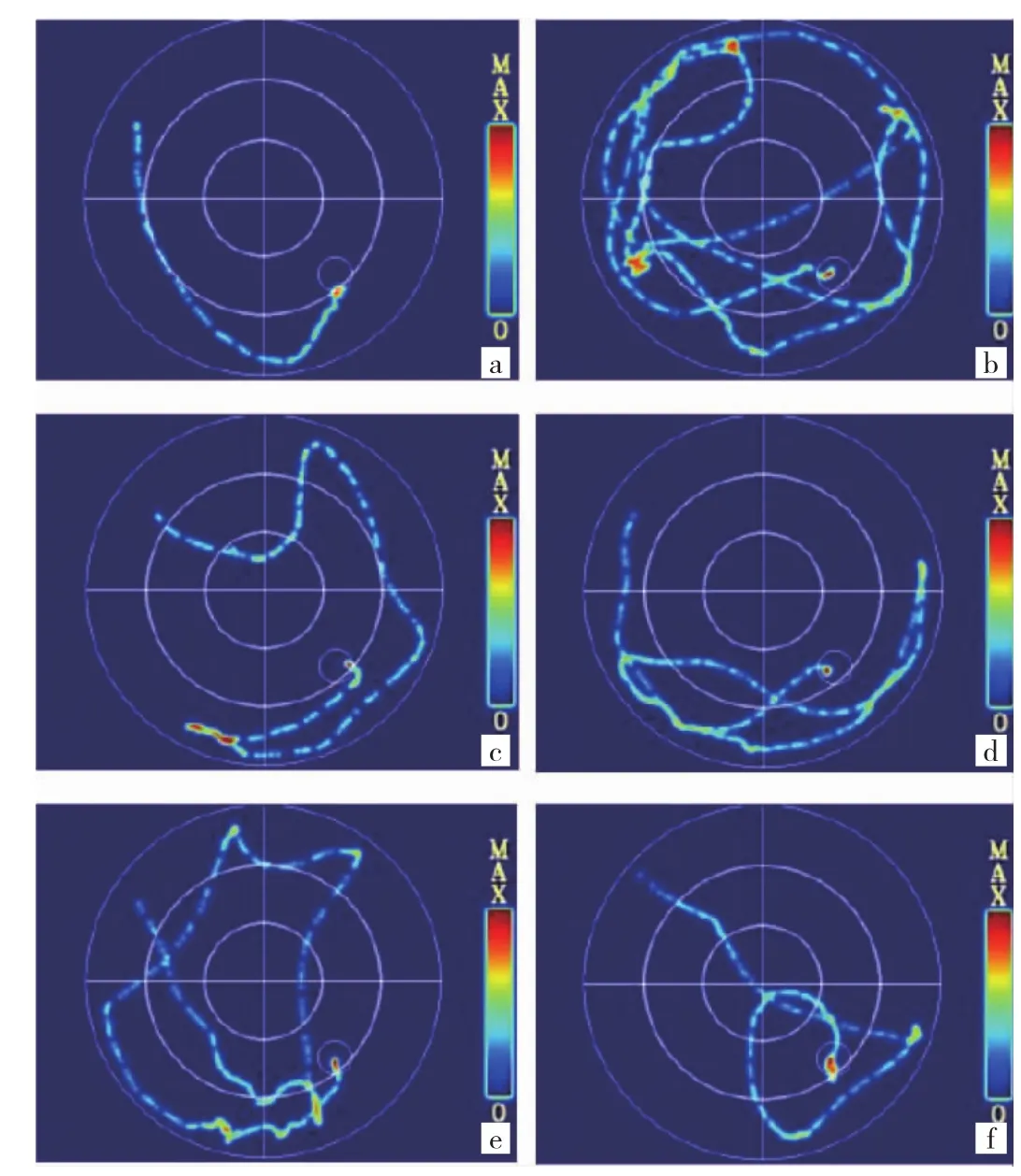
图1 各组大鼠典型定位巡航实验轨迹图[a:空白对照组;b:模型组;c:银杏内酯 B(GB)低剂量组;d:GB 中剂量组;e:GB 高剂量组;f:丙戊酸钠(VPA)组]
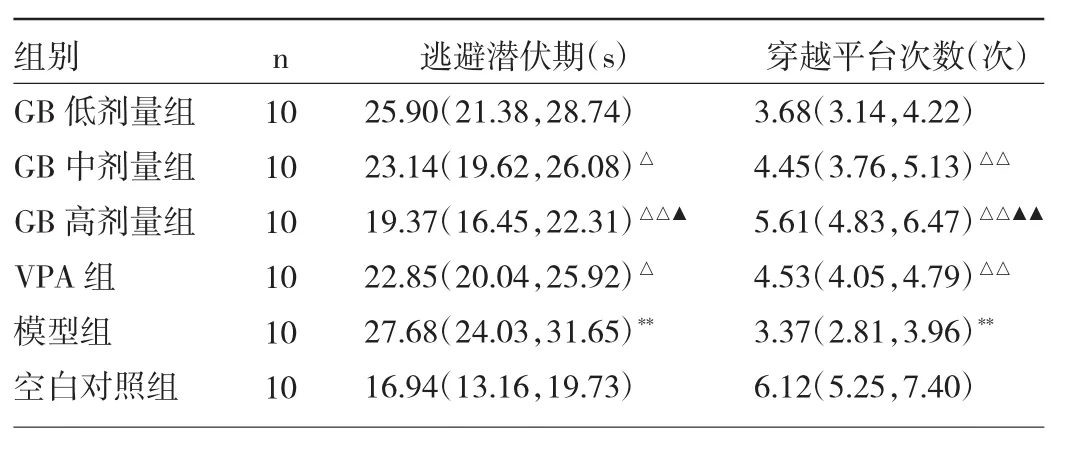
表2 各组大鼠逃避潜伏期和穿越平台次数的比较
2.3 各组大鼠海马神经元病理学改变比较 空白对照组大鼠海马神经元呈圆形或椭圆形,排列整齐、层次清晰,核膜、核仁清晰;模型组海马神经元呈现形态不规则,数量减少、间隙增大,排列紊乱、层次不清,胞体固缩、深染等病理学改变;与模型组比较,GB各剂量组和VPA组大鼠海马神经元上述病理学形态结构改变呈不同程度减轻;其中GB高剂量组海马神经元数量减少不明显、形态较规则、排列较整齐,效果优于其它组。见图2(插页)。

图2 各组大鼠海马组织病理学改变比较[a:空白对照组;b:模型组;c:银杏内酯 B(GB)低剂量组;d:GB 中剂量组;e:GB 高剂量组;f:丙戊酸钠(VPA)组;HE 染色,×400]
2.4 各组大鼠海马组织SOD、CAT活性和MDA水平比较 与空白对照组比较,模型组大鼠海马组织SOD、CAT活性降低,MDA水平升高,差异均有统计学意义(均P<0.01);与模型组比较,GB中、高剂量组和VPA组SOD、CAT活性升高,MDA水平降低,差异均有统计学意义(P<0.05或 0.01);与VPA组比较,GB高剂量组SOD活性升高且MDA水平降低,差异均有统计学意义(P<0.05或0.01)。见表3。
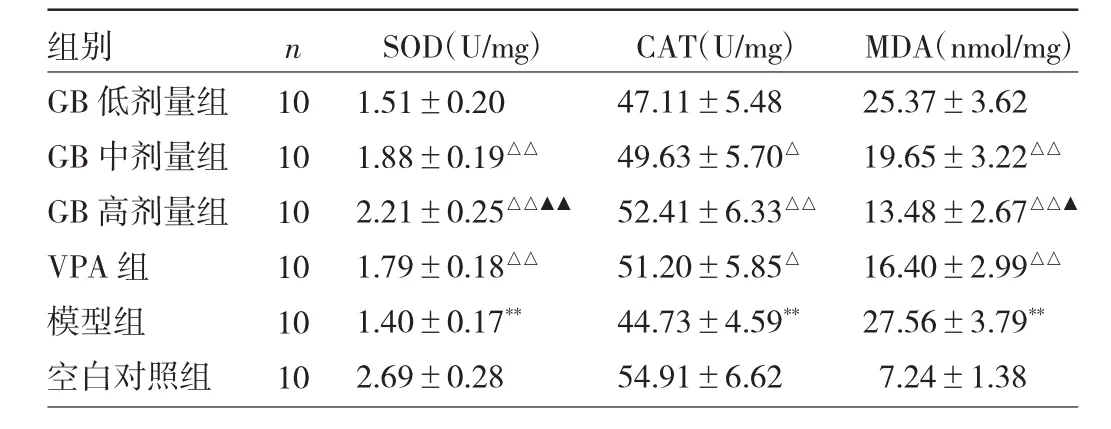
表3 各组大鼠海马组织SOD、CAT活性和MDA水平比较
2.5 各组大鼠海马组织TNF-α、IL-1β、IL-6水平比较 与空白对照组比较,模型组大鼠海马组织TNF-α、IL-1β、IL-6水平升高,差异均有统计学意义(均P<0.01);与模型组比较,GB中、高剂量组和VPA组TNF-α、IL-1β、IL-6水平降低,差异均有统计学意义(均P<0.01);与VPA组比较,GB高剂量组TNF-α、IL-6水平降低,差异有统计学意义(均P<0.01)。见表4。
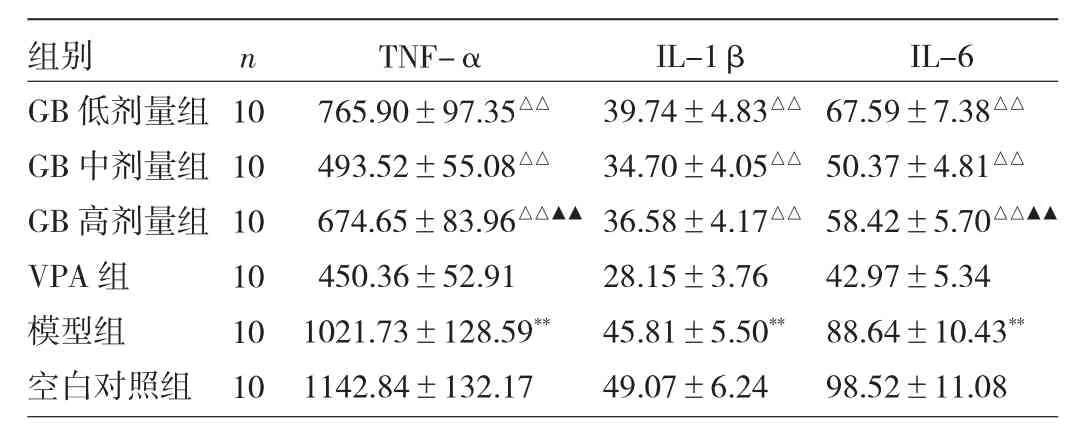
表4 各组大鼠海马组织TNF-α、IL-1β、IL-6水平比较(pg/ml)
3 讨论
癫痫是一种由于大脑神经元高度同步异常放电而引发的脑功能障碍综合征,具有自发性、反复性发作的特点,我国癫痫发病率高达千分之七,是仅次于脑卒中的第二大神经系统疾病。认知功能受损是癫痫患者最常见的并发症,与患病时程呈正相关,是影响患者生活质量的重要因素,抑制癫痫后认知功能障碍是当前脑科学研究热点之一。病理生理学研究发现,癫痫发作引发氧化应激和炎症反应所致海马神经元损伤与认知功能障碍的发生、发展密切相关[3-5]。因此,寻找靶向抑制氧化应激和细胞凋亡的新型药物减轻海马神经元损伤,或许是改善癫痫患者预后的有效途径。
GB是从中药银杏叶中提取的一种小分子活性单体化合物,具有抗氧化、抗凋亡等药理学作用,较易通过血脑屏障;Li等[6]和刘晖等[12]研究发现GB能够通过抑制氧化应激反应和炎症反应减轻大鼠缺血性脑损伤。VPA是一种广泛应用于临床的广谱抗癫痫药,也是新型抗癫痫药研究动物实验的常用阳性对照药物。临床上以颞叶癫痫最为常见,癫痫实验动物模型的制备方法主要有电点燃和化学点燃两大类,其中氯化锂-匹罗卡品化学点燃法制备的癫痫大鼠模型为颞叶癫痫,与人类癫痫病理特点一致,并且操作简便、重复性高,是公认的癫痫大鼠模型制作方法[13]。本研究采用氯化锂-匹罗卡品诱导制备癫痫大鼠模型,以VPA作为阳性对照药物,研究发现经GB干预能够明显延长大鼠癫痫发作潜伏期、缩短持续时间、降低发作程度,明显改善癫痫大鼠海马神经元病变,并且GB高剂量组效果优于VPA组,提示GB具有保护癫痫大鼠海马神经元并抑制癫痫发作的作用。
Morris水迷宫是目前世界公认的学习记忆能力评价方法,主要包括定位航行实验和空间探索实验[14]。本研究结果显示,经GB干预能够明显改善癫痫大鼠学习记忆能力,并且GB高剂量组效果优于VPA组,提示GB具有改善癫痫大鼠学习记忆能力的作用。
ROS代谢失衡是导致机体氧化应激损伤的基础。癫痫发作时神经元过度兴奋和异常放电导致ROS大量生成与释放[15],以ROS为底物的抗氧化酶(SOD、CAT)被过度消耗致使ROS过剩,ROS攻击破坏核酸、蛋白质及生物膜脂质发生氧化应激反应,生成具有生物毒性的MDA,因此SOD、CAT活性和MDA水平能够反映机体氧化应激反应程度[16]。本研究发现,经GB干预能够明显提高癫痫大鼠海马组织SOD、CAT活性并降低MDA水平,并且GB高剂量组对SOD活性和MDA水平的调控作用优于VPA组,提示GB对癫痫大鼠海马神经元氧化应激损伤具有抑制作用。
癫痫发病过程大脑神经元过度兴奋与异常同步放电刺激炎症细胞因子(TNF-α、IL-1β、IL-6)大量释放,引发系列炎症反应进而导致海马神经元损伤。并且TNF-α、IL-1β作为炎性趋化因子能够刺激粒细胞而进一步释放炎症因子,形成炎症级联反应而加重炎症损伤[17];IL-6则能够刺激细胞大量产生ROS而加重氧化应激损伤[18]。本研究发现,经GB干预能够明显降低癫痫大鼠海马组织TNF-α、IL-1β、IL-6水平,并且GB高剂量组对 TNF-α、IL-1β、IL-6 的调控作用优于VPA组,提示GB对癫痫大鼠海马组织在这炎症反应具有抑制作用。
综上所述,GB能够延长癫痫模型大鼠癫痫发作潜伏期、缩短发作持续时间、降低发作强度,改善癫痫大鼠学习记忆能力,其机制可能与GB通过抑制氧化应激和炎症反应而保护海马神经元有关。
