紫甘薯叶片响应UV-B辐射增强的转录组分析
2021-11-01孟凡来郭华春赵大伟余兴华王应梅李玉祥
孟凡来,白 磊,郭华春,赵大伟,余兴华,王应梅,李玉祥,滕 娟
(1.云南农业大学 农学与生物技术学院,云南 昆明 650201;2.文山壮族苗族自治州农业科学院,云南 文山 663099)
由于人类长期向大气中大量排放氟化物,大气臭氧层结构受到破坏,导致到达地表的紫外线(UV-B)辐射增强。大气平流层中臭氧每减少1%,到达地球表面的太阳紫外线辐射就增加2%[1-2];北半球因臭氧层破坏而导致的UV-B辐射年增加率将达到14%,南半球则达到40%[3];纬度和海拔是影响UV-B辐射的另一重要因素。研究表明,生活在低纬度地区的生物会比生活于高纬度地区的生物接受更多的UV-B辐射[4],海拔每升高1 000 m,UV-B辐射强度则提升10%~20%[5]。云南(海拔600~3 000 m,21~29°N)为典型的低纬高原,因此,该地区动植物受UV-B辐射增强的影响相对更严重。
紫甘薯为薯肉颜色紫色至深紫色的甘薯(Ipomoeabatatas(L.)Lam.),云南境内紫甘薯种植面积已达2.388万hm2,居全国第2位[6]。紫甘薯除含有普通甘薯所具有的全部营养成分外,还富含花青素、类黄酮、绿原酸等药用成分,是一种兼具粮食、经济和药用特性于一身的重要作物[6]。当前,紫甘薯鲜食和加工市场需求因居民对紫甘薯营养保健功能认知度及认可度的不断提高,以及以花青素应用为代表的医疗、工业需求增加而不断扩张[7-9]。故适当发展优质紫甘薯栽培,不仅有利于优化居民的膳食结构,而且是云南发展“高原特色农业”“效益农业”的有效途径。为了适应市场对优质紫甘薯品种的消费需求,云南农业大学薯类作物研究所选育出优质高花色苷(0.59 mg/g)品种-滇紫甘薯24。目前,关于甘薯响应UV-B辐射增强的研究主要集中于农艺性状[10]和生理生化方面[11-12],而就紫甘薯响应UV-B辐射增强的转录组分析的研究则鲜有报道,因此,本研究利用RNA测序(RNA-sequencing,RNA-seq)技术对增强UV-B辐射处理前后的紫甘薯叶片样品进行转录组测序比对,鉴定出样品响应UV-B辐射增强的显著差异表达应答基因,并对其差异表达基因(Differentially expressed genes,DEGs)进行基因本体(Gene ontology,GO)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)注释与富集分析,从转录组水平上对紫甘薯响应UV-B辐射增强的分子机制进行深入研究,以期为紫甘薯耐UV-B辐射相关基因的筛选提供科学依据。
1 材料和方法
1.1 材料及处理
试验于云南农业大学试验田内进行(25.04° N,102.73° E,海拔1 950.0 m),采用盆栽(高35 cm,直径40 cm;基质:红壤土∶腐殖土=1∶1),株行距:35 cm×40 cm。于2017年6月15日扦插,发根缓苗后进行UV-B照射处理。将带防雨灯架的紫外灯安装在田间搭建的网架上,用紫外灯管(UVB-40,南京华强电子有限公司,波长280~320 nm)进行人工增补UV-B辐射,辐照强度以灯管至甘薯最高叶面的高度和灯管数量调节,用UV-B紫外辐照计测量辐照强度(北京师范大学光电仪器厂)。以自然光照为对照(CK),自然光照基础上增加7.2 kJ/(m2·d)为UV-B辐射处理(T),每天照射5 h(11:00-16:00),阴雨天除外[13]。灯管高度随植株的生长高度适时调节,同时,为了使对照组与处理组的自然光照条件一致,在其上安装空灯架。于处理第60 天随机选取15株紫甘薯,取倒5叶,3次生物学重复,每个重复5株,将样品迅速放入取样管后液氮速冻,实验室内储存于-80 ℃超低温冰箱待用。
1.2 测序样品总RNA提取
采用TRNzol试剂盒(Invitrogen,Carlsbad,CA,美国)从叶片组织中提取总RNA[14],1%的琼脂糖凝胶电泳(电压180 V,电泳时间16 min)和Nanodrop分光光度计(IMPLEN,CA,美国)检测RNA纯度,Agilent Bioanalyzer 2100(Agilent Technologies,Santa Clara,CA,美国)测定RNA的浓度和完整性。
1.3 转录组测序
将提取的样本总RNA送至北京诺禾致源生物信息科技有限公司测序并进行文库构建。采用Illumina Hiseq 2500平台对质量合格的RNA文库进行测序。同时,使用SolexaQA package对Raw reads按照QPhred≥20和读长≥25 bp进行过滤,以获得高质量的Clean reads,并利用HISAT软件将已获得的Clean reads与甘薯参考基因组(http://public-genomes-ngs.molgen.mpg.de/sweetpotato/)进行序列比对分析。
1.4 差异表达转录因子基因的筛选
基因表达水平用FPKM(Expected number of fragments per kilobase of transcript sequence per millions base pairs sequenced)法计算[15]。借助DESeq(1.10.1)软件进行DEGs的筛选,筛选标准为|log2FC|≥2,padj<0.05,FDR<0.01。为了进一步研究差异表达基因的功能,利用GOSeq、topGO、hmmscan(Release 2.12)进行GO富集分析,显著富集标准为CorrectedP-value<0.05;利用KOBAS(V2.0)对差异表达基因进行KEGG Pathway富集分析,显著富集标准为CorrectedP-value<0.05。
1.5 qRT-PCR
提取对照组和处理组的叶片总RNA使用TUREscript 1st Stand cDNA Synthesis Kit(北京艾德莱生物科技有限公司)试剂盒合成cDNA。qRT-PCR用SYBR®Green Supermix在analytikjena-qTOWER2.2型荧光定量PCR仪上进行测定。反应条件为:95 ℃,3 min;95 ℃,10 s,58 ℃,30 s,39个循环;溶解曲线60~95 ℃,+1 ℃/cycle,保持时间4 s。基因的相对表达量用2-ΔΔCt方法计算[16],以18S DNA为内参(表1)。

表1 qRT-PCR引物序列Tab.1 The primer sequences used in qRT-PCR
2 结果与分析
2.1 总RNA质量特征
由图1可以看出,各样品总RNA条带清晰无弥散、无降解、无污染。自然光照与增强UV-B辐射下的OD260/280分别为2.000~2.138,OD260/230分别为1.509~2.102,RNA浓度分别为160~252 ng/μL,RIN分别为5.9~7.6,各值均在检测合格范围内,这表明各样品提取的总RNA纯度较高,质量符合上机测序要求(表2)。
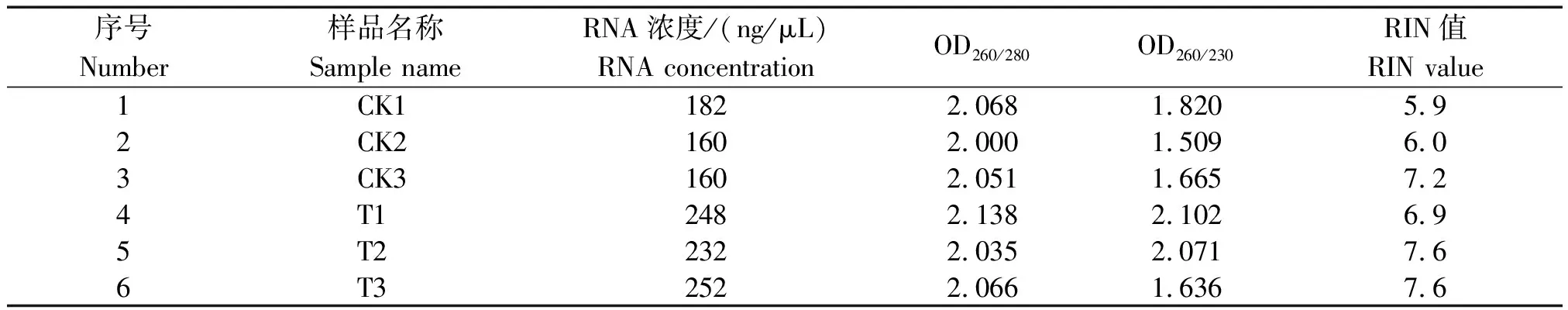
表2 样品总RNA质检结果Tab.2 The sample total RNA quality test results
2.2 紫甘薯叶片RNA测序质量分析
将Raw reads和Clean reads比对到甘薯参考序列,CK和T的Raw reads和Clean reads的比例相近,且二者中比对到参考序列的比率分别为72.56%和73.70%,充分说明测序数据质量可信[17](表3)。

表3 样品测序数据统计结果Tab.3 Statistical results of the sample sequencing data
2.3 紫甘薯叶片响应UV-B辐射增强下的差异表达基因分析
UV-B辐射处理后紫甘薯叶片中共有477个基因表达发生显著变化,其中上调表达的基因有382个,占总差异表达基因的80.08%,下调表达基因有95个,占总差异表达基因的19.92%。由图2可以看出,差异表达基因中变化倍数在2~3倍、3~5倍、5倍以上的上(下)调差异表达基因分别占总上(下)调基因总数的57.59%(74.74%),34.55%(24.21%),7.85%(1.05%)。上述结果说明,UV-B辐射增强后紫甘薯的差异表达基因主要以上调表达为主,且变化幅度主要集中在2~3倍。
2.4 紫甘薯叶片响应UV-B辐射增强下DEGs的GO功能富集分析
差异表达基因行使的主要生物学功能以GO功能显著性富集分析来确定。本研究共显著富集到分属于生物过程和分子功能的16条功能条目,表明UV-B辐射增强下紫甘薯叶片的DEGs主要通过这2个生物功能来提高自身的适应性。生物过程主要为氧化还原过程,其DEGs数占总数的63.92%,分子功能主要富集在氧化还原酶活性中,其DEGs占比为40.91%,表明紫甘薯叶片主要通过生物过程中的氧化还原过程和分子功能中的氧化还原酶活性来抵抗UV-B辐射带来的伤害,暗示UV-B辐射增强对紫甘薯叶片造成氧化伤害(表4)。

表4 紫甘薯叶片响应UV-B辐射增强下DEGs的GO功能分类Tab.4 GO function categories of DEGs of purple sweet potato leaf in response to enhanced the UV-B
2.5 紫甘薯叶片响应UV-B辐射增强下DEGs的KEGG代谢通路显著性富集分析
KEGG是系统分析基因功能、基因组信息的数据库,能够较准确的分析生物体内的代谢和研究代谢网络。通过分析可知,DEGs主要分布在56条代谢通路中,其中达到显著差异水平的通路共有9条,分别为次生代谢产物生物合成、植物昼夜节律、苯丙素生物合成、类黄酮生物合成、氮代谢、苯丙氨酸代谢、芥子油苷生物合成、油菜素内酯生物合成、硫胺素代谢,其中次生代谢产物生物合成通路所包含的DEGs数量最多,暗示其为紫甘薯响应UV-B辐射增强的主要代谢通路(表5)。

表5 紫甘薯叶片响应UV-B辐射增强下DEGs显著性富集的KEGG PathwayTab.5 KEGG Pathway with significant enrichment of DEGs of purple sweet potato leaf in response to enhanced the UV-B
对次生代谢产物生物合成通路中的DEGs进行功能注释,结果发现,与类黄酮代谢相关的基因最多,如类苯丙氨酸解氨酶基因(Tai6.36393、Tai6.18421)、4-香豆酸-CoA连接酶6基因(Tai6.23346)、查尔酮合酶基因(CHS)(Tai6.1732、Tai6.53503、Tai6.45381)、查尔酮合酶DIV亚型X1基因(Tai6.1734、Tai6.46186)、二氢黄酮醇4-还原酶基因(DFR)(Tai6.3019)、咖啡酰-CoA O-甲基转移酶基因At4g26220亚型X1基因(Tai6.25039)、花青素合成酶基因(Tai6.42091、Tai6.40394)、类花青素3-O-葡萄糖基转移酶7基因(Tai6.49002);其次为细胞色素P450家族,如类细胞色素P450 71A1基因(Tai6.44113)、类细胞色素P450 82D47(Novel07412)、类细胞色素P450 83B1基因(CYP83B1)(Tai6.44115、Tai6.18064、Tai6.41206)、类细胞色素P450 84A1基因(Novel06436、Novel06172)、类细胞色素P450 85A1基因(CYP85A1)(Tai6.2806、Tai6.19253、Tai6.15801)(表6)。上述结果表明,这些基因可能在响应UV-B辐射中起关键作用。

表6 紫甘薯叶片响应UV-B辐射增强下的主要差异表达基因Tab.6 Main DEGs of purple sweet potato leaf in response to enhanced the UV-B
2.6 紫甘薯叶片响应UV-B辐射增强下的转录因子分析
转录因子(Transcription factor,TF)为转录调控中的核心功能蛋白,在植物响应逆境胁迫中充当重要角色[18]。UV-B辐射胁迫下,紫甘薯叶片共有43个转录因子基因差异表达,约占差异表达总基因数的9.01%,其分别隶属于16个转录因子家族。这些转录因子家族中转录因子较多的家族分别为C2H2、NAM、bHLH和RR-A-type,其中NAM和RR-A-type基因全为上调表达,C2H2基因以上调表达为主,bHLH基因上、下调数目相等(图3)。
2.7 DEGs的qRT-PCR验证
随机选取7个DEGs以验证测序差异表达基因数据的可靠性,其中上调表达基因2个(PAL(Tai6.18421)和CYP450(Novel07412)),下调表达基因5个(CHS(Tai6.1732)、4CL(Tai6.23346)、DFR(Tai6.3019)、LDOX(Tai6.40394)和peroxidase gene(Novel09917))。以18S DNA为内参,进行qRT-PCR验证。结果显示,选定基因在UV-B辐射增强胁迫下的表达趋势与RNA-seq的检测结果一致(图4),表明转录组测序获得的数据较为可靠[19-20]。
3 讨论与结论
本研究采用RNA-seq技术研究紫甘薯叶片对UV-B辐射增强的响应,共获得显著响应UV-B辐射增强的差异表达基因477个,其中382个上调表达,95个下调表达,表明这些DEGs对UV-B辐射胁迫的响应主要以上调表达为主。GO功能注释显示,DEGs主要分布在生物过程中的氧化还原过程和分子功能中的氧化还原酶活性中;KEGG Pathway分析表明,DEGs主要富集在次生代谢产物生物合成通路中,且主要分布在类黄酮生物合成过程和细胞色素P450中。
类黄酮作为主要的UV-B吸收化合物,在植物生理生化层面起有效抵御UV-B辐射伤害的作用[21]。高等植物黄酮类化合物经“一般苯丙烷类途径(General phenylpropanoid pathway)”合成,肉桂酸和香豆酰辅酶A是合成途径的中间产物,其合成受苯丙氨酸解氨酶(PAL)、肉桂酸4-羟化酶(C4H)和4香豆酸辅酶A连接酶(4CL)的调控[22-23],随后查尔酮合酶(CHS)将4-香豆酰-辅酶A转化为查尔酮,这一过程是类黄酮生物合成的第一个限速步骤[24]。此后,通过对分子骨架的修饰产生不同的类黄酮亚群,该过程是由CHS、黄烷酮-3-羟化酶(F3H)、类黄酮3′-羟化酶(F3′H)、类黄酮3′,5′羟化酶(F3′,5′H)、类黄酮3-甲基转移酶(F3MT)、类黄酮3′,5′甲基转移酶(F3′,5′MT)、隐色花色素还原酶(LAR)、二氢黄酮醇4-还原酶(DFR)、花色素合成酶(ANS)、3-氧-甲基转移酶(COMT)、CCoAMT和HCT控制的。王霞等[25]以1个紫色甘薯突变体和诱变亲本为试验材料,通过转录组测序分析证实PAL、C4H、CHS、CHI、F3H和DFR可能与紫色甘薯中花青素的合成有关。本研究发现,类PAL(Tai6.36393、Tai6.18421)上调表达了2倍多,4-香豆酸-CoA连接酶6基因(Tai6.23346)下调表达了2倍多,CHS(Tai6.1732、Tai6.53503、Tai6.45381)下调了2.49~3.30倍,DFR(ai6.3019)下调了4.25倍,咖啡酰-CoA O-甲基转移酶At4g26220亚型X1基因(Tai6.25039)、ANS(Tai6.42091、Tai6.40394)及类花青素3-O-葡萄糖基转移酶7基因(Tai6.49002)下调了2.00~2.89倍,表明UV-B辐射增强下类黄酮合成通路中的各关键酶基因主要以下调表达为主,且IbCHS和IbDFR下调幅度最大,暗示其分别为类黄酮和花色甘合成的关键限速酶,致使UV-B辐射增强下紫甘薯叶片中的类黄酮与花色苷含量均下降[26]。
细胞色素P450是高等植物中最大的酶蛋白家族,其在合成植物次生代谢产物(木质素中间物、苯丙烷类的生物合成、芥子油、IAA、萜类、黄酮类、异黄酮等)中具有重要的作用[27]。前人研究发现,CYP83B1为肟的代谢酶,并参与吲哚族芥子油苷核心结构的形成,其能够高效催化来源于色氨酸的吲哚-3-乙醛肟(IAOx),植物体内的CYP83B1缺失后,IAOx就不能生成吲哚族芥子油苷,而是流向IAA合成通路,在植物中积累大量的IAA加重顶端优势,反之则可诱导植物顶端优势减弱[28]。CYP85A1在油菜素内酯(BR)生物合成途径中具有重要作用[29],油菜素内酯可以通过改善相关抗氧化指标来响应非生物胁迫,进而提高植株抗逆性能[30-31]。本研究共发现分属于5个CYP450家族的10个基因,其中IbCYP83B1(Tai6.44115、Tai6.18064、Tai6.41206)和IbCYP85A1(Tai6.2806、Tai6.19253、Tai6.15801)数量最多,且全部基因均上调表达,表明IbCYP83B1和IbCYP85A1在UV-B辐射增强下起关键的正向调控作用,并可促进紫甘薯叶片中芥子油苷和油菜素内酯含量的增加[32-35]。
转录因子在响应由环境因素引起的基因表达调控方面发挥着重要作用[36]。前人研究表明,C2H2为锌指蛋白的一个类型,在调控植物非生物胁迫如干旱、盐胁迫、低温等方面起重要作用[37]。bHLH(碱性螺旋-环-螺旋)类转录因子是植物中第二大转录因子家族,其不仅具有调节植物生长发育、参与花青素合成的功能,还在植物低温胁迫、干旱胁迫、盐害胁迫等非生物胁迫方面起重要作用[38]。NAC是植物特有的转录因子中最大的家族之一,其主要涉及对植物的生长发育调控、植物的逆境胁迫应答、调控植物的抗病性、参与植物次生生长调控以及激素信号转导等过程[39]。RR-A-type(反应调节因子和假定的新型转录因子),其为ARR-B(反应调节因子)的一个亚族,在植物细胞分裂素信号转导中起正调控作用[40]。本研究中C2H2、NAM、bHLH、RR-A-type家族的DEGs数量最多,表明其在紫甘薯响应UV-B辐射中起关键作用,其中NAM和RR-A-type的全部及C2H2的多数基因均为上调表达,暗示其在辐射增强下主要起正向调控作用,bHLH上、下调数目相等,暗示其在辐射增强下既起正向调控作用也具有负向调控作用,这与前人在小麦(TriticumaestivumL.)中的研究结果相似[41]。上述结果表明,UV-B辐射增强下,紫甘薯叶片可能主要通过C2H2、NAM、RR-A-type转录因子编码基因的正向调节来应对辐射增强,同时通过bHLH调控花青素含量,NAC调节ABA、GA等植物激素含量,RR-A-type调控细胞分裂素信号转导等途径来提高紫甘薯叶片对辐射增强的适应性。
综上所述,紫甘薯叶片响应UV-B辐射增强的关键基因可能为类黄酮代谢过程中的IbCHS和IbDFR,以及CYP450家族的IbCYP83B1和IbCYP85A1,起主要调控作用的转录因子可能为C2H2、NAM、bHLH和RR-A-type。本研究不仅可为紫甘薯耐UV-B靶标基因的筛选提供一些候选基因,还可以为揭示紫甘薯响应UV-B胁迫转录调控机制的研究奠定理论基础。
