食品中脂类物质的1O2氧化及控制方法
2021-10-31徐宝成罗登林
连 琦,徐宝成,2,3,,罗登林,2,3,周 路,余 慧,王 欣
(1.河南科技大学食品与生物工程学院,河南 洛阳 471000;2.食品加工与安全国家级实验教学示范中心,河南 洛阳 471000;3.食品原料河南省工程技术研究中心,河南 洛阳 471000)
单线态氧(singlet oxygen,1O2)是一种重要的活性氧(reactive oxygen species,ROS)[1],其分子轨道具有与基态氧分子(ground state oxygen,3O2)不同的电子排布。1O2是一种激发态氧分子,活性很高,极易与食品中脂类物质的不饱和双键直接发生反应,使其氧化劣变,营养价值丧失。光敏氧化是脂类食品1O2来源途径中最主要的一种[2-3],即脂质中天然存在的色素[4-5]在光的作用下通过Type II途径产生1O2,迅速引发并促进食品中脂类物质的氧化[6]。1O2反应活性高,与脂类物质的氧化反应速率至少是3O2的1 500 倍[7],并且氧化过程中产生的游离基还可进一步引发脂类物质的自动氧化,因此,研究脂类食品中1O2的来源途径、氧化机理及安全有效的抑制技术引起了许多国内外研究者的兴趣,并取得了系列研究成果。本文对近年来本领域的最新国内外研究成果进行了对比和分析,从脂类食品中1O2的形成途径、光敏氧化机理及控制技术等方面进行了深入阐述和分析,以期为深入研究食品中脂类物质的光敏氧化及抑制技术提供理论依据。
1 单线态氧简介

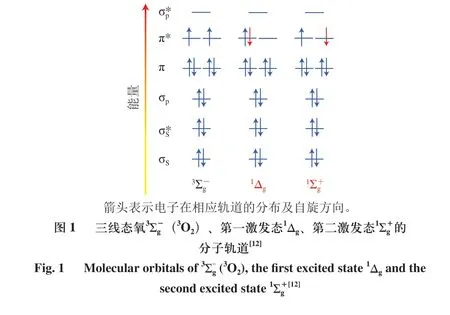
2 脂质体中单线态氧形成及光敏氧化机理
脂类食品中1O2的形成途径主要包括以下几种:酶催化反应[13-14]、自由基化学反应[12]、内过氧化物分解反应[12,15]和光敏氧化反应[16],具体如图2所示。其中,

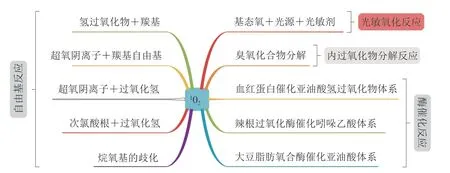
图2 脂类食品中单线态氧来源Fig. 2 Sources of singlet oxygen in lipid foods
光敏氧化途径形成1O2仅需要3O2、适当波长的光以及光敏剂(photosensitizer,Sen)[16,18-19]。Sen是光敏氧化中能够吸收光能的分子,能在紫外-可见区域吸收能量激发生成1O2。脂质中天然存在的各种色素都是潜在的Sen,如叶绿素、核黄素、肌红蛋白等[20-22]。光敏氧化过程中,Sen的激发、1O2的形成及脂质体后续的氧化过程如图3所示[17]。一旦基态单线态光敏剂(ground singlet state photosensitizers,1Sen)受激发生成激发态单线态光敏剂(excited singlet state photosensitizers,1Sen*),一部分1Sen*通过发射荧光直接回到基态,另一部分通过系间窜跃机制迅速衰变成激发态三线态光敏剂(excited triplet state photosensitizers,3Sen*),3Sen*可以通过发射磷光回到基态,也可以通过Type I和Type II两种途径回到基态,重新开始另一次循环。光敏氧化过程中Type I和Type II两种反应途径的选择主要取决于底物与3O2对3Sen*的竞争,随着底物和3O2浓度的变化,光敏氧化可能会在反应过程中改变反应途径[23]。Type I型和Type II型途径通过形成自由基化合物(R·)或生成1O2来启动氧化反应。
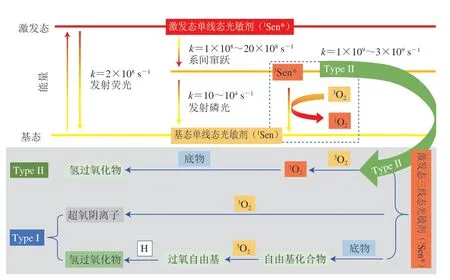
图3 Type I和Type II光敏氧化机理[17]Fig. 3 Mechanisms of type I and type II photooxidation[17]
Type I途径中3Sen*直接与底物反应生成自由基化合物(R·)[16,24]。这些自由基(R·)易与3O2反应生成过氧自由基氧化物(ROO·),并再次分解形成更多的自由基,从而引发自由基链式反应,同时过氧自由基(ROO·)也可以与氢原子结合生成氢过氧化物(ROOH)。另外,Type I型途径中3Sen*还可以与3O2反应直接生成超氧阴离子(O2-),但该反应在3Sen*与3O2反应中的占比少于1%[25]。
Type II途径中3Sen*首先与3O2反应,发生能量转移,使3O2受激生成1O2[16,24]。1O2随之进攻富含电子的化合物(如烯烃、二烯和芳香族化合物)双键并直接形成氢过氧化物(ROOH)。通过Type II型途径,每个Sen分子在淬灭之前可以激发产生103~105个1O2分子[26]。在食物系统中Type II型途径的反应速率主要取决于3O2的溶解度和浓度[17],与水相比,1O2在脂质和非极性溶剂中的溶解度更高[6]、寿命更长[27]。因此,油脂等脂类食品中天然存在的微量Sen如叶绿素等[21,28]在光照条件下,很容易通过Type II型途径引发光敏氧化反应,导致脂类食品的氧化变质。
3 脂质体中单线态氧的氧化作用
3.1 油脂的光敏氧化
3.1.1 油脂光敏氧化机制
油脂是人类膳食中一类重要的食品,富含单不饱和与多不饱和脂肪酸,其中代表性的ω-3多不饱和脂肪酸可以改善或治疗心血管疾病、糖尿病、癌症以及阿尔茨海默病等多种疾病[29],ω-6多不饱和脂肪酸具有降低心脏病风险、提升婴儿智力发育、改善儿童注意力缺陷等多种对人体有益的生理功能[30]。然而,在选择多不饱和脂肪酸油脂的同时,也增加了油脂的氧化敏感性,尤其在油脂光敏氧化Type II途径中,1O2一旦形成就率先攻击不饱和脂肪酸的富电子双键[31],通过加成机理与不饱和脂肪酸的双键直接反应。氧原子可加成到被攻击双键的任一端碳上,然后发生双键位移,生成特有的具有烯丙基结构的反式ROOH[7]。
根据这种机理,1O2氧化脂质生成的ROOH种类和数量与由3O2氧化形成的ROOH种类和数量是不同的。例如,在亚油酸系统中,与1O2反应形成的氧化产物有共轭和非共轭4 种ROOH,而与3O2反应形成的氧化产物则只有典型的两种共轭双键构型的ROOH(图4)[32]。
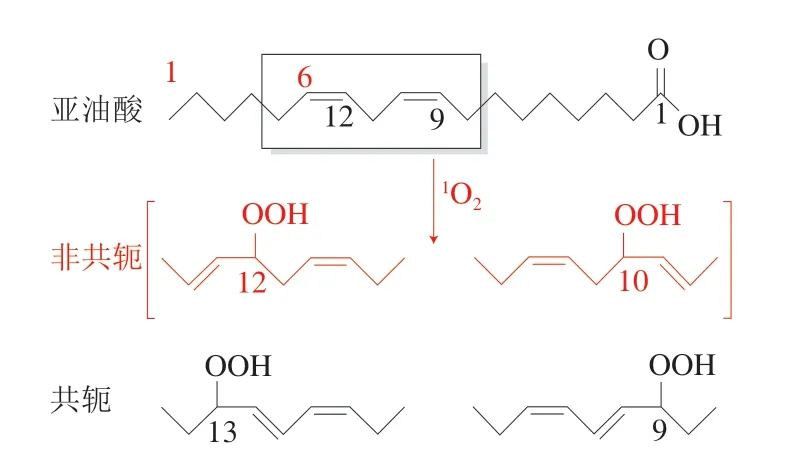
图4 亚油酸与单线态氧的反应[32]Fig. 4 Reaction of linoleic acid with singlet oxygen[32]
此外,1O2氧化的相对速率还与双键数量成正比,C18:1、C18:2和C18:3不饱和脂肪酸与1O2的相对反应速率比为1∶1.3∶2.3(表1)。

表1 单线态氧和三线态氧与不饱和脂肪酸的相对反应速率[17]Table1 Relative reaction rates of singlet and triplet oxygen with unsaturated fatty acids[17]
光敏氧化形成的ROOH并不稳定,会通过以下方式进一步分解形成次级氧化产物:
一是少量氢过氧化物(ROOH)的热分解,形成烷氧自由基(RO·)和羟自由基(·OH),如式(1)所示。

二是在变价金属离子的作用下催化分解,形成烷氧自由基(RO·)、烷过氧自由基(ROO·)以及氢离子(H+)和氢氧根离子(OH-),如式(2)、(3)所示。
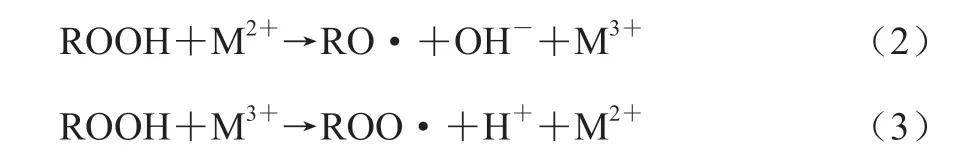
这些自由基会直接参与到油脂的自动氧化,进一步加速油脂氧化劣变[33]。同时随着ROOH浓度的增加,ROOH会进一步分解形成醛、酮、酸、醇等对人体健康有害的物质,产生不良风味,使油脂丧失食用价值[34]。
3.1.2 油脂光敏氧化产物的鉴定
油脂光敏氧化产物的鉴定主要是通过定量检测一级氧化产物ROOH实现的,传统检测油脂中总ROOH的方法有化学法和物理法,前者主要包括碘量法、比色法[35]、铁配合物法[36]和酶促反应法[37],后者包括紫外分光光度法[38]和排阻色谱法[39],其中紫外分光光度法只能检测共轭双键构型的ROOH。上述传统方法通常来说只能作为估计ROOH总量的通用技术,并不能区分不同的油脂氧化类型生成的不同ROOH。因此,国内外研究者开发出多种用于分析特定ROOH的方法。
油脂经Type II光敏氧化生成独有的非共轭ROOH,其含有的反式双键在970 cm-1处有红外吸收峰。在各种类型的油脂氧化中,此吸收峰仅见于1O2氧化产物,因此可以表征油脂Type II光敏氧化[40]。ROOH还可以通过气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪分析鉴定[41],首先用硼氢化钠加氢或碘化钾还原,再与三甲基硅烷试剂进行硅烷化反应,得到挥发性衍生物,然后用GC-MS鉴定不饱和脂肪酸在还原和硅烷化后产生的一级离子碎片,这些离子碎片含有丰富的信息,对ROOH的检测限可以达到纳克到飞克级别,可以分析鉴定不同类型油脂氧化所产生的不同ROOH。此外,利用配备不同检测器(化学发光检测器、荧光检测器灯)的液相色谱[42]也可以进行相关研究,但需要在液相色谱分离出ROOH后再进行单独的分析鉴定,步骤冗长、操作繁琐,因此应用受到较大的限制。近年来,研究者们开发出一种利用高效液相色谱-质谱(high performance liquid chromatography-mass spectrometry,HPLC-MS)联用仪对复杂氧化物分子结构或其衍生物进行分析的检测方法[43-45],该方法兼具液相色谱对完整分子分析的简便性和质谱检测的高灵敏性,因此在分析和鉴定不同类型油脂氧化产生的不同ROOH方面极具优势与潜力。
3.2 植物甾醇的光敏氧化
植物甾醇(phytosterol,PS),又称植物固醇,是一种广泛分布于油脂中的类脂物质,具有降低血浆中低密度脂蛋白胆固醇、干预多种慢性疾病的功效[46]。目前,PS已被用作功能性食品强化剂,添加到各类含脂食品中。然而,食品中的PS同样易受光敏氧化的影响,生成植物甾醇氧化物(phytosterol oxidation products,POPs),失去原有的生物活性和生理功能[47]。PS的光敏氧化同样包括Type I和Type II两条途径,但以Type II氧化为主[48]。
Zhao Yajing等[49]研究了光氧化作用下油基质中PS的稳定性。Sen(叶绿素)能促进光氧化过程中1O2的产生,对PS的光敏氧化起决定性作用。在Sen相对含量为0.025%、0.05%、0.1%,光源为白色发光二极管(light emitting diode,LED),光照强度为10 000 lx条件下照射14 d后,PS含量分别减少了15%、19%、28%。另外,甾醇的光敏氧化还与辐照强度有紧密的联系,即随着光照强度的增大,甾醇氧化速率常数增加,氧化速度加快。脂质体系不饱和度的增加会抑制甾醇的光氧化,主要机理是随着脂质体不饱和度的提高,其与1O2的竞争结合力会增强,从而降低甾醇的光敏氧化程度。
在该光照条件下,主要的POPs为7β-羟基甾醇,约占POPs总量的三分之一,其次是7α-羟基、5β,6β-环氧、7-酮基、5α,6α-环氧和6β-羟基甾醇(图5)。进一步分析发现,类固醇甾核B环C7位是PS光氧化过程中的关键氧化位点[48-49]。通常情况下,POPs对人体健康不利[47,50],但也有研究表明,麦角固醇被1O2氧化生成的麦角固醇过氧化物,可能具有潜在的健康益处和生理活性[51-53],如麦角固醇暴露于紫外光时,会氧化生成VD2等功能性物质。
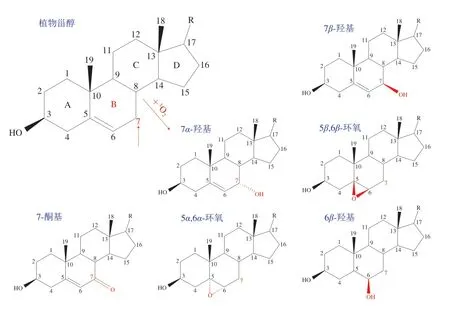
图5 植物甾醇及其主要光敏氧化产物[49]Fig. 5 Phytosterol and its major photosensitive oxidation products[49]
4 脂质体中单线态氧氧化的控制方法
油脂的光敏氧化劣变主要是由Type II途径产生的1O2所引发的,为了有效控制其光敏氧化,需要从Sen和3O2脱除、1O2淬灭、辐照光源控制等方面着手进行研究。
4.1 光敏剂的脱除
通过精炼工序脱除油脂中微量的叶绿素等天然光敏剂,可以有效抑制1O2的产生,从而防止油脂的光敏氧化劣变。
4.1.1 物理吸附法
物理吸附法以吸附剂的多孔表面与色素产生分子间作用力为主要原理,可以同时脱除油脂中叶绿素、β-胡萝卜素等多种色素,其工艺简单高效,是目前被研究最多、应用最广泛的油脂脱色技术,根据其材料大致可以分为传统工业脱色材料和新型脱色材料两类。
4.1.1.1 传统工业脱色材料
活性白土是一种粒径细、吸附率高的天然土状物质,是工业中最常用的油脂精炼材料,具有出色的脱除油脂中色素和杂质的能力。活性白土一般分为酸性白土和中性白土,其中酸性白土脱色效果要优于中性白土[54]。为了达到更好的脱色效果并降低能耗,有研究者采用高压电场辅助活性白土法进行脱色,结果显示,在保证脱色效果的前提下,采用高压电场辅助脱色可使活性白土的用量降低50%,处理时间缩短35%,处理温度降低28%。同时,该法可有效去除大豆油中90.47%的铁离子和100%的铜离子[55],具有节能高效的特点。Abbasi等[56]研究了超声波辅助下活性白土对橄榄油中叶绿素和类胡萝卜素的脱除效果,实验结果表明,没有超声波辅助的情况下(110 ℃、60 min),橄榄油中叶绿素和类胡萝卜素含量分别从9.70 μg/g和2.47 μg/g降到1.46 μg/g和0.82 μg/g。当引入超声波辅助后(60 ℃、30 min),两种色素含量可以进一步分别降至0.17 μg/g和0.50 μg/g。超声辅助同样可以有效缩短脱色处理的时间并降低脱色处理的温度,减少脱色过程造成的营养损失,被认为是更好的、能够替代传统脱色的方法。
活性碳是另一种工业上常用的油脂精炼材料,与活性白土相比,活性碳脱色后得到的油脂红值较低,不会给油脂带来异味。但是传统的活性碳价格昂贵、吸油率高,应用受到限制。Chetima等[57]以棉花和印楝籽壳为原料,经碳化和酸活化制备得到活性碳;将该活性碳应用于棉籽油的脱色,在吸附温度60 ℃、吸附时间45 min时,脱色效果达到最优,可以脱除原油中96%~98%的色素。这种新型的活性碳价格低廉、脱色效果好,可以作为传统活性碳的有效替代品。
4.1.1.2 新型脱色材料
新型脱色材料如硅酸、硅胶、中性氧化铝、聚酰胺等的出现为油脂脱色提供了新的解决方案。为达到100%脱除油脂中叶绿素、β-胡萝卜素等色素的效果,一般是将上述几种材料组合使用。Abad等[58]根据层析分离的原理开发出一种脱除油脂中色素的新方法,其操作流程如图6所示,将油脂与一定比例的正己烷混合后加入活性碳和硅酸中,在氮气保护下进行充分搅拌,然后经抽滤和旋转蒸发等工序脱除溶剂,得到成品油脂。该法不仅可以完全去除油脂中的色素,而且具有操作简单、耗时短的优点,可作为传统油脂脱色技术的有效补充。然而,上述几种新型脱色材料对油脂中微量成分脱除的选择特异性较差,即在脱除叶绿素等色素的同时,也会造成PS、不饱和脂肪酸等功能性物质和营养物质的流失。以菜籽油为例,在使用中性氧化铝脱除叶绿素和β-胡萝卜素的同时,油脂中游离脂肪酸被完全脱除,生育酚损失99.9%以上,PS损失15%以上[59-61]。因此在使用新型脱色材料对植物油脱色的同时,也应该充分考虑到油脂中其他成分的损失。另外,上述新型脱色材料价格较为昂贵、成本高昂,因此该法目前仅适用于科研等领域,大规模工业化和商业化还需要进一步发展。
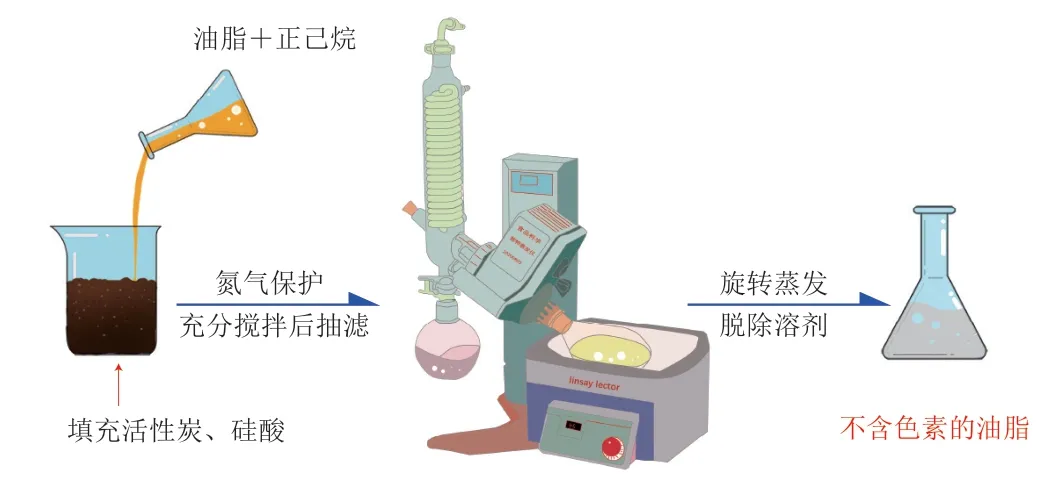
图6 层析分离技术结合新型脱色材料对油脂进行脱色[58]Fig. 6 Decolorization of lipids by chromatography combined with new decolorizing materials[58]
4.1.2 膜分离技术
膜分离技术作为一种非热分离技术,在油脂精炼领域如分离脱除植物油中水分、磷脂、游离脂肪酸、金属和色素方面已经的得到了较为广泛的应用。Dadfar等[62]研究了膜分离技术在橄榄油脱色中的应用,通过添加0.7%(以体系质量计,下同)的活性白土、0.3%的活性碳和5%的十二烷基硫酸钠溶液(0.05 mol/L)处理橄榄油,然后将其装入ETNA10PP型超滤膜池中;通过响应面法优化了包括压力2×105~4×105Pa、温度25~45 ℃和搅拌速率100~300 r/min在内的分离条件。对膜处理油的理化性质进行了评估,并将其与原油和工业脱色处理橄榄油进行了比较。结果表明,膜分离条件在压力3.7 bar(3.7×105Pa)、温度36.5 ℃、搅拌速率300 r/min时达到最佳分离效果,可以将类胡萝卜素和叶绿素含量分别降低71.3%和40.42%。ETNA10PP型超滤膜可以重复使用多次,此项技术可以作为传统油脂脱色工业的前处理步骤,是对传统脱色技术的有效补充。
Reddy等[63]研究了不同的高分子膜对葵花籽油中色素的分离效果,实验结果表明,以硅作活性层,分别以聚酰胺和聚砜作为支撑层的NTGS-2100和NTGS-1100型高分子膜,在压力为4.5 MPa,葵花油稀释液流速分别为0.15 kg/(m2·h)和0.47 kg/(m2·h)条件下,对叶绿素的分离率分别达到了95.6%和72.3%。通过对分离前后植物油稀释液紫外-可见吸收光谱的测定发现,NTGS-2100和NTGS-1100型高分子膜在分离植物油中叶绿素的同时类胡萝卜素得到了更为有效的脱除。但值得注意的是,此项高分子膜分离技术通常需要维持较高的压力,因此耗能较高,很大程度上限制了其发展;另外,压力与溶液流速、色素分离效果高度相关,后续应该优化最佳分离参数以探索其工业化商业化之路。
4.2 三线态氧的脱除与控制
油脂中溶解氧含量与自由基形成以及挥发性脂质氧化产物的产生有很大的相关性[64]。另外,由叶绿素等光敏剂激发形成1O2的量子产率也与油脂中溶解氧浓度呈正相关[65]。因此,为了有效控制油脂的光敏氧化,需严格控制油脂中溶解氧的含量[66]。
4.2.1 活性包装
活性包装指主动向包装食品或食品周围环境释放或吸收某类物质成分的新型食品包装技术,可分为活性清除系统(添加吸收剂)和活性释放系统(添加释放剂)[67];前者用来去除食品或食品环境中不需要的化合物,后者则通过释放剂将所需的化合物添加到包装食品体系或包装顶部空间。活性包装在食品中的具体应用见表2。

表2 活性包装在食品中的应用[67]Table2 Application of active packaging in foods[67]
3O2清除剂(oxygen scavenger,OS)是活性包装技术中最成功的应用之一[68],传统食品工业从食品包装中脱除3O2主要是通过真空包装工艺实现的。即使如此,包装中的残余氧体积分数仍通常保持在0.5%~5.0%之间,并可能随着储存时间的延长进一步增加。这主要是包装过程中排空不足、3O2通过包装材料渗入或包装密封性差、溶解在食品中的3O2逐渐释放到包装容器中等因素所导致。
活性包装中最常见的OS是铁基清除剂[69],在反应过程中铁基清除剂被氧化成稳定的三水合氧化铁复合物,消耗掉食品体系中的3O2。Mu Honglei等[70]研制并评估了一种使用铁纳米颗粒、活性碳、氯化钠和氯化钙混合的新型铁基OS。纳米铁基OS(平均粒径为110 nm)对3O2的清除能力几乎是微米级铁粉的1.4 倍,新型纳米铁粉可以快速地使密封包装内的溶解3O2和顶空3O2浓度稳定保持在较低水平,降低3O2受激发生成1O2的量子产率和产量,从而抑制食品中脂类物质的光敏氧化。
另一类常见的OS基于天然或生物成分,包括小分子抗氧化剂(如抗坏血酸和邻苯二酚)、耗氧孢子、酵母、大米提取物等[71]。这些小分子抗氧化剂不仅能够清除食品包装内的3O2,还可以淬灭包括1O2[20]在内的多种活性氧,其中抗坏血酸还可以与过渡金属(如铜)结合使用,以吸收食品系统中的3O2,并且金属-抗坏血酸复合物能够快速将反应过程中生成的过氧化氢还原为水,而不会形成任何自由基。
近年来,活性包装在脂类食品中的开发和应用都取得了很大的进步。然而,在应用活性包装脱除和控制食品中3O2的同时也应该充分认识到其存在的一些缺点:OS通常是封装在活性包装的隔层或小袋中[71],而这些隔层和小袋中的物质(如纳米铁粉)通常是不可食用的。如果这些隔层或者小袋出现缺陷,发生泄露,尤其是当这些缺陷的尺寸小于临界尺寸(标准检漏仪的检测极限为10 μm)时,会对食品本身造成严重污染[72]。
4.3 单线态氧淬灭与控制
除避光、清除3O2外,可在食品体系中添加适量的1O2淬灭剂,通过物理或化学作用机制,使1O2淬灭,从而防止脂类光敏氧化的发生。1O2淬灭剂可以分为天然淬灭剂和人工合成淬灭剂两大类。前者主要包括类胡萝卜素[73](尤其是番茄红素[74])、生育酚[75]、黄酮类化合物[76]等,后者包括食品工业中常用的特丁基对苯二酚(tert-butylhydroquinone,TBHQ)、丁基羟基茴香醚(butylated hydroxyanisole,BHA)和二丁基羟基甲苯(butylated hydroxytoluene,BHT)等[77]。为了更有效地淬灭1O2,国内外研究者在天然和人工合成1O2淬灭剂方面开展了诸多研究和探索,并取得了系列研究成果。
4.3.1 新型天然1O2淬灭剂
天然抗氧化剂通常是食物中存在的天然组分,因安全性高而更容易被消费者接受。Hajimohammadi等[77-78]用蒽作为1O2捕获剂,将西番莲(passiflora incarnateL.)的水醇提取物(hydroalcoholic of pasipay,HAP)与BHT、BHA、TBHQ的淬灭性能进行了比较,结果表明,上述4 种抗氧化剂对1O2淬灭性能从高到低依次为HAP>TBHQ>BHT>BHA。在抑制油脂光敏氧化方面,添加HAP(含0.457 6 mg黄酮类化合物)可使油酸与1O2的氧化作用降低约11%,说明HAP可有效淬灭脂质中的1O2,从而有效抑制脂肪酸的光氧化作用。
4.3.2 新型人工合成1O2淬灭剂
人工合成抗氧化剂具有高效、价廉的优点,在允许添加范围内使用对人体是安全无毒的。Hajimohammadi等[78]研究发现在紫外线或可见光照射下,2-硝基苯甲醛可有效阻断一系列不同测试样品中1O2的形成。将不同的硝基苯甲醛异构体与食品工业中使用的其他高效合成抗氧化剂(BHT、BHA、TBHQ)进行比较,结果表明,不同抗氧化剂对1O2的淬灭性能从高到低依次为2-硝基苯甲醛>TBHQ>3-硝基苯甲醛>BHA>4-硝基苯甲醛>BHT。此外,该化合物在300~575 nm相当宽的光谱范围内都表现出对光敏氧化形成的1O2有高度的淬灭作用,对脂肪酸的保护作用超过公认的抗氧化剂(BHT、BHA、TBHQ)。目前,该1O2淬灭剂已经进入安全评估阶段,正在考察其在体内的代谢以及可能产生的不良副作用,以确保其作为潜在食品添加剂的安全性。
4.4 光源的选择
为了吸引消费者,商家通常将油脂或者脂类食品采用透明包装并置于一定强度的光照下陈列,但由此也引发了食品中脂类物质的光敏氧化问题。为了尽可能减少辐照所引起的油脂氧化,有学者研究了不同光源对光敏氧化以及1O2生成速率的影响,试图寻求光照效果好但又不易引发食品中脂类物质光敏氧化的光源。
新鲜牛奶暴露在光照下产生异味是由Type I和Type II途径共同参与光敏氧化所导致的[79]:新鲜牛奶中含有的水溶性维生素——核黄素是典型的光敏剂,在光照下迅速引发光敏反应,导致牛奶中脂质氧化,生成醛类、酮类、酯类等多种氧化产物。Brothersen等[80]将含有1%脂肪并添加VA和核黄素的新鲜牛奶分别暴露在4 000 lx的LED光源和2 200 lx的荧光灯下照射24 h,结果表明,尽管LED的发光强度更高,但在荧光灯照射下牛奶的品质变化更大。在荧光灯下暴露12 h后便可检测出牛奶中的异味,而在LED光源下需24 h后才能检测到。与新鲜牛奶相比,核黄素的含量在荧光灯下暴露24 h后显著降低,而在LED光源下其含量基本保持不变,光敏氧化过程中核黄素本身的降解已被证明是Type II途径生成的1O2氧化所导致[17]。另外,暴露于荧光灯下时,乳脂肪被Type II途径生成的1O2氧化,所产生的二甲基硫醚[81]和1-辛烯-3-酮[82]含量均显著高于LED光源照射组,这两种物质分别是牛奶产生“阳光味”和“金属味”的主要呈味物质之一。
对于上述不同光源导致1O2生成速率的差异,目前还没有强有力证据支持的、得到业界同行公认的理论解释[84]。目前较为主流观点是不同光源的发光光谱不同,LED光源的光谱主要集中在460 nm的蓝光和500~600 nm的黄绿光附近(图7A),这种光谱分布使得LED在同等照度下亮度更高,而且光谱中不含紫外线。而对比荧光灯光谱可以发现,荧光灯发出的光包含400 nm以下的紫外线(图7B)。光敏机理表明,1Sen*到3Sen*的系间窜跃与1Sen*到1Sen的内部转化是竞争性关系,紫外线等较短波长的光可以使能量向前者倾斜,从而加强系间窜越机制的竞争力,使1O2生成效率更高[85],而这很可能是LED光源在控制Type II途径光敏氧化方面优于荧光灯的根本原因。
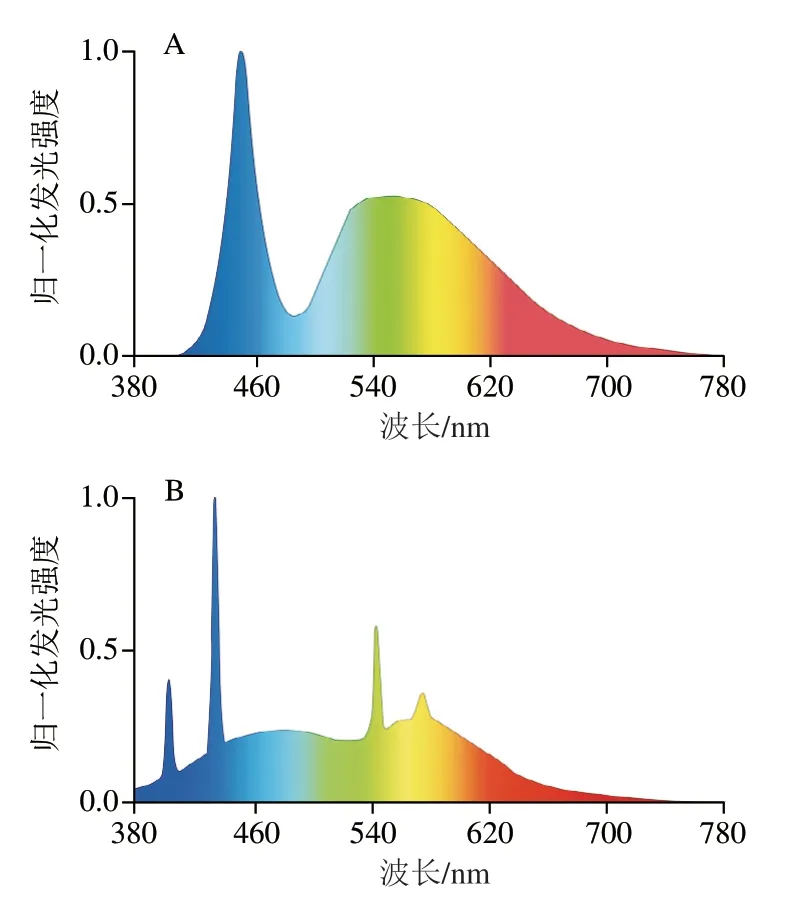
图7 LED灯(A)和荧光灯(B)的发光光谱[83]Fig. 7 LED (A) and fluorescent (B) emission spectra[83]
5 结 语
本文综述了脂类食品中1O2的形成途径、光敏氧化机理及甘油三酯和PS等常见脂类物质的光敏氧化,并从光敏剂和3O2的脱除与控制、1O2淬灭、光源选择等方面深入分析了食品中脂类物质光敏氧化控制的最新研究进展。然而,食品中脂类物质的光敏氧化除了通过Type II(主要途径)发生以外,在无光辐照情况下,1O2仍可通过烷基自由基歧化、酚类物质氧化、超氧阴离子与过氧化氢反应、氢过氧化物与羰基反应等多种途径生成[86],并由此引发后续脂类物质的氧化劣变。因此,为了有效控制由1O2引发的脂类氧化,在未来研究中应该加大对非Type II途径产生1O2的研究力度,深入解析其形成机理、影响因素,并提出安全、有效的控制手段,为全面控制由1O2引发的食品中脂类物质的氧化提供充分的理论基础和技术保障。
