接触脱水膜干燥对南美白对虾干复水特性的影响
2021-10-31范丽莉李亚敏汤海青欧昌荣
范丽莉,李亚敏,汤海青,欧昌荣,
(1.宁波大学食品与药学学院,浙江 宁波 315201;2.浙江医药高等专科学校食品学院,浙江 宁波 310053)
南美白对虾(Penaeus vannamei)肉质鲜美、口感细腻,富含不饱和脂肪酸、蛋白质、矿物质和维生素等多种营养物质,深受广大消费者的喜爱[1-2]。南美白对虾是当今世界养殖产量较高的三大虾类之一,自20世纪90年代初被我国引进养殖以来产量不断增加,2019年我国南美白对虾海水养殖产量达到114万 t[3-4]。南美白对虾自身水分和蛋白质含量较高,肌肉组织比较松软,常温下易腐败变质,贮藏时间短[5]。目前南美白对虾除鲜食、冻藏外,通常将其加工成虾干这一特色产品。传统干燥方法虽然能赋予虾干特定风味,但存在产品硬度过高、复水性差、难以咀嚼、口感差、消费者接受度低的缺点,寻找能改善虾干复水特性从而提高其食用品质的干燥方法对产业的发展具有重要的现实意义[6-7]。
接触脱水膜(contact dehydrating sheet,CDS)是由Numamoto等[8]发明的一种用适合于高蛋白食品的新型干燥方法,每个CDS单元由透水膜、高渗透剂和强吸水性物质组成。在干燥过程中,CDS与食品基质渗透压差驱动水分向CDS迁移实现脱水。CDS干燥有别于传统的干燥方法,它可以在低温贮藏过程中将高蛋白物料的水分脱除,条件温和,可以很好地维持蛋白质结构,使产品有更好的复水性能,保持产品较好的品质及感官特性。随着科技的发展,各种具有选择性透水功能的膜材料的成本越来越低[9],吸水性能较好、价格低廉的高分子吸水性物质也不断被开发出来,使得CDS技术成为一种有应用前景的高蛋白食品的干燥方法[10]。有研究表明,利用CDS包装牛肉和金枪鱼,CDS包装可以减缓肌红蛋白和脂肪的氧化,有效保持牛肉和金枪鱼的鲜味,从而延长食品的保存时间,提高食品的食用价值[11-12]。Yoshikos等[13]采用CDS技术对油炸食品进行干燥,发现CDS干燥既可以延缓食品的变质,又能显著提高其口感。Arakawa等[14]研究了CDS脱水对牛肉和金枪鱼品质的影响,发现CDS脱水不会将矿物质等成分除去,有利于营养物质的保持。本课题组前期研究结果表明CDS脱水的对虾复水后的感官特性等指标更加接近鲜虾[15],但虾干复水特性及复水后水分分布状态和蛋白质结构变化鲜见报道。
为此,本研究采用CDS脱水至不同水分质量分数南美白对虾干的蛋白质结构、复水特性及相互关系,旨在为CDS冷脱水技术应用于南美白对虾及其他高值水产品的干制提供理论依据和指导。
1 材料与方法
1.1 材料与试剂
南美白对虾(35 尾/500 g)购自宁波水产市场,4 ℃冰袋活体1 h内运至实验室。对虾处于低温昏迷状态时置于自来水中清洗干净,去除虾头及虾壳得到虾仁,沥干水分备用(水分质量分数为75%)。
玻璃纸 横望山农业科技有限公司;高分子吸水树脂 海市复纳新材料科技有限公司。
1.2 仪器与设备
DHG-9070A电热恒温鼓风干燥箱 上海精宏实验设备有限公司;H1850冷冻离心机 湖南湘仪实验室仪器开发有限公司;MB27水分测定仪 常州奥豪斯仪器有限公司;MesoMR23-060H.I核磁共振分析及成像系统上海纽迈电子科技有限公司;InVia-reflex型激光共聚焦拉曼光谱仪 英国REN-ISHAW公司。
1.3 方法
1.3.1 样品制备
CDS脱水:如图1所示,将混合后的高分子树脂、长绒棉和甘油均匀分散在允许水选择性透过的两层玻璃纸之间。高分子树脂具有吸收与储存大量水分的作用,长绒棉使甘油与高分子树脂均匀稳定地分散于两层玻璃纸之间[8],甘油可以作为媒介传递水分子。高分子吸水树脂、长绒棉、甘油的添加量分别为200、48、40 g/m2。用CDS包裹虾仁后在4 ℃下贮藏脱水。参考文献[15]的方法确定脱水曲线,当虾仁水分质量分数分别为60%、45%、30%时取样(分别记为CDS-60%、CDS-45%、CDS-60%),测定表面疏水性及拉曼光谱等表征蛋白质结构的指标,复水过程中测定复原率、持水力及水分状态分布等复水指标。
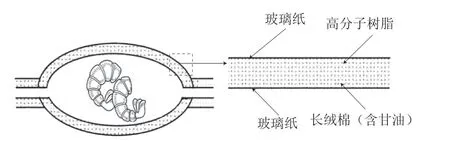
图1 CDS干燥及其横截面示意图Fig. 1 Schematic illustration of CDS drying and cross-sectional diagram of CDS
热风干燥(hot air drying,HAD)[16]:将虾仁单层均匀平铺于筛网上,放置在50 ℃的恒温鼓风干燥箱内进行干燥,风速为2.1 m/s,参考脱水曲线,当虾仁脱水至水分质量分数分别为60%、45%、30%时(分别记为HAD-60%、HAD-45%、HAD-30%)取样,测定相关指标。
1.3.2 水分质量分数测定
水分质量分数的测定参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》干燥法,用水分测定仪测定。精确称取2 g绞碎的虾肉均匀分布于铝盒中,放下仪器罩,选用自动模式,温度设置105 ℃,测定样品的水分质量分数。
1.3.3 复原率测定
常温下将虾干放入蒸馏水中复水,分别于0、20、40、60、80、100、120、140、160、180 min取样,用吸水纸吸去表面水分,测定其质量。按式(1)计算复原率[17]。

式中:mg为鲜虾的质量/g;mr为虾干复水后的质量/g。
1.3.4 持水力测定
虾干复水后持水力测定参考Kocher等[18]的方法并有所改动。将复水后的虾干表面水分用吸水纸除去,称质量后,用滤纸包裹放入离心管,在4 ℃条件下12 000×g离心20 min,记录复水虾仁的质量。每组样品测定3 次。按式(2)计算样品的持水力。
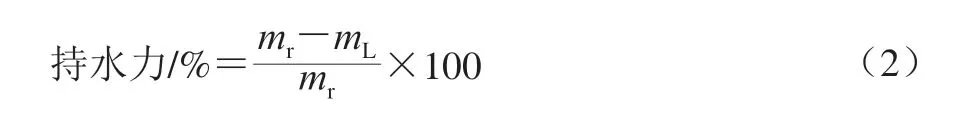
式中:mL为虾干离心后的质量/g;mr为虾干复水后的质量/g。
1.3.5 低场核磁共振测定水分状态分布
沿肌纤维方向将对虾分割成2 cm×1 cm×1 cm(质量约为5.0 g)的肉样,置于60 mm探头线圈中进行检测,采用核磁共振分析软件中的Carr-Purcell-Meiboom-Gill脉冲序列[19]采集样品“自旋-自旋”弛豫时间T2的信号。质子共振频率为23.318 MHz,磁体强度0.52 T,线圈直径为60 mm,磁体温度为32 ℃。T2测试参数:90°脉冲宽度P1=20 μs,180°脉冲宽度P2=36 μs,接收机谱宽100 kHz,重复时间为3 000 ms,回波时间为0.4 ms,模拟增益为20,数字增益为3,循环次数为4,回波个数为2 000。每个测试3 个重复。采用迭代法将采集到的T衰减曲线代入弛豫模型中进行Bi-指数拟合并反演,反演结果做归一化处理。
1.3.6 表面疏水性指数的测定
参考Benjakul等[20]的方法并稍作修改。肌动球蛋白溶液用10 mmol/L磷酸缓冲液(含0.6 mol/L的KC1,pH 7.0)稀释至一定质量浓度(0~1 mg/mL),分别取2 mL上述溶液,加入10 μL 8 mmol/L的8-苯胺基-1-萘磺酸盐(8-anilino-1-naphthalene sulfonate,ANS),混合均匀后于暗处放置10 min,在酶标仪的荧光扫描模式上测定荧光强度(激发波长为390 nm,发射波长为468 nm)。以荧光强度对肌动球蛋白质量浓度作曲线,曲线初始阶段斜率即为样品的表面疏水性指数。
1.3.7 拉曼光谱分析
取对虾腹部前两节切成1 cm×1 cm×0.1 cm的长方体置于载玻片上,用20 倍长聚焦镜头将激光聚焦于载玻片上的样品在室温下测定。参数设置:785 nm的Innova 70氩离子激光器,功率为200 mW,分辨率为1 cm-1,扫描范围为500~3 500 cm-1,每个样品扫描30 次,获取400~3 500 cm-1处的拉曼光谱,用Labspec软件对光谱进行基线校正去除荧光背景,并以苯丙氨酸(1 003 cm-1)作为内标进行归一化处理。用高斯函数和洛伦茨函数对不同处理的谱带进行拟合分峰。
1.4 数据处理与分析
实验数据使用Excel软件进行处理,采用Origin 8.5软件进行绘图,采用SAS 8.0软件进行单因素方差分析,采用Duncan多重比较进行差异显著性检验,其中P<0.05表示差异显著。
2 结果与分析
2.1 两种干燥方法对南美白对虾干复原率的影响
复原率反映了干燥方法对食品理化性质的影响,是评价干燥食品品质的指标之一,复原率越大,产品质量越好[17]。如图2所示,随着复水时间的延长,虾干复原率都呈上升趋势,CDS脱水的虾干复原率、复原速率均高于相同水分质量分数的HAD脱水组。复水180 min后,CDS脱水组水分质量分数为30%的虾干复原率为85.22%,明显高于HAD脱水组(62.55%)。HAD脱水由于高温导致蛋白质表面的亲水基团遭到破坏,组织结构致密,复水时水分较难渗入,导致复原率和复原速率小于CDS脱水组[21]。CDS冷脱水条件温和,制备的虾干蛋白质热变性较小、肌纤维损坏程度较低,能够保持虾肉的多孔组织结构完整,有较高的复原率。与HAD脱水相比,CDS脱水在低温下进行,减缓了体积皱缩和蛋白质结构的变化程度,对虾原有的结构破坏较小,使复水后的虾干品质与鲜虾较为接近。
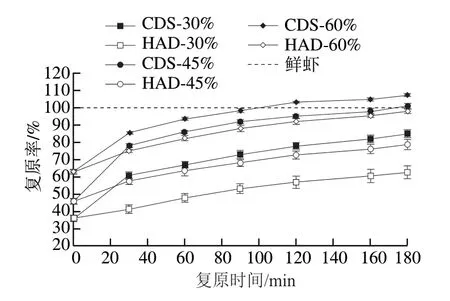
图2 CDS干燥和HAD对不同水分质量分数南美白对虾干复原率的影响Fig. 2 Effects of CDS drying and HAD on rehydration ratio of Penaeus vannamei dehydrated to different moisture contents
2.2 两种干燥方法对南美白对虾干复水后持水力的影响
持水力是指在一定的外力作用下,样品束缚自身或外加水分的能力,是评价水产品品质的重要指标之一[22]。如图3所示,采用CDS脱水和HAD干燥至不同水分含量状态的虾干,其水分质量分数越小,复水后保持水分的能力越低。水分质量分数相同时,CDS脱水虾干复水后持水力均高于HAD处理组,当虾干水分质量分数为30%时,复水结束后CDS组的持水力为69.17%,显著高于HAD组(65.73%)。CDS脱水条件温和,虾干的蛋白质结构破坏较小,肌原纤维原有的网状结构得到保持,使得对虾具有较好的持水能力[23]。HAD脱水的对虾持续加热使活性氧的含量增大,抑制了线粒体钙泵活性,使得乳酸含量增加,导致蛋白质变性,虾肉结合水的能力下降[24]。
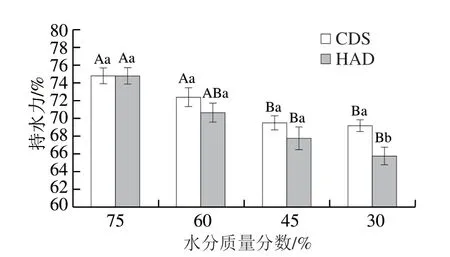
图3 CDS干燥和HAD制备的不同水分质量分数南美白对虾干复水180 min后持水力的变化Fig. 3 Changes in water-holding capacity of Penaeus vannamei dehydrated to different moisture contents by CDS drying and HAD after rehydration for 180 min
CDS脱水至不同水分质量分数虾干复水后的理化指标均接近鲜虾,为进一步研究虾干复水过程中内部结构的变化,本研究利用低场核磁共振和拉曼光谱技术分析水分质量分数30%的虾干复水后水的分布状态及蛋白质结构的变化。
2.3 两种干燥方法对南美白对虾干复水过程中水分状态分布的影响
弛豫时间(T2)主要由分子内部偶极-偶极相互作用引起的,它反映了虾干制品中水分子的流动性,T2值越大,说明水分流动性越大。应用T2拟合软件分析可得自由水、不易流动水和结合水的相对含量[25-26]。图4是经两种干燥方法脱水的虾干复水过程中低场核磁共振的T2分析图谱,产生的3 个峰代表不同的水分状态,即结合水T21(0.01~1 ms)、不易流动水T22(1~100 ms)和自由水T23(>100 ms)。同种干燥方式复水过程中对虾干的T2弛豫图谱向长弛豫时间方向移动,表明随着复水时间的延长,T2逐渐右移。复水90 min时,与HAD脱水虾干T2相比,CDS虾干的T2更接近鲜虾,表明CDS脱水的虾干复水能力较强,可能是CDS脱水是在低温下进行的,条件温和,虾干组织内部结构破坏较小,有利于水分的吸收和保持[27]。
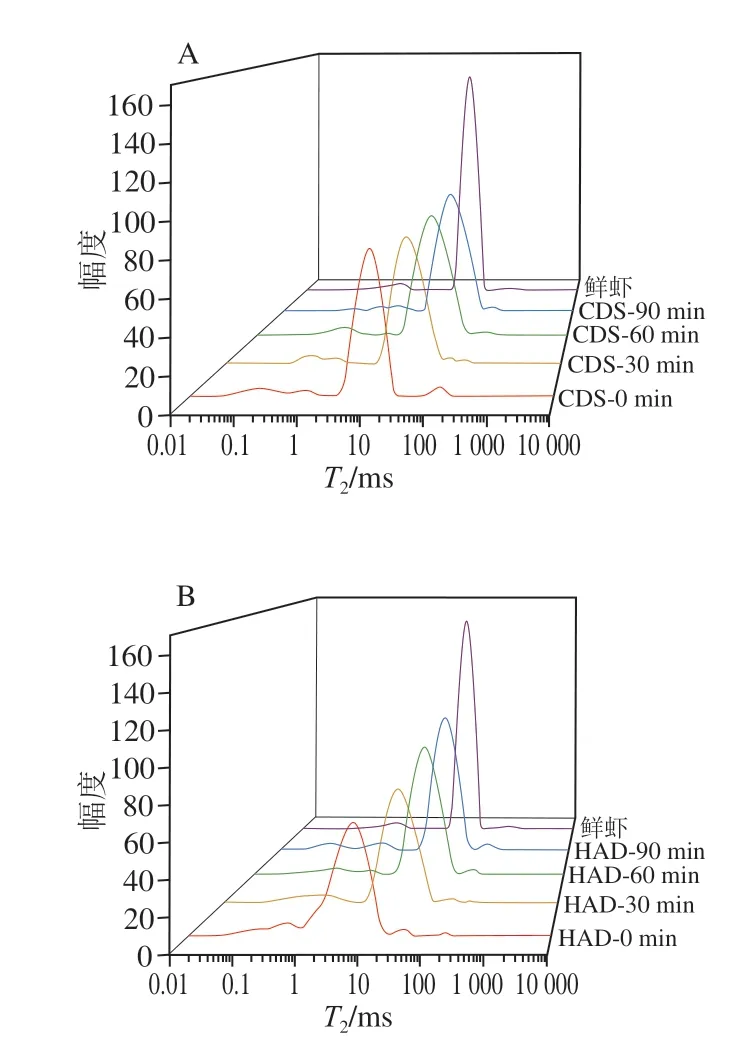
图4 CDS干燥(A)和HAD(B)制备水分质量分数30%的南美白对虾干在不同复水时间的T2弛豫图谱Fig. 4 Transverse relaxation time (T2) spectra of Penaeus vannamei dehydrated to 30% moisture content by CDS drying (A) and HAD (B) at different rehydration times
根据图4计算两种干燥方法处理的虾干复水过程中结合水、不易流动水、自由水的峰面积占总峰面积的相对比例(即A21、A22、A23),结果如图5所示。不易流动水的峰面积显著高于其他两种形式的水分,不易流动水是对虾主要水分状态的存在形式。结合水比例逐渐降低、自由水比例基本无变化,表明水分逐渐进入对虾体内,并与对虾细胞组织结合存留在南美白对虾体内。在复水终点,CDS脱水对虾的结合水比例为4.23%,不易流动水比例为94.49%,自由水比例为1.28%;在复水终点,HAD脱水对虾的结合水比例为7.81%,不易流动水比例为90.56%,自由水比例为1.63%;鲜虾的结合水比例为3.68%,不易流动水比例为95.84%,自由水比例为0.48%。由此推断,CDS脱水对虾复水后的虾干比HAD处理组更接近鲜虾,CDS脱水组虾干的复水能力大于HAD脱水组。其主要原因是蛋白质二级结构的致密性明显高于HAD脱水组,氨基酸残基的暴露程度较低,使水分有较充足的结合位点[28]。另外,CDS脱水后的虾干肌肉组织结构仍具有网状结构,使其具有保存水分的空间,从而提高保持水分的能力。
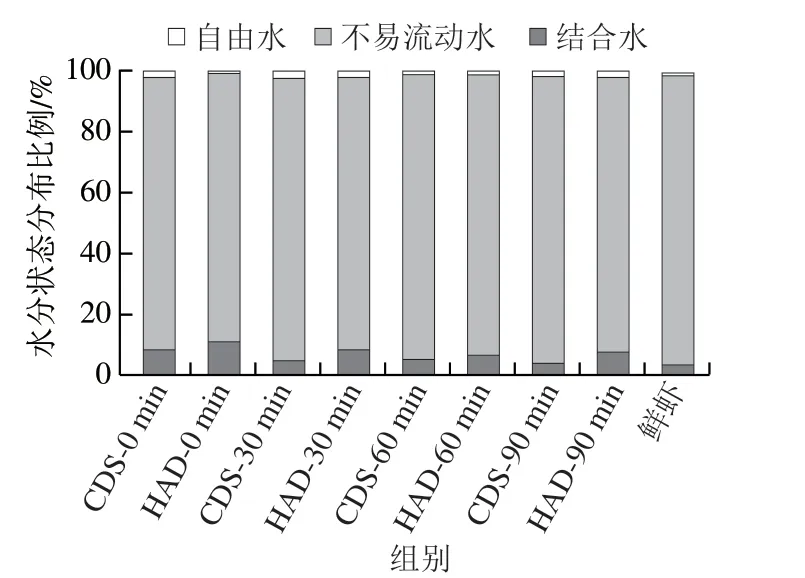
图5 CDS干燥和HAD制备水分质量分数为30%的南美白对虾干在不同复水时间的水分状态相对含量Fig. 5 Proportions of three water states in Penaeus vannamei dehydrated to moisture content of 30% by CDS drying and HAD at different rehydration times
2.4 两种干燥方法对南美白对虾干蛋白表面疏水性的影响
蛋白质表面疏水性表征蛋白质分子内部疏水基团的暴露程度,可用来评价蛋白质的变性情况[29]。表面疏水性指数可以反映表面疏水性的大小。由图6可知,CDS脱水程度越高,虾干表面疏水性越大,说明在脱水过程中,肌动球蛋白的空间结构发生变化,亲水基团和疏水基团的相对位置发生变化,疏水性氨基酸残基逐渐暴露于蛋白质分子表面,使肌动球蛋白的表面疏水性增加[30]。经HAD脱水至不同水分质量分数的虾干,随脱水程度增加,表面疏水性先升高后下降。由于高温导致蛋白质的构象发生变化,内部疏水性残基暴露,使得蛋白质表面疏水性增大。持续高温使蛋白质发生聚集和侧链间的反应,少量疏水性残基包埋于肌动球蛋白内部,蛋白质进一步变性,表面疏水性变小[31]。这与CDS脱水的虾干复原率高于HAD脱水虾干的结果相对应。
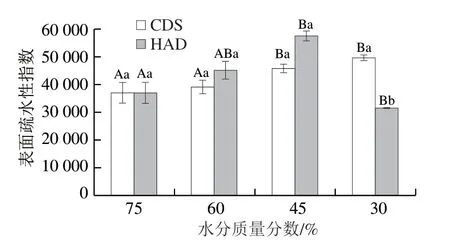
图6 CDS干燥和HAD制备的不同水分质量分数南美白对虾干肌动球蛋白表面疏水性指数的变化Fig. 6 Changes in surface hydrophobicity of actomyosin in Penaeus vannamei muscle dehydrated to different moisture contents by CDS drying and HAD
2.5 两种干燥方法的南美白对虾干肌原纤维蛋白拉曼光谱分析结果
通过比对蛋白质拉曼光谱特征峰位置、强度以及峰面积信息,可以解释不同干燥方法对南美白对虾干蛋白结构变化的具体影响。参考文献[32]对肽键骨架振动和氨基酸侧链光谱条带进行分析。
拉曼光谱在1 600~1 700 cm-1附近出现的谱带为酰胺I带,它与蛋白质骨架构象类型相关,主要涉及C-N的伸缩振动、C=O的面内伸缩振动及N-H的面内弯曲振动等,常用来估算蛋白质的二级结构相对含量[33-34]。由图7可知,两种干燥方式的对虾与鲜虾相比酰胺I带都向高波数偏移,水分质量分数相同时,相较于鲜虾(1 654.15 cm-1)的偏移程度,HAD组的偏移程度大于CDS组。由图8可知,随脱水程度增加,两种方法干燥的对虾α-螺旋相对含量都呈下降趋势。与鲜虾相比,脱水至不同水分质量分数虾干的β-折叠、β-转角和无规卷曲含量都发生了相应的变化,表明在干燥过程中多肽链发生了重排。在干燥过程中,CDS脱水的α-螺旋相对含量一直高于相同水分质量分数HAD脱水组,是因为CDS脱水是在低温下进行的,可以减弱因高温造成的肽链内的氢键断裂、肽链解旋以及转变为松散的β-转角或无规卷曲结构。南美白对虾蛋白的二级结构一旦发生较大变化,其持水力也会发生相应的改变,这与图3中CDS脱水虾干的持水力大于HAD脱水组的结果相吻合,与高瑞昌等[35]研究的凡纳滨对虾肌肉蛋白质的热变性与持水力的变化结果相似。
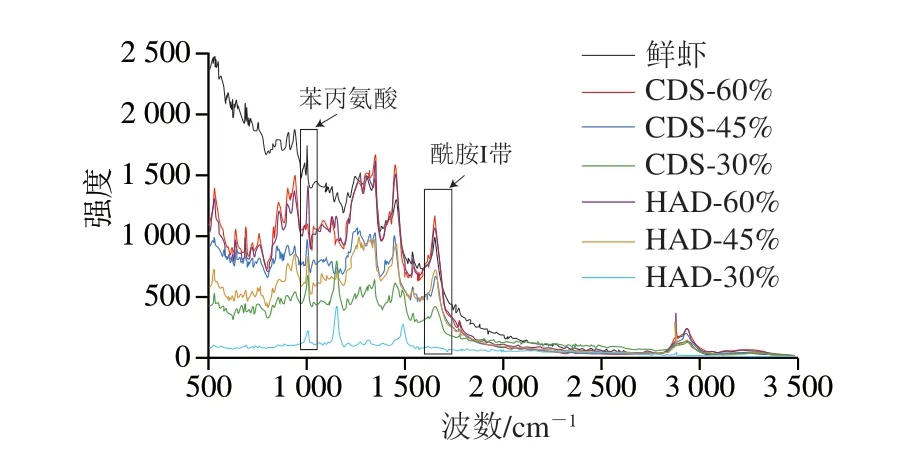
图7 CDS干燥和HAD制备的不同水分质量分数南美白对虾干肌原纤维蛋白的拉曼光谱Fig. 7 Raman spectra of myofibrillar protein of Penaeus vannamei dehydrated to different moisture contents by CDS drying and HAD
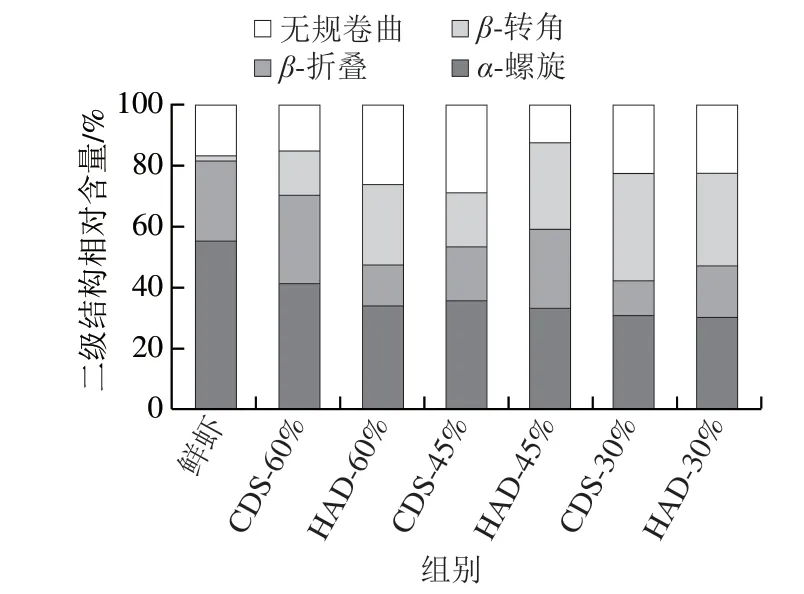
图8 CDS干燥和HAD制备的不同水分质量分数南美白对虾干蛋白质酰胺I带二级结构的相对含量Fig. 8 Relative contents of secondary structure fractions estimated from amide I band of proteins in Penaeus vannamei muscle dehydrated to different moisture contents by CDS drying and HAD
拉曼光谱中二硫键的特征波数为500~550 cm-1,它与分子内部和分子间的巯基和二硫键相互转化有关[36]。如表1所示,随着水分质量分数的降低,I510、I525、I545呈显著降低的趋势(P<0.05)。水分质量分数相同时,CDS脱水虾干的I510、I525、I545、I936均高于HAD组,水分质量分数为30%时,HAD脱水的虾干在510 、525、545 cm-1处的吸收峰几乎消失,可能是干燥过程中蛋白质二级结构逐渐松散,导致支撑三级结构的二硫键断裂,进而造成二硫键伸缩振动的相对强度降低[37]。在干燥过程中,CDS脱水是在低温下进行的,减弱了高温导致的蛋白质结构变性。

表1 CDS干燥和HAD制备的不同水分质量分数南美白对虾干蛋白拉曼光谱的相对强度变化Table1 Changes in normalized intensity of Raman spectra of Penaeus vannamei muscle dehydrated to different moisture contents by CDS drying and HAD
拉曼光谱中760 cm-1附近的谱带表征色氨酸残基的微环境,I760下降反映了色氨酸残基从包埋的疏水环境暴露在极性环境中[38]。如图9A所示,干燥能引起I760下降,与水分质量分数为75%的新鲜南美白对虾(1.11)相比,CDS-30%组I760降低至0.45,HAD-30%组则降低至0.14。水分质量分数相同时,CDS脱水组I760均高于HAD脱水组。说明两种干燥方式均会导致色氨酸残基由包埋于蛋白质结构内部逐渐“暴露”到极性环境中;水分质量分数越低对虾蛋白质暴露的程度越高;CDS脱水组的色氨酸残基在极性环境中暴露程度低于HAD脱水组。
830、850 cm-1附近的费米共振双峰反映了酪氨酸残基对位取代苯的振动[39]。I850/I830反映酪氨酸残基的暴露与包埋情况,是监测酪氨酸残基微环境的有效探针。如图9B所示,新鲜对虾的I850/I830为0.97,表明其肌动球蛋白中维持原先稳定结构的氢键断裂,酪氨酸部分包埋在疏水环境中或作为中度弱氢键的受体和供体与溶剂水分子相互作用。随着水分质量分数的降低,两种干燥方法的I850/I830呈上升趋势,表明酪氨酸残基逐渐暴露于极性环境中,蛋白质的表面疏水性增加。水分质量分数相同时,HAD脱水组虾干的I850/I830高于CDS脱水组,表明CDS脱水的样品酪氨酸残基暴露程度较低,与水分结合的能力较高,持水力较好。
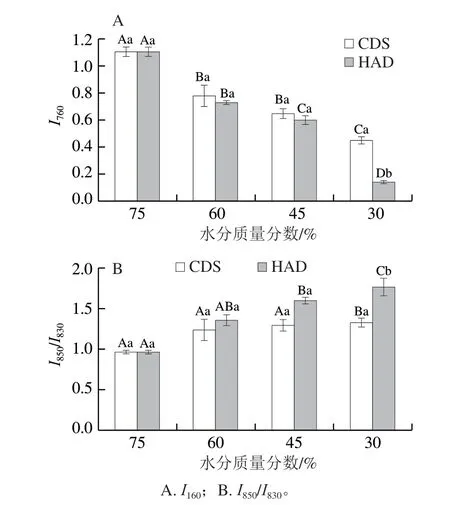
图9 CDS干燥和HAD制备的不同水分质量分数南美白对虾干蛋白质拉曼光谱相对强度的变化Fig. 9 Changes in relative Raman spectral intensity of proteins in Penaeus vannamei dehydrated to different moisture contents by CDS drying and HAD
936 cm-1附近的谱带强度主要来自于C-C骨架振动,也是α-螺旋结构的特征谱带。谱带的减弱或消失说明α-螺旋转化成β-折叠或者无规卷曲结构[40]。由表1可知,两种干燥方法的虾干水分质量分数越低,I936越小。在干燥过程中,CDS脱水组的I936均高于HAD组。表明与HAD脱水相比,CDS脱水的对虾α-螺旋结构能得到保持,HAD组的α-螺旋结构被破坏并转化为β-折叠或者无规卷曲的程度更大。高温会触发肽段发生构象重排运动,新的分子构象以“错误”的方式折叠,使蛋白质的二级结构发生根本改变,导致其功能特性减弱。
3 结 论
与热风干燥法相比,CDS脱水避免了加热导致的蛋白质结构变性,使虾干有更好的复原率和持水力。虽然CDS脱水所需时间比热风干燥长,但它利用渗透压的作用,在低温贮藏过程中完成对水产品的脱水,处理条件温和,在干燥过程中对蛋白质结构和功能损伤较小,因而得到的产品具有更好的复水能力,从而避免了传统虾干复水性能差,复水后产品过硬,难以咀嚼的缺点,更易被消费者接受。因此,CDS是一种理想的新型冷脱水技术,在高值水产干制品的制备方面具有良好的应用前景。
