安罗替尼联合多西他赛二线治疗晚期肺鳞癌的临床研究(ChiCTR1900020917)
2021-10-29谢王踢翁洁文芳沈二栋罗盘
谢王踢 翁洁 文芳 沈二栋 罗盘

【摘要】目的 探讨安罗替尼联合多西他赛二线治疗晚期肺鳞癌的疗效及安全性。方法 选取2019年1月至2020年6月本院收治的晚期肺鳞癌患者30例,随机分为联用组(n=15)和单药组(n=15)。联用组给予安罗替尼(12mg·d-1,第1天至第14天,21天为一个周期)联合多西他赛(60 mg·m-2,静脉滴注,第1日)治疗。单药组给予多西他赛单药(60 mg·m-2,静脉滴注,第1日)治疗,直至疾病进展(PD)或不良反应不可耐受。分析两组患者的总有效率、疾病控制率(DCR)、不良事件发生率、无进展生存期(PFS)。结果 中位随访时间16.6个月,联用组和单药组的DCR分别为82.35%和31.15%,两组相比有 显著差异(P=0.005);联用组最常见的Ⅲ~Ⅳ级不良事件为粒细胞减少(6.67%),与单药组(6.67%)比较差异无显著意义(P=0.701)。联用组和单药组的中位PFS 分别为7.2个月(95%CI:6.5~14.2)和 2.4个月(95%CI:1.4~3.4),两者相比,差异有显著意义(P=0.005)。结论 安罗替尼联合多西他赛二线治疗晚期肺鳞癌疗效显著,不良反应可控,值得临床推广。
【关键词】多西他赛;安罗替尼;肺鳞癌;二线治疗
基金项目:岳阳市科技局一般项目(2019YY0065)
[中图分类号] R734.2 [文献标志码] A
肺癌是全球目前发病率及死亡率最高的恶性肿瘤,其中约80%以上为非小细胞肺癌(non-small cell lung cancer,NSCLC),大部分患者一经确诊已为晚期,治疗难度非常大。国内外临床上治疗驱动基因阳性晚期肺鳞癌一线治疗首选靶向治疗,无驱动基因的晚期肺鳞癌一线首选免疫治疗或/和含铂双药联合化疗,但大部分晚期肺鳞癌患者因缺乏明确驱动基因的靶向治疗,另外免疫治疗费用太高,而选择含铂双药联合化疗后会因先后出现耐药而最终复发或转移。多西他赛(docetaxel)单药为晚期肺鳞癌标准的二线化疗方案之一,其有效率只有10%左右。如何提高晚期肺鳞癌二线治疗的疗效是目前的研究方向与热点,其中抗血管生成治疗联合化疗是目前临床研究的热点之一,安罗替尼(anlotinib)作为我国自主研发的新型小分子抗血管生成靶向药物,具有很强的抗血管生成活性及口服给药方便等特点,已在晚期肺腺癌中显示出良好疗效。本研究旨在探索安罗替尼联合多西他赛作为二线治疗方案在晚期肺鳞癌中的疗效及安全性。
1 资料与方法
1.1研究对象 选择本院肿瘤科2019年1月至2020年6月收治的晚期肺鳞癌患者。纳入标准:(1)病理及细胞学检查明确为外周型肺鳞癌;(2)年龄≥18 岁;(3)一线治疗后进展;(4)化疗前血常规、血生化及心电图等检查无异常;(5)卡氏评分(KPS评分)≥60分;(6)预计生存期>3个月。排除标准:(1)一线治疗已行包含多西他赛药物化疗;(2)依从性差;(3)有严重的基础疾病者(包括高血压及糖尿病未控,有出血倾向或正接受抗凝治疗者);(4)近期曾有超过2 mL出血史。经筛选后共纳入30例患者,经本院肿瘤科病例随访系统随机分组:分为多西他赛单药治疗组(单药组)15例和安罗替尼联合多西他赛治疗组(联用组)15例。
1.2分组及给药 本研究方案经岳阳市一人民医院医学伦理委员会审查批准,所有患者治疗前均被告知目前标准治疗方案及替代治疗方案并签署知情同意书。采用电脑随机分组,分为联用组(n=15)及单药组(n=15),联用组给予安罗替尼12 mg·d-1治疗(生产厂家:正大天晴制药,批号:国药准字H20180004,规格:12mg*7片,po,第1日至第14日,21 d为1个周期)。多西他赛75 mg·m-2 (生产厂家:江苏恒瑞制药,批号:国药准字H20020543,规格:20mg*1支,静脉滴注,第1日)联合单药组给予多西他赛(60 mg·m-2,静脉滴注,第1日)单药治疗,直到疾病进展或出现不可耐受的不良反应。出现Ⅳ级骨髓抑制者下个周期化疗药物剂量降低25%。如出现Ⅲ~Ⅳ级安罗替尼相关不良事件,则安罗替尼依次减量至每日10 mg/8mg。
1.3观察指标 本研究的主要观察指标为无进展生存期(PFS),次要观察指标为总缓解率(ORR)、疾病控制率(DCR)及不良反应。
1.4评定标准 疗效评价参照RECIST 1.1版,其中疗效评价包括完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD); ORR= (CR+PR)/總例数×100%;DCR=(CR+PR+SD)/总例数×100%,每2个周期化疗后复查头部MRI及颈胸腹部CT进行疗效评价。不良反应参照国家癌症研究所(NCI)指定的CTCAE 4.0版关于不良反应的评价标准。我科为国家临床药物试验基地之一,患者数据根据我科登记随访系统进行统计。所有患者采用返院复查或电话方式随访,主要针对日间化疗患者。
1.5统计学分析 所有数据采用 SPSS22.0分析处理,定性资料采用卡方检验,定量资料组间比较采用t检验,生存分析采用Kaplan-Meier法,生存期组间比较采用Log-rank法,均以P<0.05 为差异有显著意义。
2 结 果
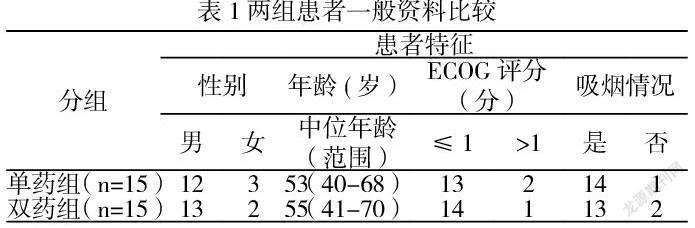
2.1一般资料 本研究共纳入33例晚期肺鳞癌患者,其中3例患者因治疗期间使用其他抗肿瘤治疗而退组,共纳入研究30例患者,电脑随机分为两组,其中联用组15例,男性13例,女性2例,中位年龄55岁;单药组15例,男性12例,女性3例,中位年龄53岁,两组各项资料均具有可比性,无显著差异(P>0.05),见表1。
2.2療效分析 联用组中位化疗8.4(4~20)个周期,单药组中位化疗2.8(2~10)个周期。两组均无患者达到CR。联用组和单药组的ORR分别为28.67%和10.62%,两组相比差异有统计学意义(P=0.03);联用组和单药组的DCR分别为82.35%和31.15%,两组相比差异有显著意义(P=0.005)。
2.3不良事件及安全性分析 联用组最常见的不良反应为Ⅲ-Ⅳ级粒细胞减少。联用组和单药组Ⅲ~Ⅳ级粒细胞减少发生率分别为6.67% 和6.67%,两者相比差异无显著意义(P=0.701)。联用组中手足综合症1例、蛋白尿1例、咯血1例、高血压1例,静脉血栓2例,均为Ⅰ~Ⅱ级,见表3。
2.4随访及PFS 本研究随访至2021年3月,中位随访16.6个月。联用组3例患者需化疗剂量减量,1例患者安罗替尼减量至每日8mg(咯血患者),没有治疗相关性死亡。联用组和单药组的中位PFS 分别为7.2个月(95%CI:6.5~14.2)和 2.4 个月(95%CI:1.4~3.4),两者相比差异有显著意义(P=0.005),见图1。
3 讨 论
肺鳞癌为非小细胞肺癌常见病理类型,其发病率约占非小细胞肺癌的40%左右。绝大多数晚期肺鳞癌患者驱动基因阴性缺乏靶向治疗,含铂双药化疗是晚期肺鳞癌的标准一线治疗方案。除了化疗外,PD-1/PD-L1抑制剂免疫治疗也成为晚期肺鳞癌的一线标准治疗方案,KEYNOTE-042研究结果显示帕博利珠单抗单药较化疗能显著延长PFS(中位10.3个月 vs. 6.0个月)且不良反应发生率低于化疗组。KEYNOTE-407研究结果显示帕博利珠单抗单药联合化疗较单纯化疗能显著延长PFS(中位6.4个月 vs. 4.8个月)且不良反应未显著增加。然而,大多数患者经历一线化疗后10个月内会出现疾病进展。既往的Ⅲ期多中心随机对照试验证实单药多西他赛或吉西他滨是晚期肺鳞癌标准的二线治疗方案,然而近年来OAK研究及KEYNOTE-010研究结果均显示免疫治疗较单纯化疗在晚期肺鳞癌患者二线治疗中均有OS获益,PD-1/PD-L1抑制剂免疫治疗也已成为晚期肺鳞癌的二线治疗新标准。
安罗替尼是一种新型小分子多靶点酪氨酸激酶抑制剂, 能有效地抑制血管内皮细胞生长因子受体( Vascular endothelial growth factor receptor,VEGFR) 、血小板衍生生长因子受体(Platelet-derived growth factor receptors,PDGFR)、成纤维生长因子受体和干细胞生长因子受体等激酶的活性,进而发挥抗肿瘤血管生成和抑制肿瘤生长的作用。ALTER0303研究中病理类型亚组分析结果显示,肺腺癌和肺鳞癌患者均可从盐酸安罗替尼治疗中获益,目前CSCO肺癌指南推荐三线应用安罗替尼治疗晚期肺腺癌。
本研究结果显示,联用组在晚期肺腺癌的二线治疗中显示出良好疗效。其中联用组和单药组的中位PFS 分别为7.2个月和2.4个月,两组的ORR分别为28.67%和10.62%,DCR分别为82.35%和31.15%,两组比较差异均具有统计学意义。
安罗替尼常见的不良反应包括粒细胞减少、血小板减少、高血压、蛋白尿和手足综合征等,本研究中联用组的不良反应均有所提高,其中主要为Ⅲ-Ⅳ级粒细胞减少,为化疗减量的主要原因。1例患者出现咯血,为安罗替尼减量的主要原因。安罗替尼相关的其他不良反应如手足综合征、高血压、蛋白尿、静脉血栓形成均为Ⅰ~Ⅱ级。结果显示联合治疗的不良反应总体可控。
综上所述,联用组与单药组相比,可显著提高晚期肺鳞癌二线治疗的ORR、DCR及中位PFS;另外,安罗替尼联合多西他赛治疗的不良反应可控,值得临床推广。然而本研究样本较少,结论的可靠性还有待于前瞻性的多中心随机对照研究进一步证实。
参考文献:
[1] Bray F, Ferlay J, Soerjomataram I,et al. Erratum: Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2020,70(4):313.
[2] Weihua Li , Lei Guo , Yutao Liu,et al. Potential Unreliability of Uncommon ALK, ROS1, and RET Genomic Breakpoints in Predicting the Efficacy of Targeted Therapy in NSCLC[J]. J Thorac Oncol, 2021, 16(3):404-418.
[3] Evgeny N Imyanitov, Aglaya G Iyevleva, Evgeny V Levchenko. Molecular testing and targeted therapy for non-small cell lung cancer: Current status and perspectives[J]. Crit Rev Oncol Hematol, 2021, 157:103194.
[4]Mok T, Wu YL, Kudaba I, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEY-NOTE-042) : a randomised, open-label, controlled, phase 3 trial[J]. Lancet , 2019, 393 (10183) : 1819-1830.
[5]Wu Y, Zhang L, Fan Y, et al. KEYNOTE-042 China Study: first-line pembrolizumab vs chemotherapy in Chinese patients with advanced NSCLC with PD-L1 TPS >= 1%[J]. J Thorac Oncol, 2019, 14 (10) : S290-S291.
[6]Paz-Aresl, Lufl A, Vicente D, et al. Pembrolizumab plus chemotherapy for squamous non-small-cell lung cancer[J]. N Engl J Med, 2018, 379 (21) : 2040-2051.
[7] Schiller JH, Harrington D, Belani CP, et al. Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer[J]. N Engl J Med, 2002, 346 (2) : 92-98.
[8]Scahliotti GV, Parikh P, Vonpawel J, et al. Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer[J]. J Clin Oncol, 2008, 26 (21) : 3543-3551.
[9] Fossella FV, Devore R, Kerr RN, et al. Randomized phase III trial of docetaxel versus vinorelbine or ifosfamide in patients with advanced non-small-cell lung cancer previously treated
with platinum-containing chemotherapy regimens. The TAX 320 Non-Small Cell Lung Cancer Study Group[J]. J Clin Oncol, 2000, 18 (12) : 2354-2362.
[10] Han B, Li K, Wang Q, et al. Effect of anlotinib as a third-line or further treatment on overall survival of patients with advanced non-small cell lung cancer: The ALTER 0303 Phase 3 Randomized Clinical Trial[J]. JAMA oncol, 2018, 4 (11) : 1569-1575.
[11]刘艳华,张有为,李劲松,等.安罗替尼治疗无敏感突变型 晚期肺鳞癌一例[J].中华肿瘤杂志,2019,41(6):447-448.
[12]Tony SK Mok , Yi-Long Wu , Iveta Kudaba, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial[J]. Lancet, 2019 ,393(10183):1819-1830.
[13]Luis Paz-Ares, David Vicente, Ali Tafreshi, et al. A Randomized, Placebo-Controlled Trial of Pembrolizumab Plus Chemotherapy in Patients With Metastatic Squamous NSCLC: Protocol-Specified Final Analysis of KEYNOTE-407[J]. J Thorac Oncol, 2020, 15(10):1657-1669.
[14]Brodowicz T, Krzakowski M, Zwitter M, et al. Cisplatin and gemcitabine first-line chemotherapy followed by maintenance gemcitabine or best supportive care in advanced non
-small cell lung cancer: a phase III trial[J]. Lung Cancer, 2006, 52 (2) : 155-163.
[15]Rittmeyer A, Barlesi F, Waterkamp D, et al. Atezolizumab versus docetaxel in patients
with previously treated non-small-cell lung cancer (OAK) : a phase 3, open-label, multicentre randomised controlled trial[J]. Lancet, 2017, 389 (10066) : 255-265.
[16]Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1 positive, advanced non-small-cell lung cancer (KEYNOTE-010) : a randomised controlled trial[J]. Lancet, 2016, 387 (10027) : 1540-1550.
[17] Binyan Lin, Xiuming Song, Dawei Yang, et al. Anlotinib inhibits angiogenesis via suppressing the activation of VEGFR2, PDGFRβ and FGFR1[J]. Gene, 2018, 654:77-86.
[18]Chengying Xie, Xiaozhe Wan, Haitian Quan, et al. Preclinical characterization of anlotinib, a highly potent and selective vascular endothelial growth factor receptor-2 inhibitor[J]. Cancer Sci, 2018, 109(4):1207-1219.
[19]中國临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)原发性肺癌诊疗指南[M]. 北京:人民卫生出版社,2020:89.
[20]石凯远. 盐酸安罗替尼治疗晚期肺癌中国专家共识(2020版)[J]. 中华肿瘤杂志, 2020,42(10):807-816.
作者简介:谢王踢(1985-),男,湖南岳阳市人,硕士研究生,主要从事恶性肿瘤综合治疗研究。
*通讯作者:翁洁
