三种动物油脂对大鼠急性胃粘膜损伤的影响
2021-10-29夏蕴实孙印石李志满
夏蕴实,孙印石,刘 畅,李志满,姜 辉,王 梓
(1.吉林农业大学中药材学院,吉林长春 130118;2.中国农业科学院特产研究所,吉林长春 130112;3.长春大学食品学院,吉林长春 130022;4.吉林特研药业有限公司,吉林吉林 132109)
胃粘膜是胃的重要生理屏障,胃粘膜损伤是导致多种胃病的主要因素[1]。吸烟、饮酒、压力及营养缺乏,可能会危害到由刺激和防御因素维持的胃粘膜完整性的平衡,导致发生胃溃疡的风险增加[2]。现如今,对胃部疾病的治疗主要依赖于合成药物,这些药物的使用可能会引起不同程度的副作用,在这种情况下,从自然资源中寻找安全有效的功能性食品是极为必要的[3−4]。
近年来,对胃粘膜损伤的饮食预防控制已取得很大进展,一些食物来源的功能性成分受到了广泛关注。其中动物油脂中所富含的不饱和脂肪酸,如亚麻酸、亚油酸和油酸等对胃粘膜损伤均具有一定的保护作用[5],如蚕蛹油[6]能缓解盐酸/乙醇对胃组织造成的伤害。许常辉等[7]用鸸鹋油给胃溃疡大鼠连续灌胃,结果表明鸸鹋油能够抑制乙醇致小鼠胃粘膜损伤且明显促进酸性胃溃疡大鼠胃溃疡面愈合。鹿油是鹿科动物梅花鹿(Cervus nippon)或马鹿(Cervus elaphus)的脂肪油,也叫鹿脂。鹿油在古籍《唐本草》中记载:“主痈肿死肌,温中,四肢不随,风头,通腠理”[8]。《中国医学大辞典》记:“疗面疱疮,频频涂之”。民间多传鹿油对胃溃疡有一定的保护作用,但现如今关于鹿油的相关活性却鲜有报道。牛油被广泛应用于食品工业,不仅具有独特风味,还富含大量维生素、脂肪酸、矿物质等营养成分[9−10]。猪油是提取自猪脂肪组织经炼制而成的一种动物油脂,其风味独特且资源丰富易得,但食用猪油对人体的利弊至今仍褒贬不一[11]。本文通过分析三种动物油脂对大鼠急性胃粘膜损伤的影响,寻求对急性胃粘膜损伤具有保护作用且较易获得的动物油脂,为动物油脂的研究与开发提供理论依据。
1 材料与方法
1.1 材料与仪器
SD 大鼠 鼠龄7 周左右,体重170~180 g,购于辽宁长生生物技术股份有限公司,合格证号:SCXK(辽)2015-0001;鹿油 未经加工的新鲜板油,长春市世鹿鹿业有限公司;猪油、牛油 未经加工的新鲜板油,长春市农贸市场;超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒 南京建成生物工程研究所;大鼠肿瘤坏死因子α(TNF-α)试剂盒、大鼠白细胞介素6(IL-6)试剂盒 上海酶联生物科技有限公司;RNA 提取试剂盒 普洛麦格生物技术有限公司;反转录试剂盒 罗氏公司;无水乙醇 国药集团化学试剂有限公司;生理盐水 昆明南疆制药有限公司;戊巴比妥钠、10%中性福尔马林 北京酷来博科技有限公司。
GZX-9140MBE 电热恒温鼓风干燥箱 上海博迅实业有限公司医疗设备厂;HH-4A 数显恒温水浴锅 常州国华电器有限公司;商用电磁炉 诸城隆泽机械有限公司;LDZM-40KCS-2 立式压力蒸汽灭菌器 上海申安医疗器械厂;电子数显卡尺605 哈尔滨量具刃具集团有限责任公司;Epoch2 酶标仪美国博腾仪器有限公司;EC3 凝胶成像系统 美国UVP 公司;DYY-8C 电泳仪电源 北京六一仪器厂;C1000 Touch PCR 仪 美国伯乐公司。
1.2 实验方法
1.2.1 油脂的提取 参考文献方法[12],取新鲜的鹿、牛、猪板油,去除粘附的毛、皮等杂质残片,冲洗后沥干水分,切碎成小块,设置商用电磁炉温度为130 ℃,熬炼提油,过滤油渣,得到鹿油、牛油和猪油。
1.2.2 实验动物分组及模型建立 参考文献方法[13],选取健康的SD 雄性大鼠40 只,饲养在温度为22~25 ℃,相对湿度45%~65%环境中,自由饮水、进食,适应性喂养一周后,随机分为8 组,每组5 只,即正常组、模型组、低剂量鹿油组、高剂量鹿油组、低剂量牛油组、高剂量牛油组、低剂量猪油组和高剂量猪油组。灌胃剂量依据人体每日服用剂量12 g/60 kg换算,并根据预实验选择对大鼠甘油三酯、总胆固醇、高、低密度脂蛋白影响较小的剂量,则低剂量为500 mg/kg,高剂量为850 mg/kg。分别在给药前期(第1 d 给药前)、中期(第15 d 给药前)、末期(第30 d给药前)称重并记录。
正常组、模型组分别灌胃生理盐水;鹿油、牛油、猪油组每天按10 mL/(kg·bw)灌胃1 次,连续30 d。末次给药后,断粮不断水24 h。除正常组外,灌胃其余各组大鼠无水乙醇1.0 mL/只,1 h 后麻醉、心脏取血处死,取胃组织并称重[14−16]。
1.2.3 大鼠胃粘膜形态学观察 大鼠心脏取血处死后,取完整胃组织,结扎幽门,灌注10%福尔马林,固定20 min 后沿胃大弯剪开,用生理盐水冲洗表面胃内容物,展开胃粘膜,观察胃粘膜出血情况。
1.2.4 组织病理学检查 观察结束后,选取胃粘膜损伤最严重的部位,以10%中性福尔马林固定、水洗、脱水透明,浸蜡包埋,修整蜡块,以5 μm 厚度连续切片,脱蜡至水,经H&E 染色后,镜下观察大鼠胃组织病理学变化。
1.2.5 急性损伤指标测定 用游标卡尺记录出血带长度、宽度及出血点个数,按表1 评分标准计算各组大鼠胃粘膜充血面积、损伤积分指数、损伤发生率、损伤抑制率,评价三种油脂对急性胃粘膜损伤大鼠的保护作用[17−18]。

表1 乙醇对大鼠急性胃粘膜损伤肉眼观察评分标准Table 1 Criteria for visual observation of ethanol in acute gastric mucosal injury in rats
胃粘膜充血面积=出血带长度×出血带宽度;
个体损伤评分=出血点个数分值+出血带长度分值+出血带宽度分值×2;
损伤积分指数=某组损伤评分总和/该组动物数量;
损伤发生率(%)=某组出现出血、充血的大鼠数量/该组大鼠数量×100;
损伤抑制率(%)=(模型组损伤积分−实验组损伤积分)/模型组损伤积分 × 100
1.2.6 生化指标的测定 各组大鼠取血后,室温静止30 min,在4 ℃条件下,以2500 r/min的转速离心20 min,分离得到血清,按照试剂盒说明方法测定大鼠血清中的SOD 活性、MDA 含量、GSH-Px 活力、IL-6 含量和TNF-α含量。
1.2.7 胃组织中EPO 和EPOR mRNA 表达水平采用Eastep Super 总RNA 提取试剂盒提取胃组织中的总RNA,使用Quick Drop 检测RNA 浓度后,用1%琼脂糖凝胶电泳鉴定完整性。再按照BioRT cDNA 合成试剂盒方法将分离的RNA 逆转录成cDNA,并通过使用表2 中所述的基因特异性引物进行RT-PCR,GAPDHmRNA的表达水平作为内置参数。最后,利用含有溴化乙锭的琼脂糖凝胶电泳观察PCR 扩增产物,并以计算机图像分析系统成像进行半定量分析。
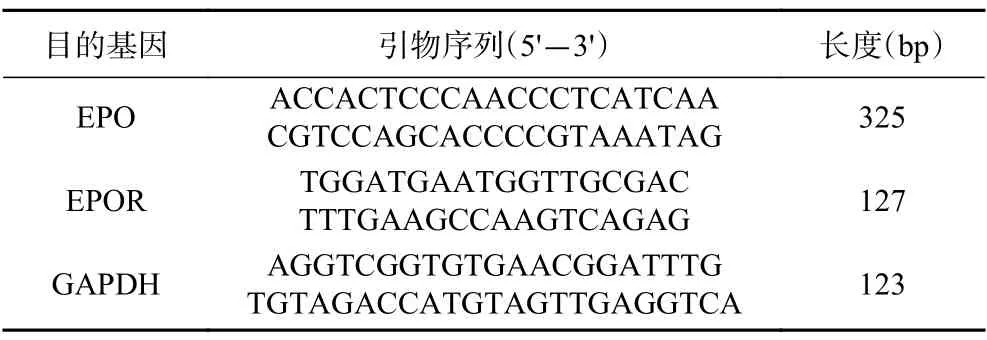
表2 实时定量PCR 反应引物序列Table 2 Sequences of primers for RT-PCR amplification
1.3 数据处理
2 结果与分析
2.1 三种动物油脂对大鼠体重、胃重量/体质量的影响
实验期间各组大鼠在各个时期体重均持续增长,与正常组相比无显著性差异(P>0.05)。第30 d经无水乙醇刺激胃粘膜后,模型组大鼠胃重量/体质量较正常组明显升高,差异有统计学意义(P<0.001)。说明经无水乙醇刺激后的大鼠胃组织出现出血、水肿,造模成功。鹿油组胃组织重量较模型组明显降低,水肿各有一定程度减轻,差异有统计学意义(P<0.01 或P<0.001),结果见表3。
表3 三种动物油脂对大鼠体重和胃重量/体质量的影响( )Table 3 Effects of three kinds of animal fats on rat body weight and stomach weight/body weight()

表3 三种动物油脂对大鼠体重和胃重量/体质量的影响( )Table 3 Effects of three kinds of animal fats on rat body weight and stomach weight/body weight()
注:与模型组相比,#表示显著(P<0.05),##表示高度显著(P<0.01),###表示极显著(P<0.001);与对照组相比,*表示显著(P<0.05),**表示高度显著(P<0.01),***表示极显著(P<0.001);表4、图3、图4同。
2.2 三种动物油脂对大鼠急性胃粘膜损伤的形态学观察
如图1 所示,正常组大鼠胃粘膜完整光滑,无出血带及出血点;模型组大鼠胃粘膜表面严重充血糜烂,有明显粗大的出血带,且颜色较深;鹿油组大鼠胃粘膜局部轻微出血,表面有较细小出血带和出血点;牛油组大鼠胃粘膜表面有多条细长出血带,颜色略深;猪油组大鼠胃粘膜表面有多条较宽出血带,颜色较深。此外,三种油脂处理组对胃黏膜形态的保护呈现出典型的量效关系,即同模型组比较,随着剂量升高,无水乙醇对大鼠胃黏膜损伤程度减弱。鹿油和牛油能一定程度上减轻乙醇所致急性胃粘膜损伤,且高剂量组效果优于低剂量组,猪油则无明显效果。

图1 三种动物油脂对乙醇致大鼠胃黏膜损伤形态影响Fig.1 Effects of three animal fats on the morphology of gastric mucosa injury induced by ethanol in rats
2.3 三种动物油脂对大鼠急性胃粘膜损伤的组织病理学影响
选取各组大鼠胃粘膜损伤最严重部位进行H&E 染色,结果如图2 所示。正常组大鼠胃黏膜细胞排列紧密、有序,细胞的蓝紫色较深,胃黏膜整体形态完整、边界清晰、明显;模型组胃黏膜细胞排列则松散、无序,且碎片较多,空腔细胞聚集成片,具有炎性浸润,胃黏膜肿胀;鹿油组和牛油组细胞排列较为有序,炎性浸润减少。此外,三种油脂处理组对胃黏膜形态的保护呈现剂量依赖性。

图2 不同组别大鼠胃黏膜H&E 染色(40×)Fig.2 H&E staining pictures of gastric mucosa of rats in different groups(40×)
2.4 三种动物油脂对大鼠急性损伤指标的影响
统计各组胃粘膜充血面积、损伤积分指数、损伤发生率及损伤抑制率,结果见表4。结果表明,模型组大鼠胃黏膜充血面积、损伤积分指数均高于其它各组,出血情况最为严重,造模成功;与模型组相比,鹿油组胃粘膜充血面积、损伤积分指数均明显降低,能够较大程度地缓解大鼠胃粘膜出血情况,具有极显著差异(P<0.001);与模型组相比,牛油组胃粘膜充血面积和损伤积分指数均有降低,有显著性差异(P<0.05 或P<0.01);猪油组损伤积分指数稍有降低,但较模型组相比,无显著性差异(P>0.05);鹿油组、牛油组、猪油组的高剂量组胃粘膜充血面积、损伤积分指数均低于低剂量组,损伤抑制率高于低剂量组。上述结果表明,鹿油、牛油对急性胃粘膜均具有不同程度的保护作用,且呈明显剂量依赖性,其中鹿油的保护效果更佳,猪油无明显保护作用。
表4 三种动物油脂对大鼠急性胃粘膜损伤指标的影响( )Table 4 Effects of three kinds of animal oils on the indexes of acute gastric mucosa injury in rats()

表4 三种动物油脂对大鼠急性胃粘膜损伤指标的影响( )Table 4 Effects of three kinds of animal oils on the indexes of acute gastric mucosa injury in rats()
2.5 三种动物油脂对大鼠血清抗氧化能力的影响
无水乙醇摄入会使细胞抗氧化能力降低,导致氧化应激的发生,进而使机体产生炎症反应[19]。GSH-Px、SOD 是重要的内源性抗氧化酶,能够反映机体清除自由基的能力。MDA 是脂质过氧化的产物,可反映体内脂质过氧化反应程度[20−21]。如图3 所示,与正常组相比,过量无水乙醇可降低血清GSH-Px 及SOD 活性,提高MDA 水平。鹿油预处理有效地提高了血清GSH-Px 和SOD 活性,降低了MDA 水平,且呈剂量依赖性;牛油仅能够提高SOD活性,降低MDA 水平,呈剂量依赖性;猪油组对以上指标影响不显著(P>0.05)。这些结果证实了鹿油和牛油可以减轻过量乙醇引起的氧化应激,提高机体抗氧化能力,且鹿油组效果优于牛油组。

图3 三种动物油脂对大鼠血清中GSH-Px、SOD活性和MDA 含量的影响Fig.3 Effects of three kinds of animal oils on GSH-Px,SOD activity and MDA content in rat serum
2.6 三种油脂对大鼠血清中炎症因子分泌的影响
TNF-α和IL-6 是两种重要的促炎细胞因子,与急性胃粘膜损伤的发生密切相关[3]。如图4 所示,乙醇刺激后的模型组大鼠血清中TNF-α和IL-6 水平较正常大鼠明显升高(P<0.001)。与模型组大鼠相比,鹿油组大鼠血清炎症细胞因子显著下降(P<0.05),且呈剂量依赖性,牛油组、猪油组无明显影响。结果表明,鹿油预处理显著限制了促炎细胞因子的产生,有效抑制了炎症因子的分泌。

图4 三种动物油脂对大鼠血清中TNF-α和 IL-6 含量的影响Fig.4 Effects of three animal fats on serum levels of TNF-α and IL-6 in rats
2.7 鹿油对大鼠胃组织中EPO 和EPOR mRNA 表达的影响
EPO(促红细胞生成素)是由炎症诱导的内源性细胞保护和炎症调控的分子,一定程度上能够抑制促炎症因子的表达。EPOR(促红细胞生成素受体)是靶细胞膜表面上的促红细胞生成素受体,有研究发现EPOR 在炎症细胞表面表达[22−23]。对低、高剂量鹿油组进行RT-PCR 检测胃组织中EPO 和EPOR mRNA的变化情况,如图5 所示,与正常组大鼠相比,模型组大鼠胃组织中EPO 和EPOR mRNA的表达均明显增强;与模型组相比,高、低剂量鹿油组中EPO 和EPOR mRNA 表达水平明显降低。说明模型组乙醇摄入后,促炎因子大量分泌,导致EPO 和EPOR 水平升高;鹿油预处理组分泌较少炎症因子,则EPO 和EPOR 水平较模型组降低。

图5 鹿油对大鼠胃组织中EPO和EPOR mRNA 表达的影响Fig.5 Effects of deer oil on the expression of EPO and EPOR mRNA of stomach tissure in rats
3 结论
以乙醇致急性胃粘膜损伤模型[24−27]研究三种常见动物油脂对乙醇所致急性胃粘膜损伤的影响。三种油脂中,鹿油能够通过提高GSH-Px 活力和SOD 活性、降低体内MDA 含量提高机体抗氧化能力,并减少IL-6 和TNF-α的分泌,提高机体抗炎能力,EPO 及EPOR 表达较少,说明鹿油抑制了炎症因子的表达,进而保护乙醇所致急性胃粘膜损伤;牛油对急性胃粘膜损伤也具有一定的保护作用,可通过升高SOD 活性、降低MDA 含量提升机体抗氧化能力对胃粘膜损伤形成一定的保护作用,低剂量牛油组无明显变化;猪油对急性胃粘膜损伤的影响无显著性差异(P>0.05),仅是一种简单的物理性保护。故三种动物油脂对急性胃粘膜损伤保护作用依次是:鹿油>牛油>猪油,呈剂量依赖性。
综上所述,鹿油对乙醇致胃粘膜损伤具有良好的改善作用,且鹿作为个体较大的哺乳动物,分布较为广泛,油脂较容易获取且提取率高,但其作用机理还需进一步明确。本研究为动物油脂在食品、保健品、日用品等各个领域的开发利用提供理论依据,具有重要的理论意义和社会经济价值。
