液相法测定米香型白酒发酵液中18 种有机酸
2021-10-29郝俊光梁振荣戴梓茹施绍颖李官连
郝俊光,柯 锋,梁振荣,张 龙,戴梓茹, ,施绍颖,罗 丹,李官连
(1.钦州市食品风味分析与调控重点实验室,北部湾大学食品工程学院,广西钦州 535011;2.广西天龙泉酒业有限公司,广西河池 546400)
白酒有机酸按物理性质可以分成三类:C1~C6的挥发性脂肪酸、C7~C22的不挥发脂肪酸和热不稳定酸(如琥珀酸、草酸、柠檬酸等多元酸)[1]。有机酸的组成和含量不仅影响白酒发酵过程微生物的生长与繁殖[2−4],也影响酯类香气物质的合成[4−5]。作为成品酒的重要呈味物质,有机酸还能起到呈香、助香、减少刺激和缓冲平衡的作用,其含量高低及相互比例直接影响着白酒的风味、质量[4−5]以及饮后舒适度[6−7]。
米香型白酒是中国四大基本白酒香型之一,以大米为原料、小曲为糖化发酵剂,经米饭固态培菌糖化、加水半液态发酵以及蒸馏而成[8]。随着产业设备技术的发展以及白酒消费习惯的改变,以效率提升、风味优化为目的的米香型白酒的现代化和低度化生产成为历史的必然[9−11]。目前,米香型白酒在市场上呈现风味多样化,不同工厂的风味物质分布差异非常大[12]。关于米香型白酒有机酸的产生与分布的报道较少[13−14],有待进一步细化研究。有机酸的定量一直是白酒风味物质研究的重点和热点之一。目前,可以检测白酒有机酸的方法有气相法[15]、气质法[16−17]、离子色谱法[18−20]、液质法[21]、液相法[22−24]等。气相直接检测技术适用于挥发性高的脂肪酸检测[15],但不适合热不稳定酸(如乳酸)的检测。气相(质)衍生技术可以实现乳酸等热不稳定酸的检测,但操作繁琐[16−17]。阴离子交换色谱法可实现白酒短、中链挥发酸和包括乳酸在内的难挥发酸的同时检测,但仪器专用、购置成本高[18−20]。高分辨液相质谱可实现白酒中多种微量有机酸的检测,但仪器和检测成本昂贵[21]。液相色谱法成本相对较低,在白酒有机酸的检测中应用较多,已实现了对乙酸、乳酸及其它热不稳定酸的检测[22−24],但尚未见其对白酒短链脂肪酸检测的报道[25−26]。
鉴于短链脂肪酸的重要性[6−7],以及液相色谱因价格比离子交换色谱、气相质谱、液相质谱便宜而在工厂中更为普及的事实,本研究将利用液相色谱开发一种能实现短链脂肪酸和热不稳定脂肪酸同时检测的技术,并对米香型白酒的发酵过程进行跟踪,以期为米香型白酒生产提供有机酸品控的实用性手段,明确其发酵过程中不同有机酸的变化规律。
1 材料与方法
1.1 材料与仪器
米香型白酒发酵醪、小曲(糖化力34 g/100 g,发酵力37%vol) 广西天龙泉酒业有限公司;晚稻大米广西河池市售;葡萄糖酸溶液(纯度51%)、甲醇、磷酸、乙酸、KH2PO4、草酸、L-苹果酸、柠檬酸、富马酸、丙酸、正丁酸、异丁酸、正戊酸、L-酒石酸、奎尼酸、甲酸、丙酮酸、琥珀酸、异戊酸、抗坏血酸、L-乳酸 色谱纯,上海麦克林生化科技有限公司。
Alliance 高效液相色谱仪(配备2695HPLC 分离单元、2996PDA 检测器、Empower 工作站) 美国Waters 仪器公司;DK-98-II 电热恒温水浴锅 天津市泰斯特仪器有限公司;INNOVA 43R 落地式低温摇床 上海巴玖实业有限公司;H1850 高速离心机 湖南湘仪实验室仪器开发有限公司;ME204E 电子天平 梅特勒-托利多仪器(上海)有限公司;Cascada I 实验室超纯水系统 美国Pall 公司;0.22 μm SLGP 033RB针头滤膜 美国Millipore 公司;PHS-3E 雷磁pH 计 上海仪电科学仪器股份有限公司;白酒生产中试线(配备100 kg 蒸饭锅一套、300 L 控温发酵罐5 个) 广西天龙泉酒业有限公司。
1.2 实验方法
1.2.1 定性标准溶液的配制 称取适量化合物,配制成草酸100 mg/L、L-酒石酸800 mg/L、葡萄糖酸5000 mg/L、奎尼酸150 mg/L、甲酸200 mg/L、丙酮酸40 mg/L、L-苹果酸400 mg/L、抗坏血酸60 mg/L、L-乳酸400 mg/L、乙酸5000 mg/L、柠檬酸200 mg/L、富马酸6 mg/L、琥珀酸400 mg/L、丙酸400 mg/L、异丁酸400 mg/L、正丁酸400 mg/L、戊酸400 mg/L、异戊酸400 mg/L的单标,用于不同有机酸保留时间和峰形的确定。上述单标溶液等体积混合后用于色谱条件的优化,不同色谱条件下色谱峰的辨识基于峰形、强度和出峰顺序。
1.2.2 色谱的基本操作条件 色谱柱:Waters Atlantis®T3 色谱柱(4.6 mm×250 mm,5 μm);流动相A:甲醇溶液;流动相B:KH2PO4缓冲液(0.02 mol/L,pH2.6);洗脱方式:线性梯度;流速变化方式:恒速;柱温:30 ℃;进样量:10 μL;检测波长:210 nm。
1.2.3 色谱条件的优化和有机酸的定性 在检测波长、流动相pH 固定的前提下,分别进行了线性洗脱梯度一(见表1),流速分别是0.43、0.40、0.37 mL/min的比对实验A、B、C,确定出适合的流速。进而在最佳流速条件下,进行梯度二、三(见表1)的比较实验E、F,以确定分离度高且检测周期短的优化洗脱梯度。在优化的色谱条件下,测定每个有机酸的保留时间,完成有机酸的定性。

表1 优化过程所采用的三种洗脱梯度Table 1 The comparison of the three eluent gradients adopted in the optimization process
分离度的计算公式为[27]:Rs=2(tR2−tR1)/(Y1+Y2)
式中,Rs是两个相邻组分的分离度;tR1、tR2和Y1、Y2分别为两组分的保留时间和峰宽。
1.2.4 混合标准储备液的配制 称取各种标准品适量,用KH2PO4缓冲液溶解并定容至100 mL 容量瓶,得到浓度为草酸500 mg/L、L-酒石酸4000 mg/L、葡萄糖酸25000 mg/L、奎尼酸750 mg/L、甲酸100 mg/L、丙酮酸200 mg/L、L-苹果酸2000 mg/L、抗坏血酸300 mg/L、L-乳酸2000 mg/L、乙酸20000 mg/L、柠檬酸1000 mg/L、富马酸30 mg/L、琥珀酸2000 mg/L、丙酸2000 mg/L、异丁酸2000 mg/L、正丁酸2000 mg/L、戊酸2000 mg/L、异戊酸2000 mg/L的混合标准储备液,4 ℃保存。
1.2.5 标准曲线的建立与样品定量 分别吸取2.5、5、10、20、40 mL 混合标准储备液于100 mL 容量瓶中,用KH2PO4缓冲液定容,得到5 个混合标样的浓度梯度。在优化的条件下对浓度梯度1~5 由低到高进行检测,将峰面积(y)和浓度(x)进行强制过原点的线性拟合,建立标准曲线。将液相测出样品的不同有机酸的峰面积带入各自的标准曲线,即可实现样品中有机酸定量。
1.2.6 定量方法的方法学评估 把最低浓度标准溶液逐步稀释检测,取信噪比等于S/N 3 和10 时对应分析物的浓度作为检出限和定量限。向米香型白酒9 d 发酵液的5 倍稀释液中加入等体积的梯度4 混合标准溶液,平行测定6 次,计算出相应组分的加标回收率和相对标准偏差。
1.2.7 米香型白酒的发酵和取样 米香型白酒的发酵工艺路线为:大米→淘洗→蒸饭→冷却→加曲糖化→加水入罐→发酵。操作要点为:
a、蒸饭
将100 kg 大米置于不锈钢桶中浸泡2 h,倒入蒸饭机中预煮45 min,然后开盖边搅拌边加入适量的水,进行第2 次蒸煮33 min,再次开盖搅拌加水(米饭水分控制在64%~66%),进行第3 次蒸煮25 min,出锅摊晾,降温至33 ℃,下曲1 kg,转入糖化槽进行糖化。
b、糖化
室温糖化24 h,期间每8 h 翻拌一次,加入重量比120%的水混合均匀,用泵抽入发酵罐中进行发酵。
c、发酵
发酵12 d,前6 d 发酵温度控制在27~29 ℃,此为主发酵期,后6 d 控制在21~22 ℃,此为后发酵期。
d、取样与检测
共进行3 次发酵实验,分别取每批实验的第0、3、6、9、12 d的醪液进行有机酸、总酸的检测;分别取每批实验的第0、1、2、3、6、9、12 d的样品进行有酒精度、pH的检测。
1.2.8 有机酸的检测 将所取样品以8000 r/min 离心15 min,然后经0.22 μm 针头微孔滤膜过滤至样品瓶。在优化的色谱条件下检测,进样量:10 μL,外标法定量,每个样品检测三次。
1.2.9 酒精度、总酸、pH的检测 参照GB/T 10345-2007《白酒分析方法》的密度瓶法测定酒精度、电位滴定法测定总酸、pH 计法测定pH,结果分别以酒精的体积占比(% V/V)、以乙酸计的浓度(g/L)、pH 值表示,每个样品检测三次。
1.3 数据处理
使用Microsoft Excel 2016 软件对数据进行处理,数据以三次实验的九个检测数据的平均值±标准偏差形式表示。
2 结果与分析
2.1 色谱条件的优化
本研究是在利用Waters Atlantis®T3 色谱柱测定毛葡萄发酵液中有机酸的基础上增加6 种短链脂肪酸的检测方法开发,其检测波长210 nm、柱温箱温度30 ℃、流动相为“甲醇和KH2PO4缓冲液(0.02 mol/L,pH2.6)”、进样量10 μL[28],被直接沿用。由于短链脂肪酸的出峰较晚,需采用梯度洗脱缩短检测周期。
首先采用梯度一(见表1)、流速0.43 mL/min 进行标样分离(结果见图1),发现除奎尼酸(峰4)与甲酸(峰5),异丁酸(峰15)与正丁酸(峰16)分离度略差外,其它有机酸均能有效分离。降低流速可以提高分离度,为此进行了0.40、0.37 mL/min 分离效果的比对实验,结果见图2。为提高图片的可视性,图2只显示了6~34 min 时间段的图谱。经比对计算,流速0.43、0.40、0.37 mL/min 对应的奎尼酸与甲酸分离度分别达到1.26、1.51、1.61。鉴于流速0.40 mL/min条件下二者达到了完全分离(分离度≥1.50)[27],且较0.37 mL/min的检测周期短,故确定0.40 mL/min为优化的洗脱流速。

图1 18 种有机酸标样在流速0.43 mL/min的HPLC 色谱图Fig.1 Chromatograms of 18 organic acid standards at eluent velocity of 0.43 mL/min

图2 18 种有机酸标样在不同流速下的HPLC 色谱图Fig.2 Chromatograms of 18 organic acid standards at three eluent velocities
在梯度一、流速0.40 mL/min的洗脱条件下,异丁酸与正丁酸的分离度已达到1.39,能较好地实现定性、定量。考虑到最后出峰的异戊酸在此条件下保留时间已达到63 min,且流动相重新回到下一个测定起始状态需要较长的平衡时间,不再进行降低洗脱强度提高分离度的实验,而是进行为缩短检测周期而降低洗脱强度的梯度二、梯度三比对试验。洗脱液中有机相甲醇比例增加时,会减弱有机酸疏水端与固定相的作用,缩短保留时间[26],但流动相甲醇比例过高、梯度改变速率过快时会导致磷酸盐析出而造成色谱柱堵塞[26],因而梯度洗脱终点设为42%且梯度变化较缓慢。三种梯度条件下,四种酸的分离情况见图3。梯度一、二、三所对应的异丁酸与正丁酸的分离度分别为1.39、1.13、1.28,异戊酸的保留时间分别为63.02、61.73、62.69 min,可以看出梯度改变对检测周期缩短作用不大,却会明显降低分离效果,因而仍选取梯度一作为优化的洗脱梯度。
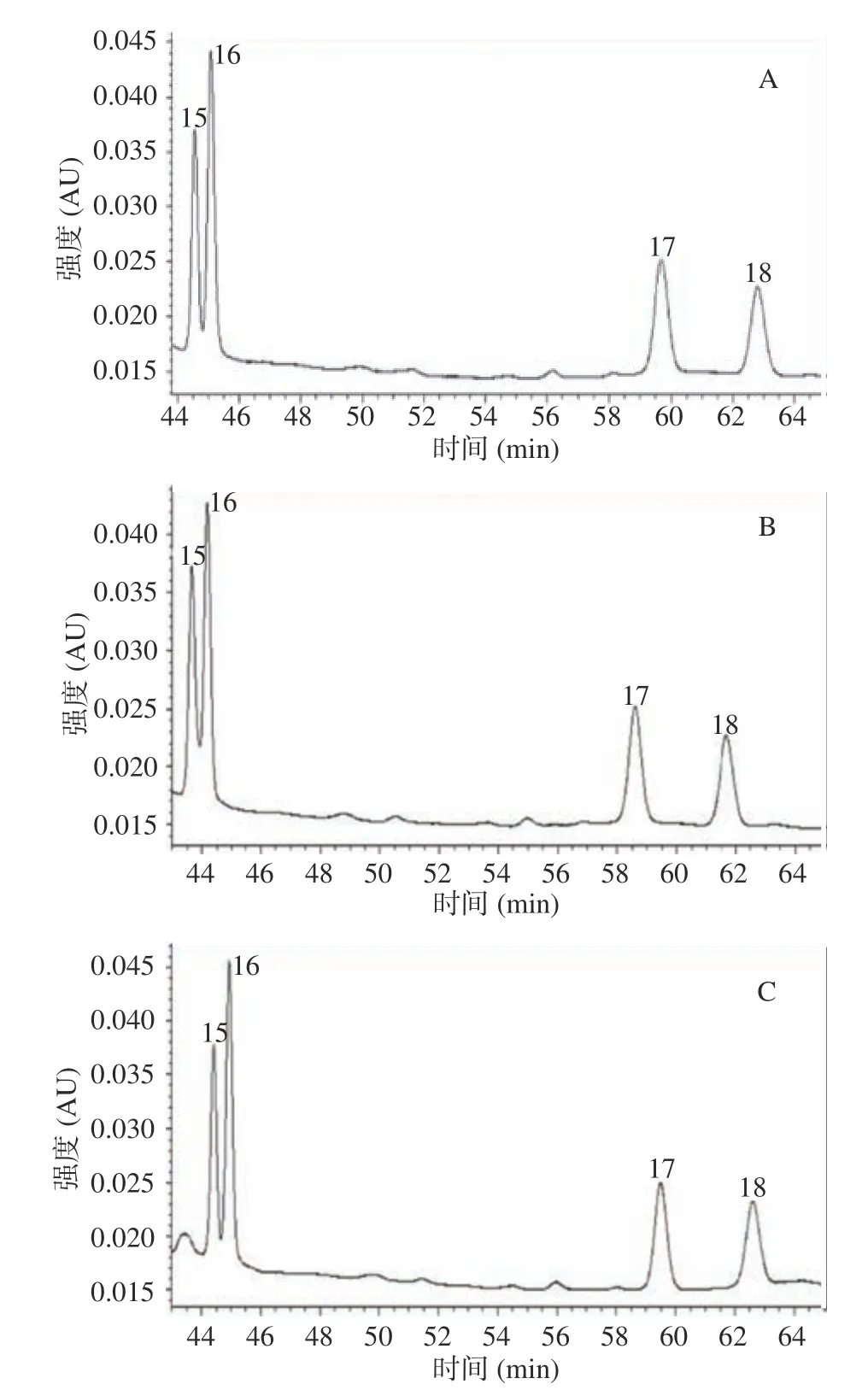
图3 18 种有机酸标样在三个洗脱梯度下的HPLC 色谱图Fig.3 Chromatograms of 18 organic acid standards at three eluent gradients
2.2 有机酸的定性
在优化的条件下确定每个有机酸的保留时间,实现了18 种有机酸的定性(见图4)。除异丁酸与正丁酸的分离度为1.39 未达到完全分离外,其它相邻有机酸的分离均实现完全分离[27]。

图4 优化条件下18 种混合标准品的HPLC 谱图Fig.4 Chromatograms of 18 organic acid standards under optimum condition
2.3 标准曲线建立及方法的评价
在优化的条件下对5 个混合标准梯度进行检测,将峰面积(y)和浓度(x)进行强制过原点的线性拟合,建立标准曲线,进行方法评价。标准曲线及其线性范围与R2、检出限、定量限、加标回收率、标准偏差的结果见表2。结果显示,该方法的线性范围较宽,标准曲线R2为0.9891~0.9999;检出限0.084~0.941 mg/L,定量限0.280~3.138 mg/L,加标回收率93.03%~107.21%,相对标准偏差<3.70%,说明该方法线性良好,精密度和准确度高,可用于米香型白酒发酵液、米酒的检测。

表2 有机酸组分的保留时间、线性范围、标准曲线、相关系数、检出限、定量限、加标回收率、标准偏差Table 2 Retention time,linear range,regression equation,correlation coefficient,limit of detection,limit of quantitation,recovery,RSD of organic acids by HPLC
2.4 米香型白酒发酵过程有机酸、pH、酒精度、总酸的变化
2.4.1 米香型白酒发酵过程有机酸的变化 米香型白酒发酵液中有机酸变化见图5。主要有机酸的变化趋势不一样:柠檬酸和富马酸呈现主酵明显下降,而后酵趋于平稳的趋势;L-苹果酸、丙酮酸、奎尼酸呈现先升后降的趋势,但峰值出现时间各不相同,前期上升可能与主酵期间酵母代谢活跃有关[3],而L-苹果酸的后期下降或与苹乳发酵有关[29];葡萄糖酸、琥珀酸、L-乳酸、异戊酸在发酵过程中一直呈上升趋势,可能与酿酒酵母在主酵、耐酒精的产酸菌在后酵都容易产生此类酸有关[3,10,17];乙酸、草酸和正丁酸在发酵前期变化不大、后期增加明显,可能与酿酒酵母不易产生此类酸而耐酒精的产酸菌在后酵容易产生此类酸有关[3,17,30];正戊酸在前9 d的发酵液中均未检出,只在第12 d 发酵液中有检出。不同发酵时间醪液的有机酸图谱不相同,说明与发酵温度、曲种、料水比一样,发酵时间也是影响米香型白酒有机酸组成的一个关键工艺参数。

图5 发酵过程18 种有机酸的变化情况Fig.5 The changes of 18 organic acids during fermentation
12 d 发酵是米香型白酒的常用工艺,故对12 d醪液的有机酸组成进行详细的分析。12 d 发酵液的总有机酸含量为24505 mg/L,各有机酸浓度按由大到小的顺序依次是:L-乳酸>乙酸>异丁酸>异戊酸>琥珀酸>葡萄糖酸>正丁酸>奎尼酸>丙酸>柠檬酸>甲酸>正戊酸>L-酒石酸>草酸>L-苹果酸>丙酮酸>富马酸>抗坏血酸。其中,占总有机酸比例达10%以上的有5 种,分别是L-乳酸(占19.76%)、乙酸(占15.64%)、异丁酸(占15.47%)、异戊酸(占14.28%)、琥珀酸(占13.30%)。与初始醪液相比,12 d 醪液中只有柠檬酸、L-苹果酸、富马酸的含量出现降低,降幅分别达到54.51%、64.34%、46.93%;其它有机酸均增加,增幅达100%以上的有机酸按由大到小的顺序依次是葡萄糖酸(73.10 倍)、乙酸(38.64 倍)、奎尼酸(17.87 倍)、正丁酸(4.89 倍)、琥珀酸(3.88 倍)、甲酸(3.28 倍)、异丁酸(2.67 倍)、L-乳酸(1.85 倍)、丙酮酸(1.57 倍)、丙酸(1.56 倍)、异戊酸(1.22 倍)。
2.4.2 米香型白酒发酵过程中总酸、pH、酒精度、总有机酸的变化 发酵过程中醪液的pH、酒精度见图6。酒精度在主酵期间增加明显,前3 d 就达到最终酒精度的91.8%。pH 在整个发酵过程中呈下降趋势,表明发酵过程游离氢离子在一直增加,且后酵也有较多的游离酸性物质产生;12 d 醪液的pH 较初始醪液降低了10.58%。

图6 发酵过程pH、酒精度的变化Fig.6 Change of pH,alcohol by volume during fermentation
总酸、总有机酸的变化见图7。总酸和总有机酸在发酵过程中一直呈上升趋势,12 d 醪液的总酸和总有机酸较初始醪液分别增加了2.42 倍和1.95 倍。后酵发酵液中酒精度高而对应的总酸和总有机酸呈增加趋势,可能与发酵液中有源自酿酒小曲的耐酒精的乙酸菌、乳酸菌等存在有关[29−30]。

图7 发酵过程总酸、总有机酸的变化Fig.7 Change of total acidity and total organic acid during fermentation
3 结论
利用反相高效液相-紫外二极管阵列法建立了米香型白酒中包括短链脂肪酸在内的18 种有机酸的定量分析方法。该方法线性好(R2>0.989)、定量限低(0.280~3.138 mg/L)、加标回收率高(93.03%~107.21%)、精密度好(<3.70%)。方法可同时准确定量测定挥发性短链脂肪酸和热不稳定多元羧酸的检测方法,为米香型白酒的品质控制提供了一个有效手段,也为果酒果醋发酵液等有机酸的检测提供了一个潜在的方法。米香型白酒发酵过程中,pH、总酸、总有机酸的变化趋势相对应,且12 d 醪液总有机酸占总酸的70%,说明本方法所监测到的有机酸覆盖了发酵液酸性物质的绝大部分。不同有机酸随时间的变化规律不同。12 d 醪液总酸和总有机酸较初始醪液分别提高了2.42 倍和1.95 倍,说明米香型白酒的发酵过程是一个明显的增酸过程。L-乳酸、乙酸、异丁酸、异戊酸、琥珀酸在12 d 发酵醪中含量占比大于10%,为米香型白酒发酵液中含量高的5 种主要有机酸。乙酸、L-乳酸、异丁酸、异戊酸在发酵后期增加明显,可能与后酵有能耐受高酒精度的产酸菌存在有关。不同发酵进程对应的有机酸分布差异较大,暗示着在其它参数一定的情况下选择合适的发酵终止时间是控制米香型白酒有机酸组成的一个有效工艺手段。
