超声辅助提取毛酸浆籽蛋白质的工艺优化
2021-10-29苗欣月朱立斌牛广财魏文毅宁志雪
苗欣月,朱立斌,朱 丹,牛广财, ,魏文毅,宁志雪
(1.黑龙江八一农垦大学食品学院,黑龙江大庆 163319;2.黑龙江省农产品加工工程技术研究中心,黑龙江大庆 163319;3.黑龙江八一农垦大学生命科学技术学院,黑龙江大庆 163319)
毛酸浆(Physalis pubescensL.)是茄科酸浆属的一年生草本植物,又名黄菇娘,其成熟果实呈金黄色,可食药兼用[1]。毛酸浆已被用于清热解毒、治疗咳嗽和泌尿生殖系统疾病等,还具有预防肿瘤、抗氧化、抗癌、降血脂和降血糖等功能[2−8]。毛酸浆籽作为毛酸浆在加工生产过程中产生的副产物,由于得不到有效利用而被丢弃或被作为下脚料处理[9]。目前,已有大量关于毛酸浆果实方面的研究报道[10−13],但有关毛酸浆果籽方面的研究较少,关于毛酸浆籽中蛋白质的提取及其性质的研究更是鲜见报道。郝晓磊等[14]、陆占国等[9]分别采用索氏微波提取法和超临界CO2流体萃取法提取了毛酸浆籽油,并分析鉴定出毛酸浆籽油的脂肪酸组成为:亚油酸、油酸、棕榈酸、十六(烷)酸、十八(烷)酸、亚油酸乙酯和硬脂酸等,其不饱和脂肪酸含量占81.0%~85.12%。张舵等[15]采用碱提酸沉法确定了红菇娘籽中蛋白质的最佳提取工艺条件,即在料液比为1:7,pH8.0,水浴温度45 ℃,酸沉最佳pH 为4.0 时,红菇娘籽蛋白质的提取率为52.68%。
目前,提取植物蛋白的主要方法有酶解法、碱溶酸沉法、超声辅助法等。酶解法提取条件温和,但是提取温度不宜过高,否则蛋白质不易从植物细胞壁中溶出,导致提取效果不佳[16]。碱溶酸沉法提取率较低,提取时间长,也会改变活性物质的结构和性质[17]。而超声辅助提取技术具有的空穴效应可产生较强的机械剪切力,有利于蛋白质从固体物料中溶出,具有提取效率高、提取时间短等优点[18]。唐诗琦等[19]采用超声辅助碱法确定了辣木籽蛋白质的最优提取工艺条件为:pH8.0,提取时间45 min,提取温度44 ℃,超声功率150 W,此条件下辣木籽蛋白的提取率为44.03%。马梦婷等[20]确定了超声辅助碱提棉籽蛋白的最优工艺条件为pH 11.0,液料比20:1 mL/g,超声时间20 min,超声温度45 ℃,超声功率600 W,在此条件下棉籽蛋白提取率为87.64%。
本试验拟采用超声辅助法提取毛酸浆籽中的蛋白质,并通过正交试验对毛酸浆籽中蛋白质的提取工艺进行优化,分析超声辅助提取的毛酸浆籽蛋白质的溶解性、乳化性和起泡性,以期为毛酸浆籽蛋白质的开发利用提供帮助。
1 材料与方法
1.1 材料与仪器
毛酸浆籽 大庆地产毛酸浆,品种为铁把小菇娘(physalis pubescensTieba),毛酸浆打浆后经纱布过滤、水洗,干燥后得到毛酸浆籽,毛酸浆粗蛋白含量为5.37%,粗脂肪含量为2.89%;牛血清蛋白 北京索莱宝科技有限公司;考马斯亮蓝G-250 蛋白试剂 上海迈坤化工有限公司;乙醇 分析纯,辽宁泉瑞试剂有限公司;硫酸钾、硫酸铜、硫酸等 均为分析纯,天津市富宇精细化工有限公司;十二烷基硫酸钠 美国Sigma 公司。
DK-600B 电热恒温水槽 上海森信实验仪器有限公司;LE203E/02 电子天平 梅特勒-托利多仪器(上海)有限公司;QDN-11 全自动凯氏定氮仪 杭州汇尔仪器设备有限公司;Beta2-8LD plus 冷冻干燥机德国Christ 公司;KH-500DE 型超声波清洗器昆山禾创超声仪器有限公司。
1.2 实验方法
1.2.1 毛酸浆籽蛋白质提取工艺 参考李逸鹤等[21]的方法并稍加修改。将毛酸浆籽粉碎后置于真空干燥箱,45 ℃条件下干燥24 h,过40 目筛。取适量经预处理后的毛酸浆籽粉,用石油醚(料液比1:5 g/mL)浸泡1 h,重复操作两次,干燥后置于4 ℃冰箱贮存。实验时,将2.0 g 毛酸浆籽粉按1:15 g/mL的料液比分散到蒸馏水中,加碱调节至一定的pH。一定温度下水浴30 min,在设定的超声功率、提取时间、提取温度下进行毛酸浆籽粉中蛋白质的提取。超声辅助提取结束后,在转速为4500 r/min 条件下离心20 min 取上清液。滴加HCl 溶液(1 mol/L)使上清液pH 至4.0,离心取沉淀蛋白质,加入蒸馏水将pH 调至7.0,最后冷冻干燥得到毛酸浆籽蛋白质粉。
1.2.2 单因素实验
1.2.2.1 超声功率的选择 将加入蒸馏水的毛酸浆籽溶液用NaOH 调pH 至9.0,充分搅拌混匀后水浴30 min,分别选择超声功率100、200、300、400、500 W 于温度20 ℃条件下超声提取20 min,计算毛酸浆籽蛋白质的提取率,确定毛酸浆籽蛋白质的最适超声功率。
1.2.2.2 提取温度的选择 将加入蒸馏水的毛酸浆籽溶液用NaOH 调pH 至9.0,充分搅拌混匀后水浴30 min,分别选择不同提取温度20、30、40、50、60 ℃于功率300 W的条件下超声提取20 min,计算毛酸浆籽蛋白质的提取率,确定毛酸浆籽蛋白质的最适提取温度。
1.2.2.3 提取时间的选择 将加入蒸馏水的毛酸浆籽溶液用NaOH 调pH 至9.0,充分搅拌混匀后水浴30 min,固定提取温度20 ℃,超声功率300 W,考察不同提取时间(20、30、40、50、60 min)对毛酸浆籽蛋白质提取率的影响,确定毛酸浆籽蛋白质的最适提取时间。
1.2.2.4 提取液pH的选择 将加入蒸馏水的毛酸浆籽溶液用NaOH 调节pH 分别为7.0、8.0、9.0、10.0、11.0,充分搅拌混匀后水浴30 min,在提取时间20 min,超声功率300 W,提取温度20 ℃下进行实验,计算毛酸浆籽蛋白质提取率,确定毛酸浆籽蛋白质的最适提取液pH。
1.2.3 正交试验设计 根据单因素实验结果,采用L9(34)正交设计优化毛酸浆籽蛋白质的提取条件,具体因素水平表见表1。

表1 正交试验因素水平表Table 1 Factors and levels table of orthogonal experiment
1.2.4 蛋白质提取率测定 采用考马斯亮蓝染色法测定上清液中蛋白质的含量[22],毛酸浆籽中总蛋白质含量用凯氏定氮法进行测定[23],毛酸浆籽蛋白质提取率计算公式如下:

1.2.5 毛酸浆籽蛋白质等电点测定 用1 mol/L HCl和1 mol/L NaOH 溶液将毛酸浆籽蛋白质提取液的pH 分别调至3.0、3.5、4.0、4.5、5.0、5.5,静置一段时间后,离心(4500 r/min,20 min),取上清液比色测定,吸光值最小的即为等电点。
1.2.6 毛酸浆籽蛋白质功能特性的测定
1.2.6.1 溶解性的测定 参考许英一等[24]的方法稍加修改。配制2.5%的样品溶液,滴加HCl(1 mol/L)或 NaOH 溶液(1 mol/L)使pH 分别至2.0、4.0、6.0、8.0、10.0,室温振荡30 min,于6000 r/min 条件下离心20 min,上清液中氮含量采用微量凯氏定氮法进行测定。蛋白质溶解性用氮溶解指数(NSI)来表示,计算公式如下:

1.2.6.2 乳化性的测定 参考李永恒等[25]的方法稍加修改。配制100 mL 浓度为2%的毛酸浆籽蛋白溶液,滴加HCl(1 mol/L)或 NaOH 溶液(1 mol/L)使pH 分别在3.0~10.0。分别取30 mL 溶液并加入液油体积比为4:1的大豆色拉油5 mL,用匀浆机(10000 r/min)搅拌2 min 后,从烧杯底部取样50 μL加入到0.1% SDS 溶液中,以0.1% SDS 溶液作为空白对照,于500 nm 下测定吸光值A0。乳化性(EAI)计算公式如下:
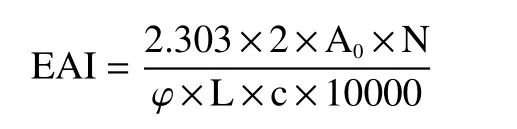
式中:A0—样品的吸光值;N—稀释倍数;φ—油相所占的体积分数;L—比色皿的光路长度,1 cm;c—毛酸浆籽蛋白质的质量浓度,g/mL。
1.2.6.3 起泡性的测定 参考李超楠等[26]的方法稍加修改。配制100 mL 浓度为2%的毛酸浆籽蛋白溶液,滴加HCl(1 mol/L)或 NaOH 溶液(1 mol/L)使pH 分别至3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0。搅拌1 h 后,以5000 r/min的转速离心15 min,用匀浆机(10000 r/min)搅拌2 min 后,立即测定泡沫体积V0,起泡性(FA)的计算公式如下:

1.3 数据处理
每个试验重复3 次,结果以平均值±标准差表示,应用SPSS 19.0 对试验数据进行显著性分析,当P<0.05 差异显著,P>0.05 无显著差异;采用Origin软件进行图表制作。
2 结果与分析
2.1 单因素实验
2.1.1 超声功率对毛酸浆籽蛋白质提取率的影响从图1 可知,当超声功率从100 W 升至200 W 过程中,毛酸浆籽蛋白质提取率随着功率的增加显著增加(P<0.05),并在功率200 W 时达到最大值63.60%。这可能是由于超声产生的空化效应使毛酸浆籽粉细胞中的结构被破坏,加速了毛酸浆籽粉中蛋白质的溶出,有利于蛋白质的提取[27]。功率在200 W 与300 W时对蛋白质提取率的影响差异不显著(P>0.05),而当超声功率高于300 W,毛酸浆籽中的蛋白质提取率开始显著降低,产生这种现象主要是因为当超声功率逐渐升高时,溶液温度也随之升高,从而导致蛋白质的结构改变,引起毛酸浆籽蛋白质破坏,从而影响蛋白质提取率[28]。因此,选择超声功率100、200、300 W 进行后续优化实验。
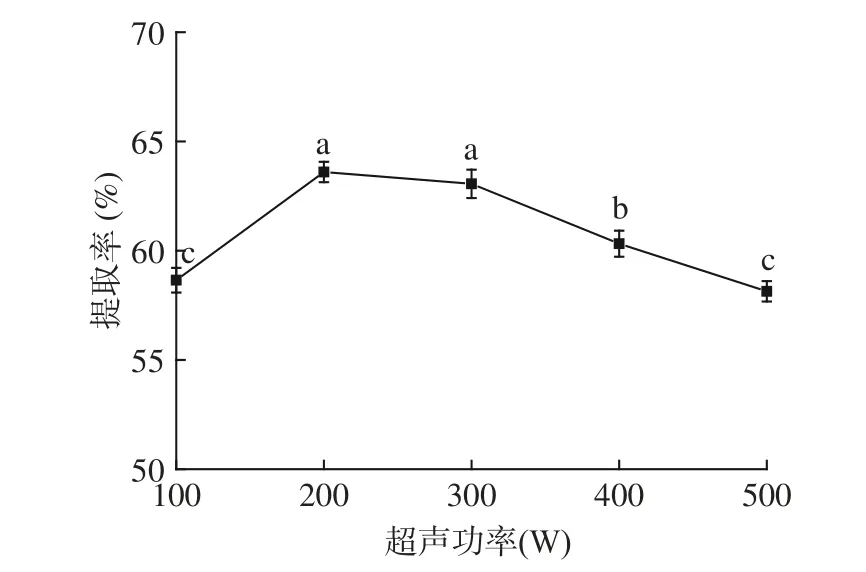
图1 超声功率对毛酸浆籽蛋白质提取率的影响Fig.1 Effect of ultrasonic power on the yield of Physalis pubescens L.seeds protein
2.1.2 提取温度对毛酸浆籽蛋白质提取率的影响由图2 可知,提取温度在20 ℃到40 ℃范围时,毛酸浆籽蛋白质的提取率显著上升(P<0.05),这是因为适当的温度有利于毛酸浆籽中的蛋白质从细胞中溶出,同时提高了毛酸浆籽蛋白质的溶解度,从而有利于毛酸浆籽蛋白质的提取。当温度高于50 ℃时,毛酸浆籽蛋白质发生变性,溶解性降低,不利于毛酸浆籽粉中蛋白质的提取[21]。因此,选择提取温度30、40、50 ℃进行后续优化实验。
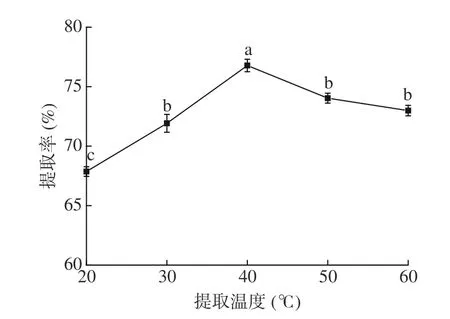
图2 提取温度对毛酸浆籽蛋白质提取率的影响Fig.2 Effect of temperature on the yield of Physalis pubescens L.seeds protein
2.1.3 提取时间对毛酸浆籽蛋白质提取率的影响由图3 可知,当提取时间由20 min 增加到50 min时,毛酸浆籽蛋白质的提取率显著上升(P<0.05),在50 min 时提取率达77.89%,随后显著下降,这可能是由于超声产生的空化作用使毛酸浆籽蛋白质在很短的一段时间内能最大限的溶出,从而增加了蛋白质的提取率;随着提取时间继续增加,可能会使蛋白质部分变性,不利于毛酸浆籽蛋白质的提取[26]。因此,选择提取时间40、50、60 min 进行后续优化实验。
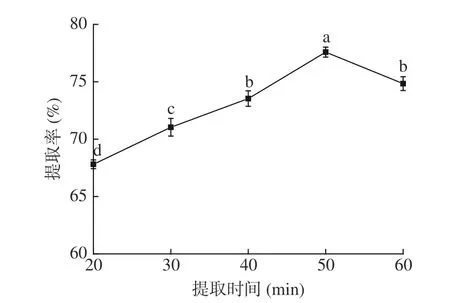
图3 提取时间对毛酸浆籽蛋白质提取率的影响Fig.3 Effect of extraction time on the yield of Physalis pubescens L.seeds protein
2.1.4 提取液pH 对毛酸浆籽蛋白质提取率的影响由图4 可知,当pH 由7.0 升至9.0 时,随着pH的增加,蛋白质提取率显著增加(P<0.05),在pH 9.0 时达到最高值68.18%,这可能是因为毛酸浆籽中的蛋白质在稀碱溶液中发生水解,蛋白质分子间相互排斥,对蛋白质分子有增溶作用,使毛酸浆籽蛋白质的提取率增加[17]。但随着提取液pH 继续增大,毛酸浆籽蛋白质的提取率呈逐渐下降的趋势,这可能是由于碱性条件增加了毛酸浆籽蛋白质的水解性,在酸沉时也会造成部分蛋白质的损失;且碱性过强会使蛋白质变性和水解,造成提取蛋白质的品质下降[24,29]。因此,选择提取液pH8、9、10 进行后续优化实验。

图4 提取液pH 对毛酸浆籽蛋白质提取率的影响Fig.4 Effect of pH on the yield of Physalis pubescens L.seeds protein
2.2 正交试验结果与分析
在单因素实验的基础上,按L9(34)正交表对毛酸浆籽蛋白质提取率的各影响因素进行正交试验,结果见表2。

表2 正交试验结果Table 2 Results of orthogonal experiment
由表2 可知,影响毛酸浆籽蛋白质提取率的各因素的主次顺序为:提取温度(A)>超声功率(D)>提取液pH(B)>提取时间(C)。最佳工艺组合为A3B2C2D3,即最佳提取条件为提取温度50 ℃、功率300 W、提取液pH 9.0、提取时间50 min。
表3 为该正交试验的方差分析结果。由表3 可知,考察的4 个因素中:提取温度对毛酸浆籽蛋白质提取率有较大的影响,差异极显著(P<0.01);提取液pH 及超声功率对毛酸浆籽蛋白质提取率的影响显著(P<0.05);而提取时间对毛酸浆籽蛋白质提取率的影响不显著(P>0.05)。

表3 正交试验方差分析表Table 3 Variance analysis of orthogonal experiment
2.3 验证性试验
为验证超声辅助法提取毛酸浆籽蛋白质的稳定性和有效性,选取由正交试验最佳工艺A3B2C2D3,即在提取时间50 min、提取温度50 ℃、提取功率300 W、提取液为pH 9.0的条件下进行稳定性试验。此工艺条件下通过实验得到毛酸浆籽蛋白质的提取率为90.45%±0.16%。因此,此工艺条件对毛酸浆籽蛋白质的提取具有较好的可行性。
2.4 毛酸浆籽蛋白质等电点的测定
由图5 可知,pH 在3.0~5.5 范围内,吸光值随pH的增加呈先下降后升高,且pH 在4.0 时的吸光值最小,说明此pH 条件下蛋白质沉淀最多,此时的pH 即为毛酸浆籽蛋白质的等电点。
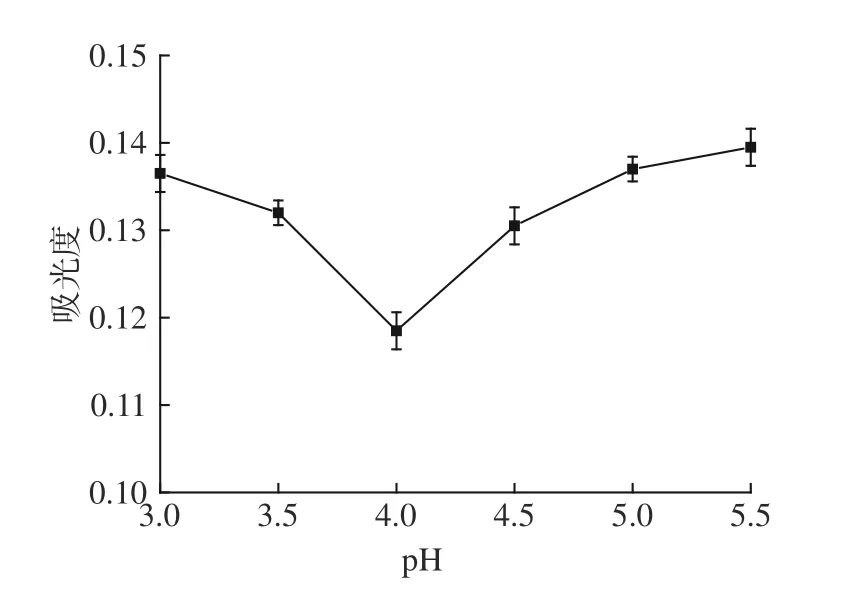
图5 毛酸浆籽蛋白质等电点的测定Fig.5 Determination of isoelectric point of Physalis pubescens L.seeds protein
2.5 毛酸浆籽蛋白质的特性研究
2.5.1 毛酸浆籽蛋白质溶解性 由图6 可知,当pH由2.0 升至10.0,毛酸浆籽蛋白质的氮溶解指数先下降后升高;pH 为4.0 时,氮溶解指数达到最小值14.59%。这可能是因为在等电点(pH4.0)附近时,蛋白质分子内的净电荷为0,分子颗粒间相互作用力减弱而发生碰撞、聚集,产生沉淀,此时蛋白质的溶解度最低;当pH 远离等电点时,蛋白质与水分子之间的相互作用增强,蛋白质的水溶性提高,从而增加了蛋白质的溶解性[24,30]。在pH 为10.0 时,氮溶解指数达到最高值58.32%。
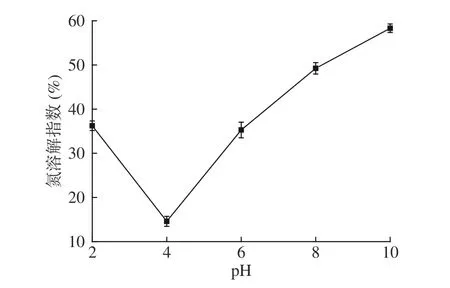
图6 pH 对毛酸浆籽蛋白质溶解性的影响Fig.6 Effect of pH on solubility of Physalis pubescens L.seeds protein
2.5.2 毛酸浆籽蛋白质乳化性研究 由图7 可知,毛酸浆籽蛋白质的乳化性随pH的增加先降低后升高,在pH 为4.0 时呈现最小值,这可能是因为处于等电点附近时毛酸浆籽蛋白质的溶解度最低,且无净电荷,所以蛋白质乳化能力较弱[31]。在pH 为10.0 时,乳化性达到68.94 m2/g。
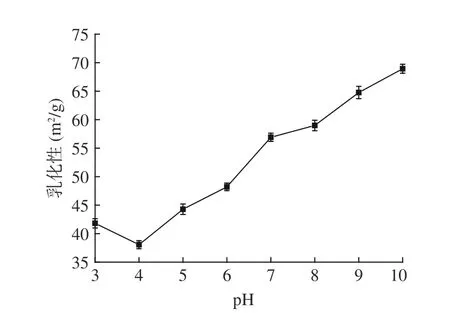
图7 pH 对毛酸浆籽蛋白质乳化性的影响Fig.7 Effect of pH on emulsification of Physalis pubescens L.seeds protein
2.5.3 毛酸浆籽蛋白质起泡性研究 由图8 可知,当pH 由3.0 升至7.0,毛酸浆籽蛋白质的起泡性先降低后升高。pH 为4.0 时呈现最小值,这可能是因为在等电点附近时未溶解的毛酸浆籽蛋白质较多,起泡性较弱。而在pH7.0 时呈现最大值43%,但继续增加pH,则起泡性又降低,说明过酸或过碱条件都不利于毛酸浆籽蛋白质的起泡。
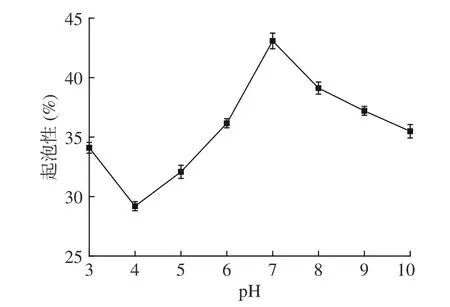
图8 pH 对毛酸浆籽蛋白质起泡性的影响Fig.8 Effect of pH on foaming characteristic of Physalis pubescens L.seeds protein
3 结论
本研究在单因素实验基础上,通过正交试验优化了超声辅助法提取毛酸浆籽中蛋白质的提取条件,即在提取温度50 ℃、功率300 W、提取液pH 9.0、提取时间50 min的条件下,毛酸浆籽蛋白质的提取率可达90.45%±0.16%。超声辅助法提取毛酸浆蛋白质的功能特性表明,在等电点pH4.0 附近,毛酸浆籽蛋白质的溶解性、起泡性和乳化性最弱,pH 为7.0 时,毛酸浆籽蛋白质的起泡性最好,且毛酸浆籽蛋白质在强碱性溶液中有较好溶解性。后续将进一步研究毛酸浆籽蛋白质的结构和凝胶特性。
